Содержание страницы
К этой группе пищевых добавок относятся вещества, используемые для создания необходимых или изменения существующих реологических свойств пищевых продуктов, то есть добавки, регулирующие или формирующие их консистенцию.
К ним принадлежат добавки различных функциональных классов:
- загустители,
- гелеобразователи,
- стабилизаторы физического состояния пищевых продуктов,
- поверхностно-активные вещества (ПАВ), в частности эмульгаторы и пенообразователи.
Химическая природа пищевых добавок, отнесенных к этой группе, достаточно разнообразна. Среди них имеются продукты природного происхождения, а также продукты, получаемые искусственным путем, в том числе химическим синтезом. В пищевой технологии они используются в виде индивидуальных соединений или смесей.
В последние годы в группе пищевых добавок, регулирующих консистенцию, большое внимание стало уделяться стабилизационным системам, включающим несколько компонентов: эмульгатор, стабилизатор, загуститель. Их качественный состав, соотношение компонентов могут быть весьма разнообразными, что зависит от характера пищевого продукта, его консистенции, технологии получения, условий хранения, способа реализации.
Применение в современной пищевой технологии таких добавок позволяет создать ассортимент продуктов эмульсионной и гелевой природы (маргарины, майонезы, соусы, пастила, зефир, мармелад и др.), структурированных и текстурированных.
Стабилизационные системы широко применяются в общественном и домашнем питании, кулинарии. Они используются при производстве супов (сухие, консервированные, замороженные), соусов (майонезы, томатные соусы), бульонных продуктов, продуктов для консервированных блюд.
1. Загустители и гелеобразователи
Эта группа пищевых добавок включает соединения двух функциональных классов: а) загустители — вещества, используемые для повышения вязкости продукта; б) гелеобразователи — соединения, придающие пищевому продукту свойства геля (структурированной высокодисперсной системы с жидкой дисперсионной средой, заполняющей каркас, который образован частицами дисперсной фазы).
Загустители и гелеобразователи, введенные в жидкую пищевую систему в процессе приготовления пищевого продукта, связывают воду, в результате чего пищевая коллоидная система теряет свою подвижность и консистенция пищевого продукта изменяется. Эффект изменения консистенции (повышение вязкости или гелеобразование) будет определяться, в частности, особенностями химического строения введенной добавки.
По химической природе добавки этой группы являются полимерными соединениями, в макромолекулах которых равномерно распределены гидрофильные группы, взаимодействующие с водой. Они могут участвовать также в обменном взаимодействии с ионами водорода и металлов (особенно кальция), а кроме того, с органическими молекулами меньшей молекулярной массы.
Перечень загустителей и гелеобразователей, разрешенных к применению в производстве пищевых продуктов в России, включает 50 добавок.
Как уже отмечалось, главной технологической функцией добавок этой группы в пищевых системах является повышение вязкости или формирование гелевой структуры различной прочности. Одним из основных свойств, определяющих эффективность применения таких веществ в конкретной пищевой системе, является их полное растворение, которое зависит прежде всего от химического строения. Поскольку большинство представителей этой группы относится к соединениям полисахаридной природы и содержит значительное количество гидроксильных групп, они являются гидрофильными и в основном растворимы в воде.
Растворимость повышается в присутствии ионизированных групп — сульфатных и карбоксильных, увеличивающих гидрофильность (каррагинаны, альгинаты), а также при наличии в молекулах полисахаридов боковых цепей, раздвигающих главные цепи, что улучшает гидратацию (ксантаны). Растворению способствует механическое воздействие (перемешивание) и нагревание. Растворимость понижается в присутствии факторов, способствующих образованию связей между полисахаридными цепями, к которым относятся наличие неразветвленных зон и участков без ионизированных групп (камедь рожкового дерева), а также присутствие ионов кальция или других поливалентных катионов, вызывающих поперечное сшивание полисахаридных цепей (пектины).
Многие представители этой группы пищевых добавок имеют смежную технологическую функцию стабилизатора, поскольку повышение вязкости дисперсной пищевой системы при введении в нее загустителя или превращение такой системы в слабый гель при низких концентрациях гелеобразователя способствует предотвращению ее разделения на исходные компоненты (например, выпадение в осадок твердых частиц, диспергированных в жидкой дисперсионной среде).
Подавляющее большинство загустителей и гелеобразователей со статусом пищевых добавок относится к классу полисахаридов (гликанов). Одним из немногих исключений среди гелеобразователей является имеющий белковую природу желатин, который относится не к добавкам, а к пищевым ингредиентам.
В зависимости от особенностей химического строения загустители и гелеобразователи полисахаридной природы могут быть подразделены по различным классификационным признакам (табл. 1).
К основным представителям относятся модифицированные крахмалы и целлюлозы, пектины, полисахариды морских водорослей, камеди и некоторые другие.
Таблица 1. Классификация пищевых добавок полисахаридной природы в зависимости от структуры
| Kлассификационный признак | Характеристика | Основные представители |
| Строение полимерной цепи | Линейное | Альгинаты, каррагинаны, модифицированные целлюлозы, фурцеллеран, пектины |
| Разветвленное | Галактоманнаны (гуаровая камедь и камедь рожкового дерева), ксантаны, гуммиарабик, камедь карайи, трагакант | |
| Природа мономерных остатков | Гомогликаны
Гетерогликаны |
Модифицированные целлюлозы, модифицированные крахмалы Альгинаты, каррагинаны, галактоманнаны, пектины |
| Тригетерогликаны | Kсантаны, камедь карайи, геллановая камедь | |
| Тетрагетерогликаны | Гуммиарабик | |
| Пентагетерогликаны | Kамедь гхатти, трагакант | |
| Заряд | Нейтральный | Производные целлюлозы, амилопектины, галактоманнаны |
| Анионный (кислотный) | Альгинаты, каррагинаны, пектины, ксантаны, трагакант, камедь карайи, гуммиарабик, фурцеллеран |
2. Модифицированные крахмалы
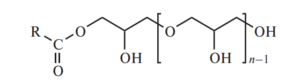
В отличие от нативных растительных крахмалов, считающихся пищевыми продуктами, большинство модифицированных крахмалов (Е1400– Е1451) относится к пищевым добавкам. В группу модифицированных крахмалов объединены продукты фракционирования, деструкции и различных модификаций нативных крахмалов, представляющих собой преимущественно смесь двух фракций гомоглюканов (полимеров глюкозы) линейного и разветвленного строения — амилозы и амилопектина:
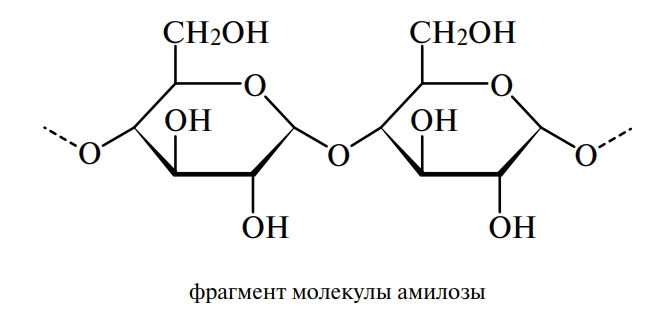
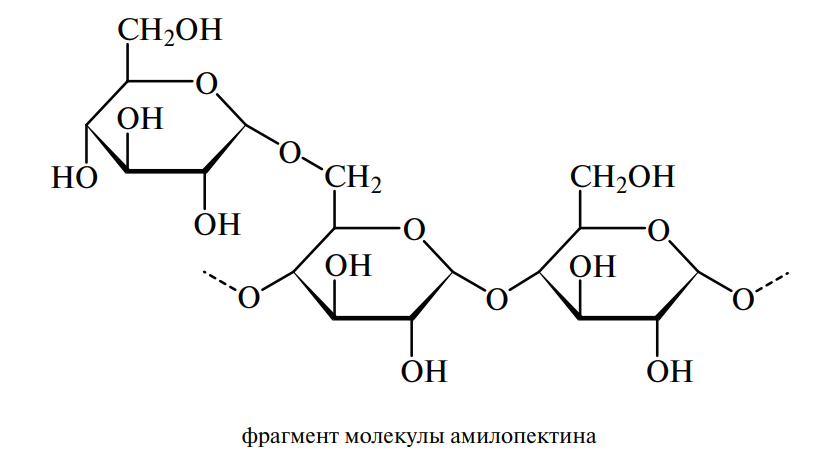
Краткая характеристика основных фракций крахмала приведена в табл. 2.
Особенности химического строения и свойств этих фракций, а также их соотношение в нативном крахмале, зависящее от вида растительного источника (картофель, рис, кукуруза и т. п.), определяют основное технологическое свойство нативного крахмала — способность растворяться при нагревании в воде с образованием вязких коллоидных растворов (клейстеров).
Однако свойства таких клейстеров часто не соответствуют необходимым требованиям; например, нативные кукурузные крахмалы образуют слабые, резиноподобные клейстеры и нежелательные гели в процессе термической обработки. Типичным для клейстеров, образованных нативными крахмалами, является также процесс с инерезиса — сокращение объема с выделением жидкой фазы в результате самопроизвольного уплотнения структурной сетки.
Различные способы обработки (физические, химические, биологические) нативных крахмалов позволяют существенно изменить их строение, что отражается на растворимости и свойствах клейстеров, например их устойчивости к нагреванию, воздействию кислот и т. п.
Таблица 2. Краткая характеристика основных фракций крахмала

Реакционноспособными центрами в полимерных молекулах крахмалов являются:
- гидроксильные группы глюкозных структурных единиц, активность которых по отношению к химическим реагентам изменяется в ряду: OH при C-6 OH при C-2 OH при C-3;
- α-гликозидные связи, соединяющие глюкозные структурные единицы в полимерные цепи;
- концевые остатки D-глюкопираноз, обладающие восстанавливающей способностью.
По изменениям, происходящим в нативных крахмалах, можно выделить четыре основных типа модификаций, позволяющих путем физических или химических воздействий получить различные виды модифицированных крахмалов (табл. 6).
Набухающие крахмалы. Инстант-крахмал ы, т. е. крахмалы, способные растворяться в холодной воде, получают путем физических превращений, не вызывающих существенной деструкции крахмальных молекул. В общем случае их получают нагреванием крахмальной суспензии в условиях, обеспечивающих быструю клейстеризацию и последующее высушивание клейстера, в связи с чем эти крахмалы называют также преклейстерными. Такие условия достигаются при вальцовой сушке или экструзии.
Таблица 3. Основные виды модифицированных крахмалов
| Тип модификации | Основные группы | Основные подгруппы |
| Набухание | Набухающие крахмалы | Растворимые в холодной воде (инстанткрахмалы), полученные:
Набухающие в холодной воде |
| Деполимеризация | Расщепленные крахмалы | Декстрины:
|
| Стабилизация | Стабилизированные крахмалы | Со сложной эфирной связью:
С простой эфирной связью — оксиалкильные |
| Поперечное сшивание полимерных цепей | Сшитые крахмалы | Сшитые:
|
Инстант-крахмалы сохраняют статус пищевых ингредиентов, поэтому они не включены в перечень пищевых добавок и не имеют персонального цифрового кода. Одна из основных областей их применения — пудинги быстрого приготовления.
Крахмалы, набухающие в холодной вод е, получают термообработкой нативного кукурузного крахмала в 75–90 %-ном этаноле при температуре 150–175 °С в течение 1,5–2,0 ч или высушиванием крахмальной суспензии в распылительной сушилке.
Аналогично инстант-крахмалам, продукты этого способа модификации также не относятся к пищевым добавкам.
Способность крахмалов набухать в холодной воде без дополнительного нагревания используют в технологии различных десертов, желейного мармелада, сдобного теста, содержащего ягоды, которые в отсутствии стабилизатора оседают на дно до начала выпечки.
Основой для получения растворимых и набухающих крахмалов могут служить как нативные, так и химически модифицированные. В последнем случае получаемые набухающие крахмалы сохраняют свойства, достигнутые при химической модификации, например проявляют устойчивость в кислой среде, стабильность в циклах замораживания и оттаивания. Такие крахмалы позиционируются как пищевые добавки с кодами, соответствующими видам химической модификации.
Расщепленные крахмалы. Они представляют собой продукты, имеющие, вследствие физических или химических воздействий, более короткие (по сравнению с нативными крахмалами) молекулярные цепи. К этой группе относятся декстрины, продукты кислотного или ферментативного гидролиза, а также окисленные крахмалы.
Декстрины (Е1400) получают при сухом нагревании нативных крахмалов в присутствии кислотных катализаторов или без них. В зависимости от условий термообработки образуются белые или желтые декстрины.
Гидролизованные крахмалы получают обработкой крахмальных суспензий растворами кислот или гидролитических ферментов амилаз. Состав и свойства таких крахмалов зависят от условий гидролиза. Основная область использования этих крахмалов — кондитерские изделия: пастила и желе, жевательные резинки.
Состав и свойства о кисленных крахмалов определяются выбором окислителей, в качестве которых могут использоваться H2O2, KMnO4, HClO3, KIO4 и некоторые другие. Как и кислоты, окисляющие агенты приводят к образованию крахмалов с более короткими молекулярными цепями.
В зависимости от условий окислению могут подвергаться как первичные, так и вторичные группы глюкопиранозных структурных единиц:
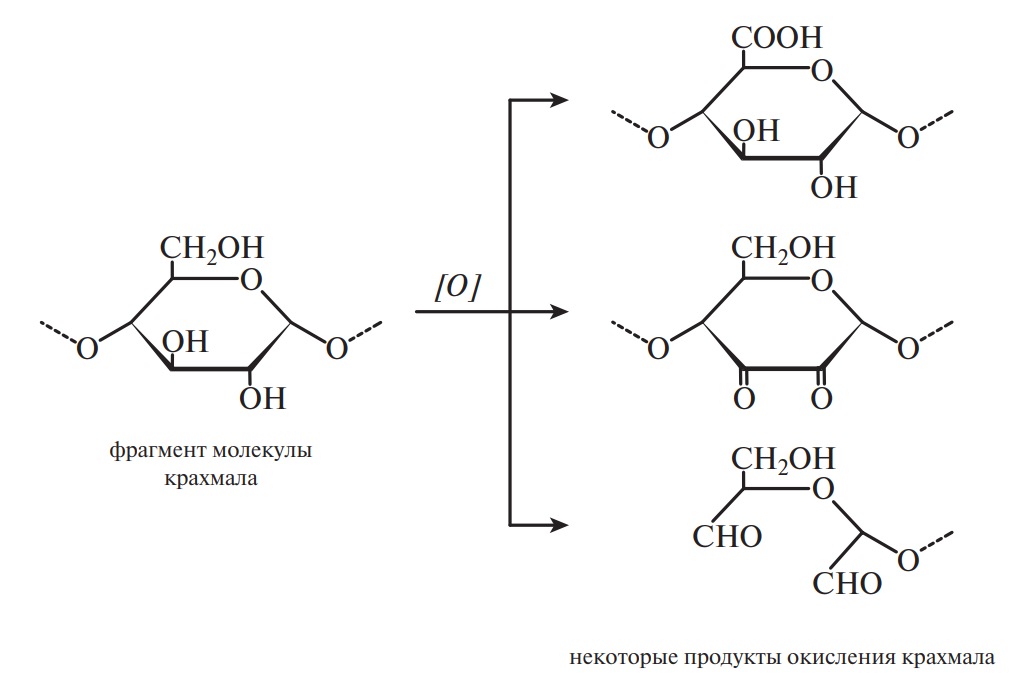
Их используют для стабилизации мороженого, при производстве мармеладов, лукума, а также в хлебопечении. Разбавленные растворы высокоокисленных крахмалов сохраняют прозрачность в течение длительного хранения, что делает их ценными добавками при приготовлении прозрачных супов.
Стабилизированные крахмалы. Они представляют собой продукты химической модификации монофункциональными реагентами с образованием по гидроксильным группам производных с простой или сложной эфирной связью. Такие производные, несмотря на невысокую степень замещения гидроксильных групп (0,002–0,2), отличаются от нативных крахмалов значительно меньшей склонностью к межмолекулярным ассоциациям и получили название стабилизированных.
Основные виды модифицированных крахмалов этой группы, а также их отличительные свойства представлены в табл. 4.
Сложные эфиры крахмалов получают реакцией этерификации между спиртовыми группами молекул крахмала и ацилирующими или фосфорилирующими агентами. В качестве ацилирующих агентов обычно используют ангидриды карбоновых кислот.
При получении эфира крахмала и натриевой соли октенилянтарной кислоты процесс осуществляют в две стадии. Первоначально в молекулу янтарной кислоты вводят углеводородный радикал с образованием 1-октенилпроизводного, которое затем взаимодействует с молекулой крахмала, что приводит к образованию моноэфира с низкой степенью замещения гидроксильных групп.
Таблица 4. Этерифицированные пищевые крахмалы
| Этерифицированные крахмалы | Эфирные группы | Главные характеристики |
| Сложные эфиры | ||
| Ацетилированные | 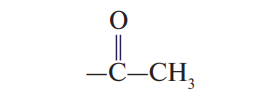 |
Повышенная прозрачность и стабильность клейстера при низких температурах, облегченная тепловая обработка |
| Фосфорилированные | 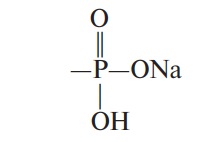 |
Повышенная прозрачность и стабильность клейстера, стойчивость к замораживанию– оттаиванию |
| Этерифицированные октенилянтарной кислотой | 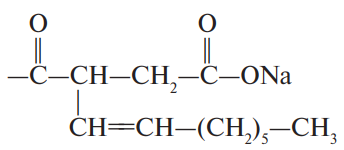 |
Эмульгирующая и стабилизирующая способность |
| Простые эфиры | ||
| Гидроксипропилированные | 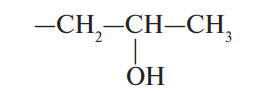 |
Повышенная прозрачность и стабильность клейстера, устойчивость к замораживанию–оттаиванию, облегченная тепловая обработка |
Введение в молекулу крахмала углеводородных (алкенильных) фрагментов сопровождается возникновением разделенных между собой гидрофобных участков. Вследствие этого такие молекулы становятся поверхностно-активными и приобретают способность, концентрируясь на границах раздела фаз, образовывать, а также стабилизировать (благодаря полимерному строению) различные дисперсные системы, в частности эмульсии.
Простые эфиры крахмалов для пищевых целей получают взаимодействием нативного крахмала с окисью пропилена до степени замещения гидроксильных групп, соответствующей 0,02–0,2. По своим свойствам гидроксипропилкрахмалы (Е1440) аналогичны ацетилированным модификациям, имеют пониженную температуру гелеобразования, повышенную прозрачность клейстеров, такую же устойчивость к ретроградации.
Сшитые крахмалы. Значительное число модифицированных пищевых крахмалов относится к подгруппе сшитых. Поперечное сшивание отдельных крахмальных молекул между собой происходит в результате взаимодействия их гидроксильных групп с бифункциональными реагентами.
Для пищевых целей используют, главным образом, три вида межмолекулярно-сшитых крахмалов — дикрахмальные эфиры фосфорной и адипиновой кислот, а также дикрахмалглицерины:
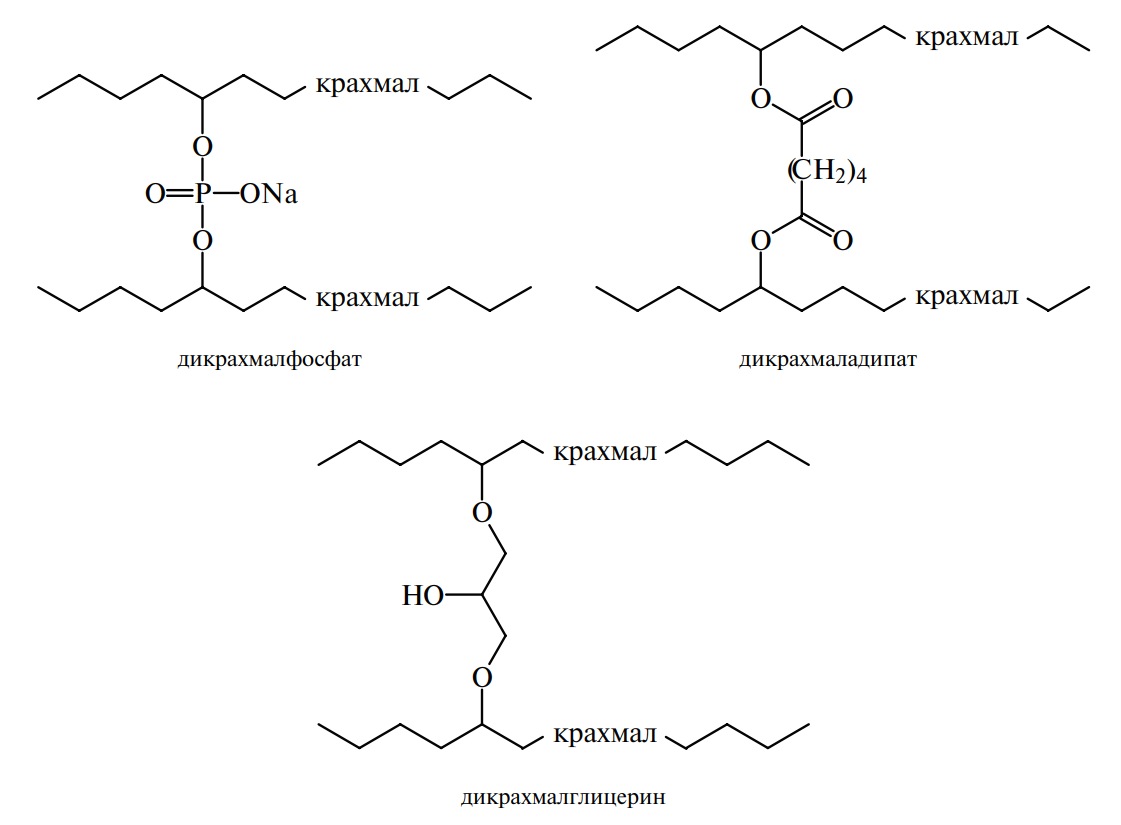
В большинстве сшитых пищевых крахмалов содержится не более одной поперечной связи на каждую тысячу глюкопиранозных остатков, что оказывается достаточным для значительного изменения свойств модифицированных крахмалов по сравнению с исходными. Крахмалы этой подгруппы имеют пониженную скорость набухания и клейстеризации, что создает эффект пролонгированного действия. Клейстеры поперечно-сшитых крахмалов являются более вязкими, имеют «короткую» текстуру, устойчивы к различным внешним воздействиям — высоким температурам, длительному нагреванию, низким рН, механическим нагрузкам.
Устойчивость к подкислению и физическим воздействиям пропорциональна количеству поперечных связей.
Благодаря таким свойствам сшитые крахмалы особенно эффективны в пищевых технологиях, включающих продолжительную термическую обработку, интенсивные механические воздействия, а также в технологиях, где требуется пролонгирование процессов набухания крахмальных гранул, повышения вязкости и формирования текстуры. К таким технологиям относятся получение экструдированных продуктов, консервирование методом стерилизации, различные выпечки (например, выпечка открытых пирогов с фруктовыми начинками), производство консервированных супов и т. п.
3. Целлюлоза и ее производные
В группу пищевых добавок целлюлозной природы (Е460–Е467) входят продукты механической и химической модификации и деполимеризации нативной целлюлозы, представляющей собой линейный полимер, который состоит из соединенных β-(1→4)-гликозидными связями остатков D-глюкопиранозы.
Наличие β-гликозидной связи приводит на уровне вторичных и третичных структур (конформации полимерных цепей, упаковки цепей в фибриллы) к формированию линейных молекул с зонами кристалличности (высокоориентированными участками), включающими отдельные аморфные (неориентированные) участки. Такое строение обусловливает большую механическую прочность волокон целлюлозы и их инертность по отношению к большинству растворителей и реагентов.
Собственно целлюлоза используется в качестве пищевой добавки Е460 в двух модификациях:
- Е460i — микрокристаллическая целлюлоза (частично гидролизованная кислотой по аморфным участкам, наиболее доступным для атаки реагентами, и затем измельченная; отличается укороченными молекулами);
- E460ii — порошкообразная целлюлоза, выделенная из растительного сырья (древесины, хлопка и т. п.) удалением сопутствующих веществ (гемицеллюлоз и лигнина) и затем измельченная.
Основные технологические функции целлюлозы — эмульгатор и текстуратор, добавка, препятствующая слеживанию и комкованию.
Химическая модификация молекул целлюлозы приводит к изменению свойств и, как следствие, к изменению функций в пищевых системах. В образовании производных целлюлозы большую роль играет доступность и реакционная способность гидроксильных групп β-D-глюкопиранозных остатков. По реакционной способности гидроксильные группы располагаются в последовательности: OH при C-6 > OH при C-2 > OH при C-3.
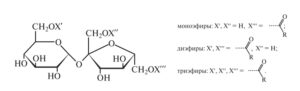
Статус пищевых добавок имеют семь химических модификаций целлюлозы, представляющих собой моноили дипроизводные с простой эфирной связью (простые эфиры). В общем виде модифицированные целлюлозы могут быть описаны следующей формулой:
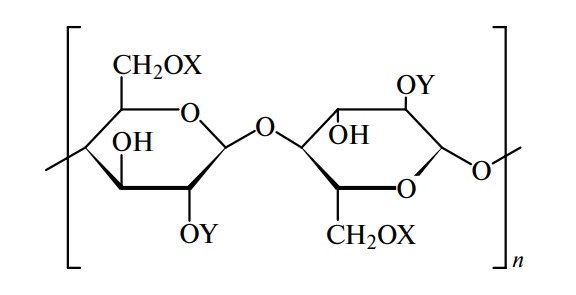
Cтроение и технологические функции этих целлюлоз представлены в табл. 5.
Получение простых эфиров целлюлозы включает стадию повышения ее реакционной способности, поскольку плотная упаковка целлюлозных волокон в целом препятствует взаимодействию гидроксильных групп с молекулами реагента. С этой целью целлюлозу подвергают набуханию или переводят в растворимое состояние. В промышленных условиях процесс ведут в гетерофазной среде (дисперсия целлюлозы в ацетоне или изопропиловом спирте), обрабатывая целлюлозу раствором едкого натра при температуре 50–140 °С с образованием алкалицеллюлозы (процесс мерсеризации).
Таблица 5. Модифицированные целлюлозы и их технологические функции
| Kод | Название | Х | Y | Технологические функции |
| Е461 | Метилцеллюлоза | —СН3 | —H | Загуститель, стабилизатор, эмульгатор |
| Е462 | Этилцеллюлоза | —СН2СН3 | —H | Наполнитель, связующий агент |
| Е463 | Гидроксипропилцеллюлоза | —СН2СН(OH)СН3 | —H | Загуститель, стабилизатор, эмульгатор |
| Е464 | Гидроксипропилметилцеллюлоза | —СН2СН(OH)СН3 | —CH3 | То же |
| Е465 | Метилэтилцеллюлоза | —СН3 | —CH2CH3 | Загуститель, стабилизатор, эмульгатор, пенообразователь |
| Е466 | Kарбоксиметилцеллюлоза (натриевая соль) | —СН2СООNa | —H | Загуститель, стабилизатор |
| Е467 | Этилгидроксиэтилцеллюлоза | —CH2CH3 | —CH2CH2OH | Эмульгатор, стабилизатор, загуститель |
| Е468 | Кроскарамеллоза | — | — | Стабилизатор, носитель |
| Е469 | Карбоксиметилцеллюлоза ферментативно гидролизованная | — | — | Загуститель, стабилизатор, носитель |
Получение пищевых производных целлюлозы осуществляют взаимодействием полученной алкалимодификации с галогеналкилами (получение метилированных и этилированных производных) или соответствующими эпоксидами (эпоксид этилена, эпоксид пропилена) для получения гидроксиэтил- и гидроксипропилпроизводных:
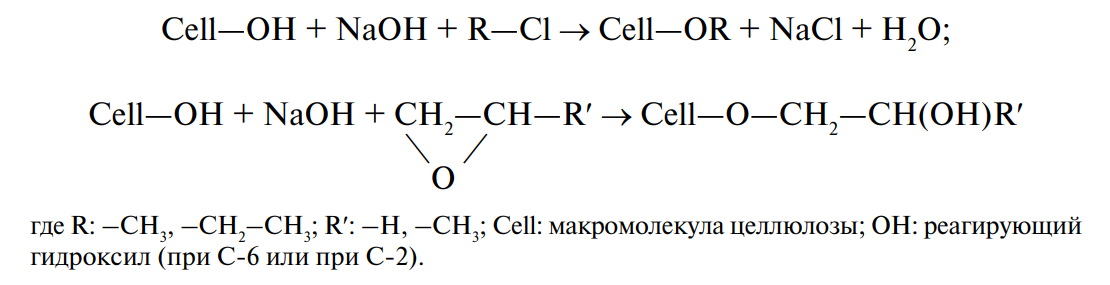
Комбинируя исходные реагенты, получают смешанные производные целлюлозы, например метилэтилцеллюлозу, метилгидроксипропилцеллюлозу и др.
Пищевые добавки целлюлозной природы являются безвредными, поскольку не подвергаются в желудочно-кишечном тракте деструкции и выделяются без изменений. Дневной суммарный прием с пищей всех производных целлюлозы может достигать 25 мг на килограмм массы тела человека. Их дозировки в пищевых продуктах определяются конкретными технологическими задачами.
Традиционно эти добавки используются при изготовлении хлебобулочных и кондитерских изделий, молочных и низкожирных эмульсионных продуктов, а также безалкогольных напитков, где они выступают в качестве эмульгаторов и стабилизаторов многокомпонентных дисперсных систем, суспензий и эмульсий, обеспечивают необходимые консистенцию и вкусовые свойства.
4. Пектины
Пектины наряду с галактоманнанами (гуаровой камедью и камедью рожкового дерева) являются основными представителями группы гетерогликанов высших растений.
Пектинами (Е440) называется группа высокомолекулярных гетерогликанов (от греч. pektos — свернувшийся, замерзший), которые входят в состав клеточных стенок и межклеточных образований высших растений и через боковые цепочки соединены с гемицеллюлозами, например галактаном, а затем с волокнами целлюлозы. В такой связанной форме, имеющей название «протопектины», они нерастворимы в воде.
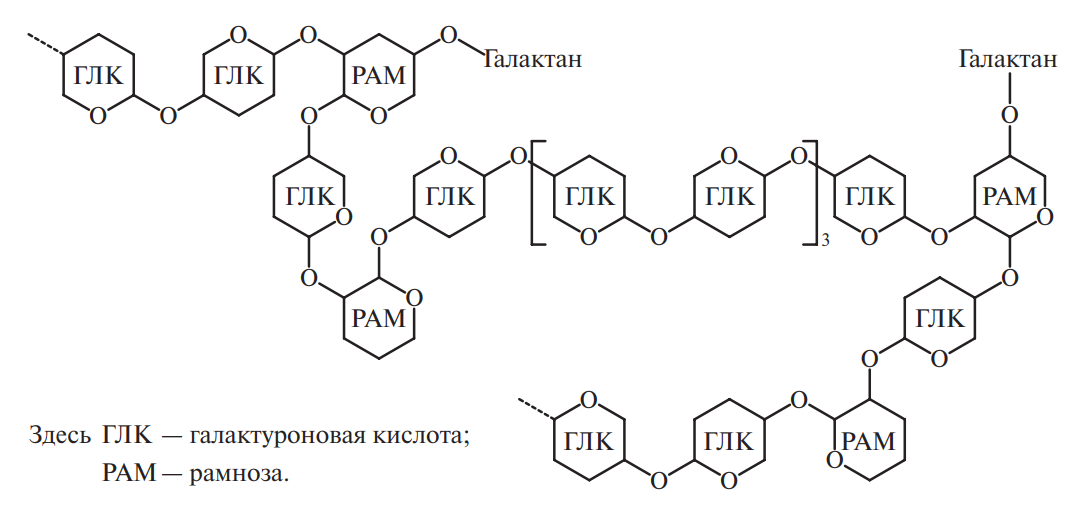
По химической природе пектины представляют собой гетерополисахариды, основу которых составляют рамногалактуронаны. Главную цепь полимерной молекулы образуют производные полигалактуроновой (пектовой) кислоты (полиурониды), в которой остатки D-галактуроновой кислоты связаны α-(1→4)- гликозидной связью. Основная цепочка полигалактуроновой кислоты в растворе имеет вид спирали, содержащей три молекулы галактуроновой кислоты в одном витке.
В цепь полигалактуроновой кислоты неравномерно через α-(1→2)-гликозидные связи включаются молекулы L-рамнозы (6-дезокси-L-маннопиранозы), что придает полимерной молекуле зигзагообразный характер. Схематичное изображение фрагмента рамногалактуронана:
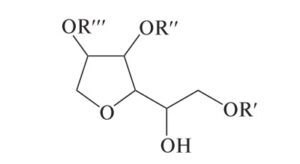
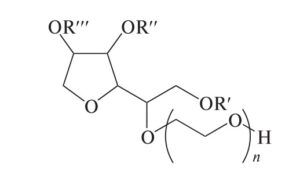
Часть карбоксильных групп полигалактуроновой кислоты обычно этерифицирована метанолом (пектиновая кислота), а часть вторичных спиртовых групп (С-2 и С-3) в отдельных случаях ацетилирована. Молекулы пектинов содержат обычно от нескольких сотен до тысячи мономерных остатков, что соответствует средней молекулярной массе от 50 000 до 150 000. Путем химических модификаций часть свободных карбоксильных групп может быть переведена в амидированную форму (амидированные пектины). Фрагменты молекул пектовой и пектиновой кислот представлены на рис. 1. Соли пектовой кислоты получили название пектаты, соли пектиновой — пектинаты.
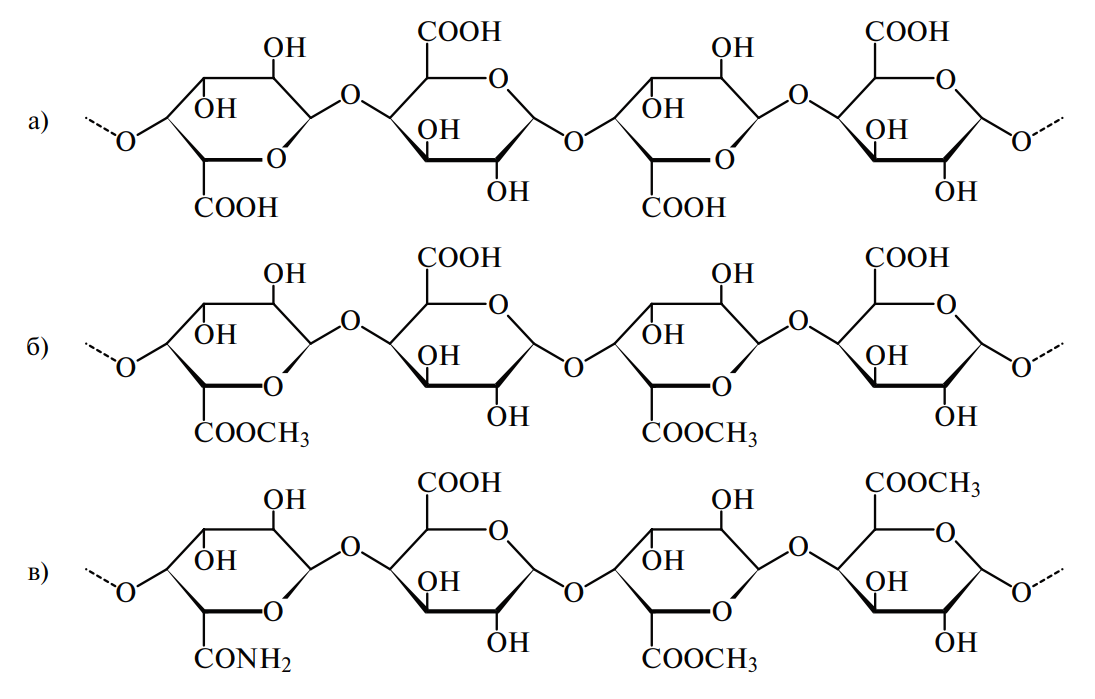
Рис. 1. Фрагменты пектиновых молекул: а — пектовая кислота; б — пектиновая кислота; в — амидированный пектин
В промышленности пектины получают кислотным или ферментативным гидролизом (обменной реакцией между веществом, в данном случае пектинсодержащим материалом, и водой) в условиях, обеспечивающих расщепление гликозидных связей, соединяющих пектиновые молекулы с нейтральными полисахаридами и не затрагивающих более прочные гликозидные связи в полимерной пектиновой молекуле, а также сложноэфирные связи в молекулах высокоэтерифицированных пектинов.
В классических способах гидролиз осуществляют растворами минеральных кислот (HCl, H2SO4, HNO3, H3PO4) при рН около 2 и температуре около 85 °С в течение 2–2,5 ч. При этом молекулы рамногалактуронанов переходят в раствор, откуда, после очистки и концентрирования, их извлекают различными технологическими приемами, например осаждением из этанола. Осажденный пектин сушат, измельчают и стандартизуют добавлением глюкозы (декстрозы) или ретардатора — соли одновалентного катиона и пищевой кислоты (молочной, винной, лимонной), замедляющей процесс гелеобразования.
В некоторых случаях степень этерификации выделенных пектинов специально понижают, для чего концентрированный жидкий экстракт подвергают контролируемой деэтерификации кислотным, щелочным или ферментативным (с помощью фермента пектинэстеразы) способами. Наиболее быстрым является способ щелочной деэтерификации под действием гидроксида натрия или аммиака (процесс аммонолиза).
В зависимости от степени этерификации пектины условно подразделяют на две подгруппы: высокоэтерифицированные (степень этерификации более 50 %) и низкоэтерифицированные (степень этерификации менее 50 %).
В настоящее время выпускается несколько видов пектинов, выделяемых из различных источников сырья и различающихся по составу и функциональным свойствам: высокоэтерифицированные (яблочный, цитрусовый), низкоэтерифицированные (свекловичный, из корзинок подсолнечника), а также комбинированные пектины из смешанного сырья различной степени этерификации.
Указанные пектины отличаются и характером распределения карбоксильных групп по длине пектиновой молекулы: в яблочных пектинах это распределение равномерно, а, например, в цитрусовых — нет.
Из низкоэтерифицированных пектинов более востребованными являются неамидированные, которые используют при приготовлении, например, сухих киселей, диабетических кондитерских изделий.
Особенности химического строения пектиновых молекул, в частности степень этерификации, определяют различия их физико-химических свойств, основными среди которых являются растворимость, гелеобразующая способность и способность взаимодействовать с катионами металлов и белками.
Растворимость пектинов в воде повышается с увеличением степени этерификации их молекул и уменьшением молекулярной массы. Пектовая кислота, в молекуле которой не содержится этерифицированных карбоксильных групп, в воде нерастворима.
При комнатной температуре в условиях интенсивного перемешивания в 100 мл воды растворяется от 4 до 8 г пектина, при температуре 60–80 °С — около 10 г, то есть максимальная концентрация водных растворов пектина может составлять 10 %. Растворимость повышается в присутствии сахаров. Из-за наличия в пектиновых молекулах диссоциирующих свободных карбоксильных групп их водные растворы имеют кислую реакцию (для 2,5 %-ного раствора пектина рН около 3).
Образование гелевой структуры в растворах пектинов происходит в результате взаимодействия пектиновых молекул между собой и зависит от особенностей строения молекулы — молекулярной массы, степени этерификации, характера распределения карбоксильных групп. Кроме этого, на процесс гелеобразования оказывают влияние температура, рН среды и содержание дегидратирующих веществ.
Формирование пространственной структуры геля может происходить двумя путями: а) за счет изменения сил электростатического отталкивания пектиновых молекул в присутствии дегидратирующих веществ (сахарозы) в кислой среде (сахарно-кислотное гелеобразование); б) с участием ионов поливалентных металлов.
Тип ассоциации пектиновых молекул определяется степенью этерификации. Высокоэтерифицированные пектины образуют гели в присутствии кислоты (рН 3,1–3,5) при содержании сухих веществ (сахарозы) не менее 65 %, низкоэтерифицированные — как по первому типу, так и в присутствии ионов поливалентных металлов, например кальция, независимо от содержания сахарозы, в широком диапазоне рН (от 2,5 до 6,5). Пектины высокой степени этерификации образуют высокоэластичные гели, которые имеют тенденцию возвращаться в исходное состояние после изменения формы при механическом сдвиге.
Пектины низкой степени этерификации, в зависимости от концентрации ионов кальция, могут давать различные по консистенции гели — от высоковязких (не восстанавливающих исходную форму после деформирования) до высокоэластичных.
Комплексообразующая способность (образование циклических комплексов поливалентных металлов) различных пектинов зависит от содержания свободных карбоксильных групп, то есть степени этерификации пектиновых молекул, и не зависит от их молекулярной массы.
Способность пектиновых молекул связывать поливалентные катионы увеличивается при снижении степени их этерификации и повышении степени диссоциации свободных карбоксильных групп (то есть при повышении рН среды), а по отношению к различным металлам изменяется в ряду (A. J. Paskins-Hurlburt et al., 1977):
Mg — Mn — Cr — Hg — Fe — Ni — Co — Cu — Zn — Sr — Cd — Ba — Pb.
Молекулы высокоэтерифицированных пектинов могут образовывать пектин-протеиновые комплексы. При рН 4,0–4,2 они вступают во взаимодействие с молекулами казеина молока, что приводит к изменению общего заряда белковых молекул и обеспечивает их физическую стабильность в кислой среде.
Кроме того, пектины, как растворимые пищевые волокна, являются физиологически ценными (функциональными) ингредиентами, присутствие которых в пищевых продуктах традиционного рациона способствует улучшению состояния здоровья человека. Специфическое физиологическое воздействие растворимых пищевых волокон связано с их способностью снижать уровень холестерина в крови, нормализовать деятельность желудочно-кишечного тракта, связывать и выводить из организма некоторые токсины и тяжелые металлы. Рекомендуемое суточное потребление пектиновых веществ в рационе здорового человека составляет 5–6 г.
5. Галактоманнаны: камедь рожкового дерева, гуаровая камедь
Галактоманнаны представляют собой гетерогликаны, содержащиеся в семенах стручковых растений и выполняющие функцию предотвращения обезвоживания семян. Коммерческие препараты растительных галактоманнанов получили название камеди. Наиболее распространенными в качестве пищевых добавок в этой группе являются галактоманнаны семян двух видов растений — гуара (Cyamopsis tetragonolobus), произрастающего в Индии и Пакистане, и рожкового дерева (Ceratonia siligua), произрастающего на побережье Средиземного моря.
Эти камеди (Е410 и Е412) имеют сходное химическое строение и представляют собой нейтральные полисахариды, состоящие из β-(1→4)-гликозидно-связанных остатков маннозы, к которым (1→6)-связями через равные интервалы присоединены боковые цепи, состоящие из единичных остатков α-D-галактозы. У камеди гуара, получившей название гуаран, остаток галактозы присоединен к каждому второму остатку маннозы, а у камеди из бобов рожкового дерева — к каждому четвертому (рис. 2). Причем галактопиранозные структурные единицы распределены вдоль полимерной цепи маннана не равномерно, а блочно, что особенно характерно для галактоманнанов рожкового дерева. Таким образом, полимерная цепь галактоманнанов имеет нерегулярную структуру с чередующимися линейными и разветвленными зонами. От характера распределения этих зон, а также от соотношения галактозы и маннозы зависят основные свойства галактоманнанов.
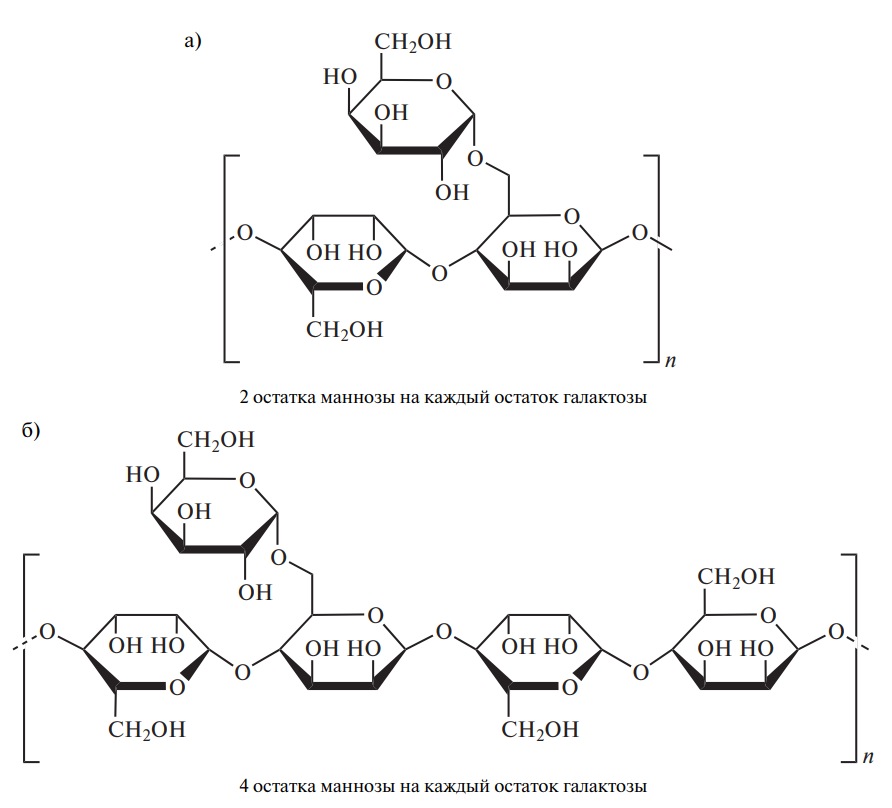
Рис. 2. Фрагмент молекулы галактоманнанов: а — камедь гуара; б — камедь рожкового дерева
Технология п олучения коммерческих препаратов галактоманнанов основана на водной экстракции полисахаридов из измельченного растительного сырья с последующим отделением и очисткой экстракта, обработкой его спиртом для выделения целевого продукта, который затем отфильтровывают, высушивают и измельчают.
Растворимость галактоманнанов в воде зависит от особенностей их строения. Галактоманнаны с высокой степенью замещения первичных гидроксильных групп в остатках D-маннозы (гуаран) полностью растворяются в холодной воде, а галактоманнаны с ограниченной степенью замещения (камедь рожкового дерева) — только в горячей. Однако в обоих случаях процесс растворения является продолжительным и ускоряется за счет интенсивного перемешивания или нагревания, при котором температура не должна превышать 80 °С из-за потенциально возможной термической деструкции полимерных молекул.
Вязкость растворов галактоманнанов зависит от их концентрации. При низких концентрациях (до 0,5 %) она имеет линейную зависимость, которая при дальнейшем повышении дозировок переходит в экспоненциальную.
6. Полисахариды морских растений
Коммерческие препараты этой подгруппы пищевых добавок объединяют полисахариды, выделяемые из красных и бурых морских водорослей. В пищевой промышленности широко используются альгинаты, каррагинаны и агароиды.
Альгиновая кислота (Е400) и ее соли (Е401–Е405) относятся к полисахаридам бурых морских водорослей родов Laminaria и Macrocystis (от лат. alga — водоросль), которые построены из остатков β-D-маннуроновой и α-L-гулуроновой кислот, находящихся в пиранозной форме и связанных в линейные цепи (1→4)-гликозидными связями. Фрагменты молекул этих кислот в наиболее энергетически выгодной конформации (конформации кресла 4С и 1С ) представлены на рис. 3.
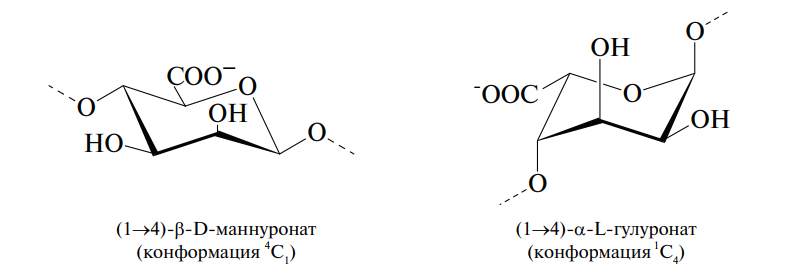
Рис. 3. Структурные фрагменты альгинатов
Распределение остатков мономеров этих кислот вдоль полимерной цепи носит блочный характер и образует три типа блоков:
- гомополимерные блоки из монотонных последовательностей остатков β-D-маннуроновой кислоты (М-блоки);
- гомополимерные блоки из монотонных последовательностей остатков α-L-гулуроновой кислоты (Г-блоки);
- гетерополимерные блоки с регулярным чередованием остатков обеих кислот (М-Г-блоки).
Такое строение полимерных молекул приводит к образованию зон кристалличности в Г-блоках, аморфных участков (зон гибкости) в М-блоках и участков с промежуточной жесткостью в гетерополимерных М-Г-блоках. Соотношение полимеров и характер их распределения в молекулах альгинатов меняются в широких пределах в зависимости от сырьевого источника. Степень полимеризации молекул составляет обычно 100–300, что соответствует молекулярной массе от 200 тыс. до 600 тыс.
Технологический процесс получения альгинатов основан на щелочной экстракции разбавленными растворами соды или щелочей в виде хорошо растворимых натриевых или калиевых солей. При подкислении экстракта из раствора выделяют собственно альгиновые кислоты, которые в связи с их ограниченной стабильностью, как правило, переводят в различные солевые формы. Статус пищевых добавок наряду с альгиновой кислотой имеют 5 альгинатов (табл. 6).
Таблица 6. Пищевые альгинаты
| Kод | Название | Природа катиона в мономерном остатке |
| Е400 | Альгиновая кислота | H |
| Е401 | Альгинат натрия | Na |
| Е402 | Альгинат калия | K |
| Е403 | Альгинат аммония | NH4 |
| Е404 | Альгинат кальция | Ca1/2 |
| Е405 | Пропиленгликольальгинат (ПГА) | 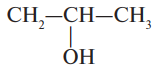 |
Растворимость этих добавок в воде зависит от природы катиона в мономерных остатках, формирующих молекулы рассматриваемых гетерогликанов. Свободные альгиновые кислоты плохо растворимы в холодной воде, но набухают в ней, связывая 200–300-кратное количество воды, однако растворимы в горячей воде и в растворах щелочей, образуя при подкислении гели. Натриевые и калиевые соли альгиновых кислот легко растворимы в воде с образованием высоковязких растворов. Соли с двухвалентными катионами образуют гели или нерастворимые альгинаты.
Вязкость растворов альгинатов связана с длиной полимерной молекулы альгината, в связи с чем коммерческие препараты имеют, как правило, определенную молекулярную массу. В этом случае вязкость растворов изменяется пропорционально концентрации добавки. При низких концентрациях повышение вязкости может быть достигнуто путем введения небольшого количества ионов кальция, которые, связывая молекулы, приводят фактически к повышению молекулярной массы и, как следствие, к повышению вязкости. Превышение дозировки ионов кальция может привести к гелеобразованию.
Образование гелевой структуры в растворах альгинатов происходит с участием ионов бивалентного кальция путем взаимодействия их молекул между собой в зонах кристалличности. В связи с этим гелеобразующая способность и прочность гелей непосредственно связаны с количеством и длиной зон кристалличности.
Агар (агар-агар) Е406 — смесь полисахаридов агарозы и агаропектина. Основная фракция агарозы — линейный полисахарид, построенный из чередующихся остатков β-D-галактопиранозы и 3,6-ангидро-α-L-галактопиранозы, связанных попеременно β-(1→4)- и α-(1→3)-связями.
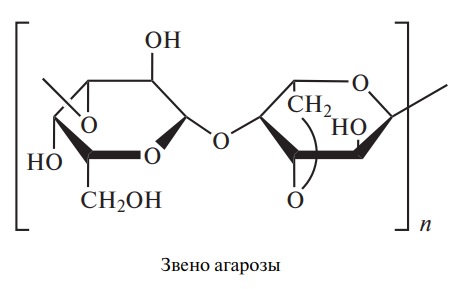
Агаропектин — смесь полисахаридов сложного строения, содержащая глюкуроновую кислоту и эфирносвязанную серную кислоту.
Агар-агар получают из красных морских водорослей (Gracilaria, Gelidium, Ahnfeltia), произрастающих в Белом море, Тихом и Атлантическом океанах. В зависимости от вида водорослей состав выделенных полисахаридов может изменяться. Агар незначительно растворяется в холодной воде, но набухает в ней. В горячей воде он образует коллоидный раствор, который при охлаждении дает хороший прочный гель, обладающий стекловидным изломом. У агара этот процесс осуществляется за счет образования двойных спиралей и их ассоциации независимо от содержания катионов, сахара или кислоты. Гелеобразующая способность агара в 10 раз выше, чем у желатина. При нагревании в присутствии кислоты способность к гелеобразованию снижается. Гели стабильны при рН более 4,5 и термообратимы.
Каррагинаны (Е407) объединяют семейство полисахаридов (известное также под названием ирландский мох), содержащихся наряду с агаром в красных морских водорослях Chondrus Crispis, Eucheuma Spinosum, Gigartina species и др. По химической природе каррагинаны близки к агароидам и представляют собой неразветвленные сульфатированные гетерогликаны, молекулы которых построены из остатков производных D-галактопиранозы со строгим чередованием α-(1→3)- и β-(1→4)-связей между ними, то есть из повторяющихся дисахаридных звеньев, включающих остатки β-D-галактопиранозы и 3,6-ангидро-α-D-галактопиранозы. В зависимости от особенностей строения дисахаридных повторяющихся звеньев различают три основных типа каррагинанов, для обозначения которых используют буквы греческого алфавита:
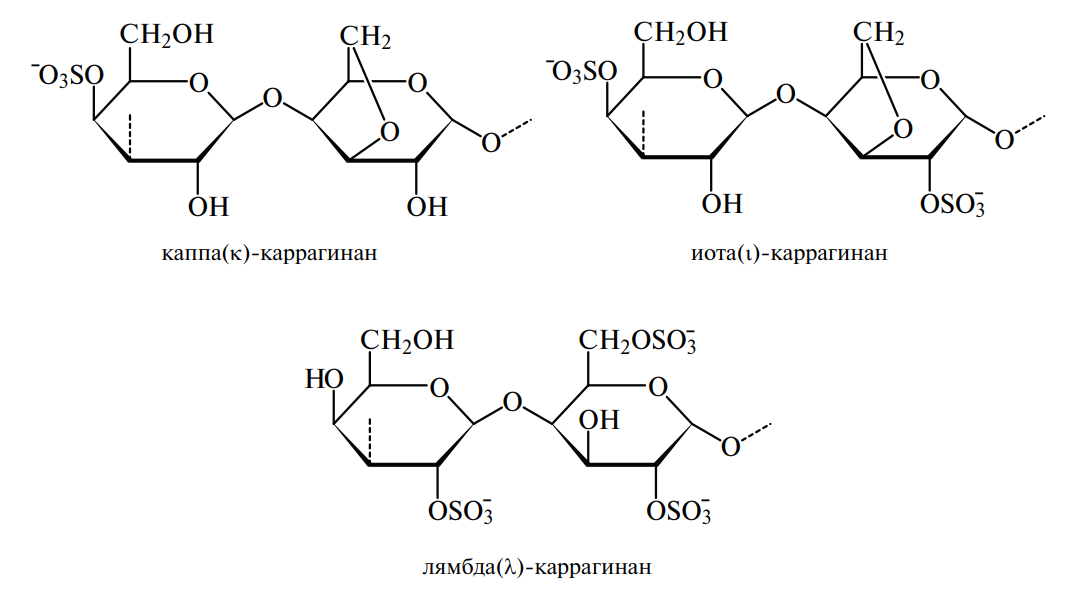
В κ- и ι-каррагинанах левые галактозные остатки дисахаридных повторяющихся звеньев содержат сульфатированные гидроксильные группы при четвертом атоме углерода, а правый галактозный остаток находится в 3,6-ангидроформе и имеет сульфатированный гидроксил при втором атоме углерода в -каррагинане и несульфатированный — в -типе.
Сульфатные группы в молекулах коммерческих каррагинанов могут быть замещены на ионы натрия, калия или аммония. Коммерческие препараты обычно содержат сопутствующий полисахарид — фурцеллеран.
Принципиальным для условий формирования гелевых структур является конформационное состояние моносахаридных остатков. В повторяющихся дисахаридных звеньях, формирующих макромолекулы каррагинанов, оба галактопиранозных остатка находятся в конформации «кресла», причем, в - и -каррагинанах правый остаток имеет конформацию 4С , а левый — конформацию 1С .
В λ-каррагинане оба галактозных фрагмента находятся в конформации 4С1. Именно наличие двух типов конформаций в дисахаридном звене обусловливает способность каррагинановых молекул к образованию двойных спиралей, ассоциация которых приводит к гелеобразованию.
Технологический процесс получения каррагинанов основан на их экстракции горячей водой с последующим выделением из раствора.
В промышленности используют два способа выделения:
- а) через гелеобразование в среде с хлоридом калия — для выделения гелеобразующих каррагинанов;
- б) осаждением из спирта — при выделении смеси всех трех типов.
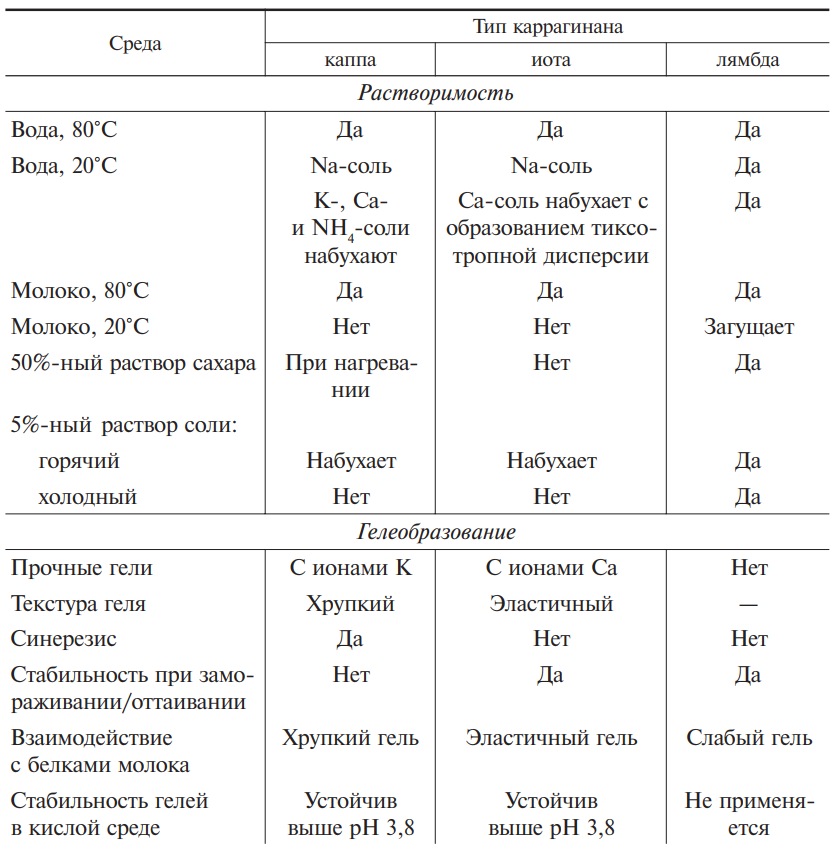
Основные свойства каррагинанов представлены в табл. 7, из которой видно, что все три вида каррагинанов растворимы в горячей воде, а в виде натриевых солей они растворимы и в холодной воде с образованием вязких растворов. κ- и ι-Kаррагинаны являются гелеобразователями, а λ-тип — загустителем. Растворы гелеобразующих каррагинанов становятся твердыми и образуют гели при температуре ниже 49–55 °С. Эти гели устойчивы при комнатной температуре, но могут быть вновь расплавлены при нагревании до температуры, превышающей температуру гелеобразования на 5–10 °С. При охлаждении такого расплава вновь образуется гель.
Таблица 7. Свойства каррагинанов
Механизмы загущения и гелеобразования у различных типов каррагинанов неодинаковы. -Каррагинан связывает воду и образует прочный гель в присутствии ионов калия, а ι- и λ-каррагинаны в этих условиях проявляют лишь незначительную реакцию. Для образования геля -каррагинаном необходимо присутствие ионов кальция, которые образуют связи между отдельными молекулами биополимера с формированием спирали. Отрицательные заряды, связанные с наличием двух сульфатных групп в дисахаридных блоках -каррагинанов, не позволяют спиралям этих каррагинанов агрегатировать с той же степенью, что и в -каррагинанах. По этой причине -каррагинаны образуют обычно эластичные прозрачные гели, не склонные к синерезису и устойчивые в условиях замораживания и оттаивания.
Молекулы λ-каррагинанов являются более высокосульфатированными, что делает образование гелевой структуры менее вероятным, поскольку сульфатные эфиры не соединяются с ионами калия с образованием спиралей из-за ионизации сульфатных групп даже в кислой среде. В этих условиях полимерные молекулы сохраняют произвольное распределение и образуют вязкие растворы при охлаждении.
Наличие отрицательно заряженных сульфатных групп в молекулах каррагинанов обусловливает их способность к комплексообразованию с казеиновыми мицеллами молока, имеющими в периферийных (внешних) зонах высокую концентрацию положительных зарядов. Это взаимодействие в комбинации с водопоглотительной способностью синергетически увеличивает прочность геля приблизительно в 10 раз, то есть одна и та же прочность геля достигается в молочной системе при концентрации каррагинана в 10 раз меньшей, чем в водной среде. - и -Каррагинаны образуют гели с молоком при концентрациях 0,02–0,2 %.
Ксантановая камедь, или камедь кукурузного сахара (Е415), представляет собой смесь полисахаридов, образующихся как вторичные метаболиты при аэробной ферментации сахаров (например, кукурузного сиропа) бактериями Xanthomonas campestris. По химической природе это гетерополисахарид с молекулярной массой от одного до нескольких миллионов, молекулы которого формируются из трех типов моносахаридов:
β-D-глюкозы, α-D-маннозы и α-D-глюкуроновой кислоты при их соотношении 2 : 2 : 1. Структурной единицей молекулы ксантана является повторяющийся пентасахаридный фрагмент, имеющий строение:
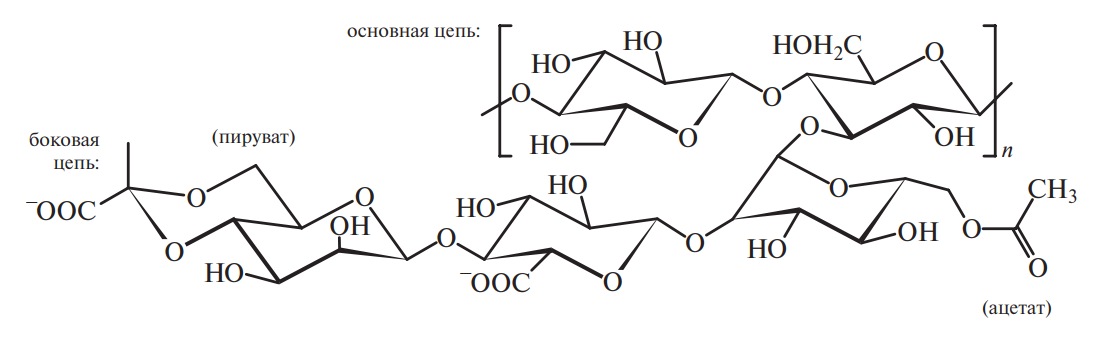
Молекулы β-D-глюкозы, соединяясь (1→4)-гликозидной связью, образуют основную цепь, где каждый второй глюкозный остаток содержит короткое боковое звено из трех моносахаридных единиц, в котором остаток глюкуроновой кислоты располагается между двумя остатками
α-D-маннозы. Конечный остаток маннозы может содержать пируватную группу, а манноза, примыкающая к основной цепи, — ацетатную группу при шестом углеродном атоме. Как правило, каждое второе боковое ответвление содержит пируватную группу, однако соотношение пируватных и ацетатных групп зависит от вида микроорганизма и условий получения.
Растворимость ксантанов в воде определяется наличием регулярных боковых звеньев с кислотными группировками, вызывающими взаимное отталкивание отдельных молекул, что приводит к повышению их гидратации. В связи с этим ксантаны растворяются в воде уже при комнатной температуре, кроме того, они хорошо растворимы в горячем и холодном молоке, в растворах соли и сахара.
Обычно молекулы ксантанов представляют собой единичные или двойные спирали, подобные жестким стержням, не проявляющим тенденции к ассоциации, что объясняет их поведение в растворах. Ксантаны являются загустителями и при температурах до 100 °С образуют растворы высокой вязкости, которая мало зависит от температуры и стабильна в диапазоне рН от 1 до 13.
7. Желатин
Желатин не относится к категории пищевых добавок, однако описание этого ингредиента в данном разделе cвязано с тем, что он широко используется в пищевой промышленности для придания гелевой структуры пищевым продуктам. Желатин является практически единственным гелеобразователем белковой природы. Желатин — пищевой ингредиент, представляющий собой смесь линейных полипептидов с различной молекулярной массой (50 000–70 000) и их агрегатов с молекулярной массой до 300 000, не имеет вкуса и запаха. Аминокислотный состав желатина включает до 18 аминокислот, в том числе глицин (26–31 %), пролин (15–18 %), гидроксипролин (13–15 %), глутаминовую кислоту (11–12 %), аспарагиновую кислоту (6–7 %), аланин (8–11 %) и аргинин (8–9 %).
Фрагмент молекулы желатина имеет следующий вид (АК — аминокислота):
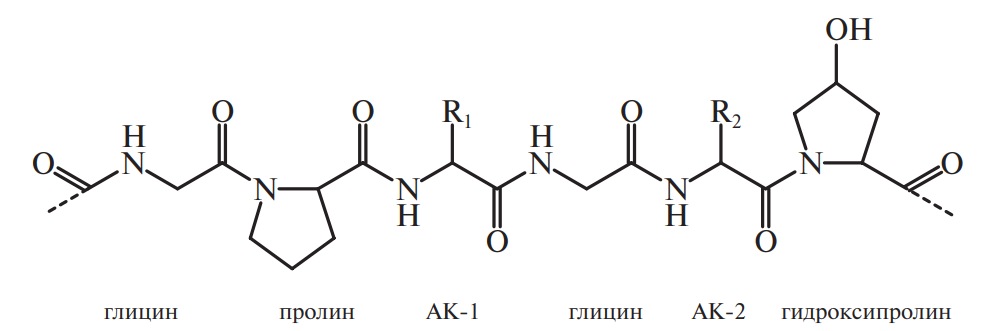
Электрокинетические свойства желатина в растворе, в том числе изоэлектрическая точка, определяются пятью электроактивными аминокислотами. В молекулах желатина основными функциональными группами, несущими заряд, являются:
- —COOH-группы аспарагиновой и глутаминовой кислот;
- —NH2-группы лизина и гидроксилизина;
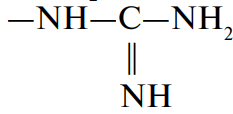 группы аргинина.
группы аргинина.
На их долю приходится более 95 % всех ионизированных групп желатина.
Желатин получают из коллагена, содержащегося в костях, хрящах и сухожилиях животных. Технологический процесс основан на кислотной или щелочной экстракции, в процессе которой нерастворимый коллаген превращается в растворимый желатин, с последующим выделением продукта известными технологическими приемами, предусматривающими его очистку, высушивание и стандартизацию. В коллагене 35 % кислотных групп находится в амидированной форме, которая преобразуется в кислотную в процессе щелочной обработки. Поэтому изоэлектрическая точка желатина варьирует между 9,4 (для амидированной формы) и 4,8 (для карбоксильной формы).
Желатин растворяется в воде, молоке, растворах солей и сахара при температуре выше 40 °С. Растворы желатина имеют низкую вязкость, которая зависит от рН и минимальна в изоэлектрической точке. При охлаждении водного раствора желатина происходит повышение вязкости с переходом в состояние геля. Это так называемый золь-гель-переход. Условиями образования геля являются достаточно высокая концентрация желатина и соответствующая температура, которая должна быть ниже точки затвердевания (примерно 30 °С).
При охлаждении сегменты, богатые аминокислотами различных полипептидных цепей, принимают спиральную конфигурацию. Водородные связи с участием или без участия молекул воды стабилизируют образовавшуюся структуру. Эти связи распределены по всей длине цепи, что объясняет уникальные свойства желатиновых гелей.
Наиболее интересным свойством желатина является образование термически обратимых гелей. В противоположность полисахаридам, гелеобразование желатина не зависит от рН и не требует присутствия других реагентов, как, например, сахаров, солей или двухвалентных катионов.
8. Эмульгаторы
В эту группу пищевых добавок входят вещества, которые, будучи добавленными к пищевому продукту, обеспечивают возможность образования и сохранения однородной дисперсии двух или более несмешивающихся веществ.
Строго говоря, термины «эмульгатор» или «эмульгирующий агент» подразумевают химическое вещество, способное (при растворении или диспергировании в жидкости) образовывать и стабилизировать эмульсию, что достигается благодаря его способности концентрироваться на поверхности раздела фаз и снижать межфазное поверхностное натяжение. Такая способность связана с поверхностно-активными свойствами, поэтому применительно к рассматриваемой группе пищевых добавок термины эмульгатор, эмульгирующий агент и поверхностно-активное вещество (ПАВ) могут рассматриваться как синонимы.
Хотя основными дефинициями эмульгаторов являются образование и поддержание в однородном состоянии смеси несмешиваемых фаз, таких как масло и вода, в других пищевых системах применение этих добавок может быть связано не столько с эмульгированием, сколько с их взаимодействием с такими пищевыми ингредиентами, как белки, крахмал и др. В качестве первых пищевых эмульгаторов использовались натуральные вещества, в частности камеди, сапонины, лецитин и др.
Некоторые из них сохранили свою популярность, однако наиболее широко в промышленности используются сегодня синтетические эмульгаторы или продукты химической модификации природных веществ, промышленное производство которых начало развиваться в 1920-е гг.
По химической природе молекулы классических эмульгаторов, являющихся поверхностно-активными веществами, имеют дифильное строение, то есть содержат полярные гидрофильные и неполярные гидрофобные группы атомов, которые, будучи связанными с неполярным соединительным звеном (основанием), отделены друг от друга и располагаются на противоположных концах молекулы. Первые (гидрофильные) обеспечивают растворимость в воде, вторые (гидрофобные) — в неполярных растворителях (см. рис. 2). Дифильное строение молекул эмульгаторов обусловливает их склонность к формированию ассоциатов в объемной фазе растворителя, называемых мицеллами.
В зависимости от особенностей строения молекулы эмульгатора, которые будут проявляться в соотношении между гидрофильными свойствами полярной группы и липофильными свойствами неполярной части молекулы ПАВ, могут образовываться как классические мицеллы в воде, так и обращенные мицеллы в неполярных растворителях (маслах и жирах), что схематично отображено на рис. 4.
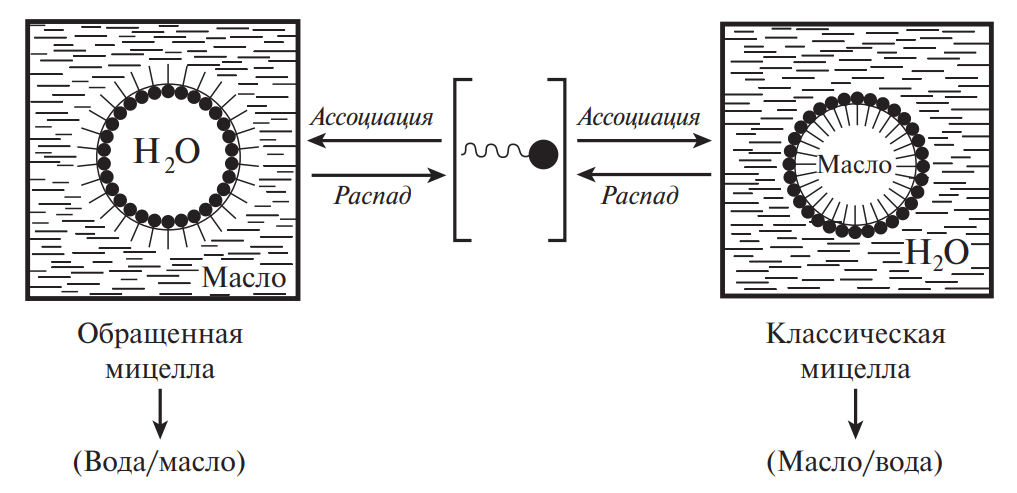
Рис. 4. Схема образования мицелл
Склонность к формированию ассоциатов мицеллярного типа, равно как и другие проявления поверхностно-активных свойств, зависит от химического строения молекул ПАВ, прежде всего от соотношения размеров полярной и неполярной частей молекулы, которое выражается в показателе гидрофильно-липофильного баланса (ГЛБ). Чем выше гидрофильность, тем больше величина ГЛБ; при этом, в общем случае, тем ярче проявляется способность молекул ПАВ к образованию классических мицелл и стабилизации прямых эмульсий (масло/вода); и наоборот, чем ниже гидрофильность и, следовательно, меньше значение ГЛБ, тем выше способность к ассоциации в виде обращенных мицелл и стабилизации обратных эмульсий (вода/масло).
9. Классификация эмульгаторов
Известно несколько способов классификации эмульгаторов по различным признакам (табл. 8).
Таблица 8. Классификация эмульгаторов
| Kлассификационный признак | Основные подклассы |
|
Заряд поверхностно-активной части: отрицательный |
Анионные |
| положительный | Kатионные |
| нейтральный | Неионогенные |
| положительный или отрицательный (в зависимости от рН) | Амфотерные |
| и положительный, и отрицательный (оба) | Цвиттер-ионные |
| Гидрофильно-липофильный баланс:
4—6 |
Эмульгаторы вода/масло |
| 7—9 | Смачивающие агенты |
| 8—18 | Эмульгаторы масло/вода |
| Растворимость:
в воде |
Водорастворимые (гидрофильные, липофобные) |
| в масле | Маслорастворимые (липофильные, гидрофобные) |
| Функциональные группы:
—СООН |
Kислоты |
| —ОН | Спирты |
 и т. д. и т. д. |
Эфиры |
В анионных (анионактивных) эмульгаторах гидрофильными группами могут являться ионные формы карбоксильных и сульфонильных групп, в катионактивных — ионные формы соединений аммония с третичным или четвертичным атомом азота (третичные или четвертичные аммониевые основания и соли), в неионогенных эмульгаторах — гидроксильные и кетогруппы, эфирные группировки и др.
В цвиттер-ионных эмульгаторах роль гидрофильных групп выполняют ионные группировки, имеющие одновременно и положительный, и отрицательный заряды. Например, в молекуле лецитина гидрофильная группировка состоит из отрицательно заряженного остатка фосфорной кислоты и катионной группы четвертичного аммониевого основания холина.
Основные виды пищевых эмульгаторов — неионогенные ПАВ. К исключениям относятся, например, цвиттер-ионный лецитин и анионактивные лактилаты.
По химической природе основные виды пищевых эмульгаторов представляют собой производные одноатомных и многоатомных спиртов, моно- и дисахаридов, структурными компонентами которых являются остатки кислот различного строения.
Обычно ПАВ, применяемые в пищевой промышленности, являются не индивидуальными веществами, а многокомпонентными смесями и выпускаются под фирменными наименованиями. Химическое название препарата при этом соответствует лишь основной части продукта.
В зависимости от особенностей химической природы эмульгатора, а также специфики пищевой системы, в которую он вводится, некоторые из представителей этого функционального класса пищевых добавок могут иметь смежные технологические функции, например функции стабилизаторов.
Некоторые характеристики и общие свойства основных групп пищевых эмульгаторов представлены в табл. 9.
Таблица 9. Некоторые характеристики пищевых эмульгаторов
| Эмульгаторы | Kод | ГЛБ | Растворимость | Мицеллообразование | |
| в масле | в воде | ||||
| Лецитин | Е322 | 3—4 | Р | Д | Обратные мицеллы |
| Модифицированный лецитин | — | 7—12 | Р | Д | Мицеллы |
| Моно- и диглицериды | Е471 | 3—4 | Р | Д | Обратные мицеллы |
| Ацетилированные моноглицериды | Е472а | 2—3 | Р | Н | То же |
| Лактилированные эфиры моно- и диглицеридов | Е472b | 3—4 | Р | Н | »» |
| Эфиры диацетилвинной кислоты с моно- и диглицеридами | Е472е | 8—10 | Р | Д | Мицеллы |
| Эфиры сахарозы | Е473 | 3—16 | Д | Д | Мицеллы, обратные мицеллы |
| Стеароиллактат натрия | Е481 | 10—12 | Р | Д | Мицеллы |
| Стеароиллактат кальция | Е482 | 5—6 | Р | Д | Обратные мицеллы |
| Сорбитан моностеарат | Е491 | 3—6 | Р | Д | То же |
| Полисорбат 60 | Е435 | 14—15 | Р | Р | Мицеллы |
| Полисорбат 65 | Е436 | 10—11 | Р | Д | То же |
| Полисорбат 80 | Е433 | 14—15 | Р | Р | »» |
Примечания: Р — растворимо, Д — диспергируемо, Н — нерастворимо.
Общим свойством, объединяющим эмульгаторы и отличающим их от пищевых добавок других классов, является поверхностная активность. В зависимости от особенностей состава и свойств пищевой системы, в которую преднамеренно вводится эмульгатор, его поверхностная активность может проявляться в различных, главным образом технологических изменениях.
Основными технологическими функциями эмульгаторов в пищевых системах являются:
- диспергирование, в частности эмульгирование и пенообразование;
- солюбилизация;
- комплексообразование с крахмалом;
- взаимодействие с белками;
- изменение вязкости;
- модификация кристаллов;
- смачивание и смазывание.
Липофильная (гидрофобная) часть дифильных молекул всех перечисленных в таблице добавок имеет одинаковую химическую природу и сформирована ацилами высших жирных кислот. Основные структурные отличия, обусловливающие различия поверхностно-активных свойств, связаны с особенностями химического строения гидрофильной (липофобной) части молекул представленных ПАВ, которые отражаются в значениях гидрофильно-липофильного баланса.
10. Основные группы пищевых ПАВ
Моно -, диацилглицерины и их производные (Е471, Е472а–E472f ). Они являются наиболее известной группой эмульгаторов, промышленное производство которых началось в 1920-е гг. Сегодня их доля в общем потреблении пищевых эмульгаторов составляет около 60 %.
В группу пищевых добавок глицеридной природы входят неполные ацилглицерины (глицериды), получаемые в промышленности глицеролизом жиров и масел или этерификацией глицерина высокомолекулярными жирными кислотами, а также продукты их этерификации по первичной гидроксильной группе пищевыми низкомолекулярными кислотами — уксусной, молочной, винной, диацетилвинной, лимонной.
Известны различные типы моноглицеридов, которые, в зависимости от вида исходного жирового сырья и технологии получения, могут содержать от 40 до 60 % фракции моноэфира в смеси с ди- (34–50 %) и триглицеридами (3,5–10 %) со значениями йодного числа от 1 до 100 % йода и температурой плавления от 40 до 70 °С.
При молекулярной дистилляции продуктов глицеролиза получают дистиллированные моноглицериды, содержащие не менее 90 % моноэфира, представляющего собой смесь α- и β-кристаллических форм, из которых наиболее активной с позиций функциональности является α-форма. Содержание α-формы может изменяться в интервале 40–90 %.
Общая формула, объединяющая эту группу добавок, имеет следующий вид:
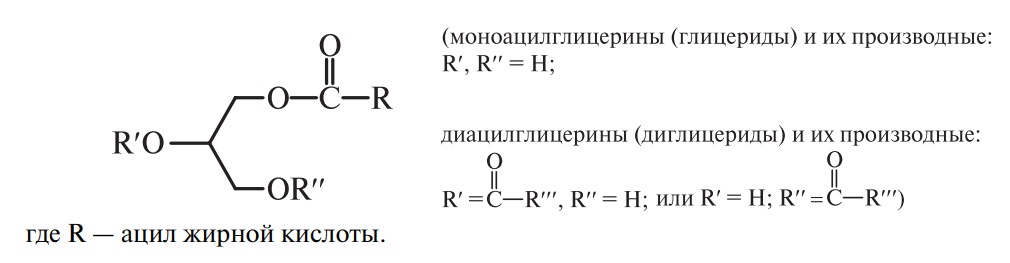
В качестве пищевых добавок разрешены 7 сложноэфирных модификаций неполных ацилглицеринов, представленных в табл. 10.
Таблица 10. Пищевые добавки глицеридной природы
| Код | Название | R» | дед |
| Е471 | Моно- и диглицериды жирных кислот
Эфиры уксусной кислоты и моно-, диглицеридов жирных кислот |
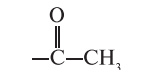 |
* |
| Е472а | * | ||
| E472b | Эфиры молочной кислоты и моно-, диглицеридов жирных кислот | 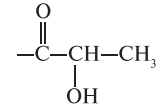 |
* |
| Е472с | Эфиры лимонной кислоты и моно-, диглицеридов жирных кислот | 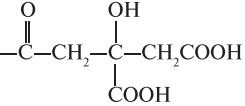 |
* |
| E472d | Эфиры винной кислоты и моно-, диглицеридов жирных кислот | 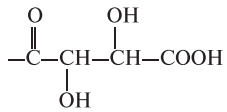 |
0-30 |
| Е472е | Эфиры диацетилвинной кислоты и моно-, диглицеридов жирных кислот | 0-50 | |
| E472f | Смешанные эфиры винной и уксусной кислот и моно-, диглицеридов | См. Е472а и E472d | 0-30 |
* Совершенно безвредны, применяются без ограничений. Примечани е. R′′ — общей формулы ацилглицеринов — см. перед таблицей.
Три из них, как и исходные моно- (МГ) и диглицериды (ДГ), относятся к группе совершенно безопасных добавок, применяемых без ограничений. Для остальных допустимая суточная доза составляет 30 мг/кг массы тела, а для добавки Е472е даже 50 мг/кг массы тела человека.
Модификация моно- и диацилглицеринов пищевыми кислотами (табл. 10) позволяет направленно изменять ГЛБ молекул (см. табл. 9) и, следовательно, их поверхностную активность на границах раздела различных фаз.
Фосфолипид ы. Наиболее популярными в этой группе являются природные лецитины (Е322), синтетический аналог которых получил название аммониевые фосфатиды (Е442).
В соответствии с директивой Европейского совета лецитины представляют собой смесь фракций фосфатидов, полученную из животных или растительных объектов физическими методами, включающими использование ферментов, в которой содержание веществ, нерастворимых в ацетоне (собственно фосфолипидов), составляет не менее 56–60 %.
Основными фракциями коммерческих лецитинов являются фосфатидилхолины, то есть собственно лецитины (до 25 %), фосфатидилэтаноламины (до 25 %), фосфатидилсерины (до 15 %), фосфатидилинозиты, фосфатидовые (фосфатидные) кислоты (5–10 %).
Аммониевые фосфатиды представляют собой смесь аммониевых солей различных фосфатидных кислот, являющихся продуктами взаимодействия ортофосфорной кислоты с одним, двумя или тремя остатками ацетилглицеринов.
Общая формула и основные фракции природных и синтетических фосфолипидов представлены ниже (R′ и R′′ — углеводородные радикалы):
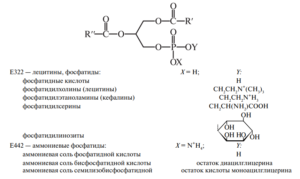
Основным источником промышленного получения лецитинов для пищевой промышленности являются масличные культуры (главным образом соя, реже — подсолнечник), откуда их выделяют при гидратации масел.
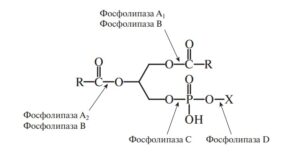
Принципиально возможны два способа модификации стандартных фосфолипидов — ферментативный и химический.
Продукты ферментативной модификации фосфолипазами А1 и А2 (гидролизованные фосфолипиды) представляют собой лизоформы (лизофосфатидилхолин, лизофосфатидилэтаноламин и т. д.), полученные направленным отщеплением.
Под действием фосфолипазы В деэтерификация идет и в первом, и во втором положении; фосфолипазы С и D, не затрагивая ацилов высших жирных кислот, осуществляют гидролиз в фосфорнокислой группе и приводят к образованию диацилглицеринов (фосфолипаза С) или фосфатидных кислот (фосфолипаза D):
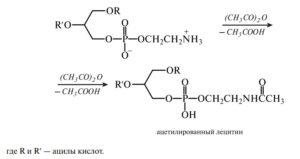
Химическая модификация возможна по двум направлениям, к которым относятся:
обработка пероксидом водорода в присутствии молочной кислоты с образованием гидроксилированных лецитинов:

получение ацетилированных производных:
Все приемы модификации фосфолипидов приводят к изменению ГЛБ, а следовательно, и поверхностной активности, определяющей технологические функции фосфолипидов в различных пищевых системах. Значения ГЛБ для различных модификаций лецитина приведены ниже:
- Стандартный 4
- Ацетилированный 6
- Гидролизованный 8
- Гидроксилированный 10
В основе получения синтетических аналогов лежит глицеролиз растительных масел и жиров с последующим фосфорилированием образовавшихся неполных ацилглицеринов фосфорным ангидридом и нейтрализацией кислотных форм газообразным аммиаком:
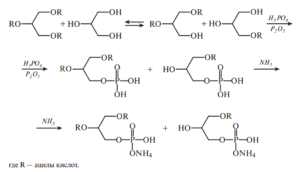
В отличие от своих природных аналогов, аммониевые фосфатиды принадлежат к группе натуральных безвредных добавок, в связи с чем применение их в пищевых продуктах регламентируется соответствующими директивами.
Особенности эмульгирующих свойств фосфолипидов обусловлены способностью образовывать и поддерживать в однородном состоянии как прямые, так и обратные эмульсии, что распространяет их использование на все виды пищевых эмульсий: от майонезов и различных салатных соусов (прямые эмульсии) до маргаринов различного жирно-кислотного состава и разного содержания жировой фазы (обратные эмульсии).
Другой отличительной особенностью фосфолипидов как пищевых эмульгаторов является их способность образовывать липосомы (липидные везикулы) — частицы, формируемые концентрическими замкнутыми липидными бислоями с внутренним водным слоем, изолированным от внешней среды и содержащим, в зависимости от назначения липосом, различные включения, например пептиды или белки. Использование липосомальных систем в пищевых продуктах связано с функциями защиты отдельных пищевых ингредиентов от внешнего воздействия (защита дрожжевых клеток от охлаждения в замороженных мучных полуфабрикатах и пицце), сохранения влаги (мороженое) или органических, например вкусовых, веществ (хлеб и бисквиты).
Поверхностная активность фосфолипидов на различных межфазных границах (твердое вещество/жидкость, жидкость/газ и т. д.) обусловливает эффективность их действия в многокомпонентных дисперсных системах, включая структурированные, в которых дефиниции этих добавок сводятся к изменению реологических свойств.
В отличие от большинства других пищевых добавок, препараты фосфолипидов обладают высокой физиологической эффективностью, связанной с уменьшением уровня холестерина, улучшением функции печени и состояния центральной и периферической нервной системы, торможением процессов старения организма и нормализацией иммунобиологической реактивности организма. И хотя диетологи не относят фосфолипиды к незаменимым факторам питания, они являются физиологически ценными компонентами пищи, суточная потребность в которых составляет около 5 г.
Эфиры. Эфиры полиглицерина (Е475) представляют собой сложные эфиры жирных кислот с полиглицерином и могут быть описаны формулой:
Технология их получения основана на полимеризации глицерина с последующей этерификацией пищевыми жирами или высшими жирными кислотами (пальмитиновой, стеариновой, олеиновой).
Эфиры полиглицерина являются неионогенными ПАВ и могут проявлять как гидрофильные, так и липофильные свойства со значениями ГЛБ от 5 до 13, что зависит, в частности, от степени полимеризации (преимущественно n = 1, 2, 3 или 4).
Их применение в пищевой промышленности связано с технологическими функциями эмульгаторов, пеногасителей, замутнителей, смазочных материалов. Основные объекты использования — хлебопекарные и кондитерские изделия, а также маргариновая продукция. ДСД эфиров полиглицерина, в общем случае, не должна превышать 25 мг на 1 кг массы тела человека в день.
Эфиры сахарозы (Е473) представляют собой смесь преимущественно моно-, ди- и триэфиров сахарозы с природными высшими жирными кислотами:
Получение добавок основано на реакции между сахарозой и метиловыми или этиловыми эфирами пищевых кислот жирного ряда в среде органического растворителя (диметилсульфоксида или диметилформамида), остаточное содержание которого в пищевой добавке не должно превышать 1 и 2 мг/кг (для диметилформамида и диметилсульфоксида соответственно). Общее содержание эфиров должно составлять не менее 80 % при контролируемом уровне содержания сахарозы, составляющем не более 5 %.
Добавки являются неионогенными эмульгаторами и характеризуются различной гидрофильностью, зависящей от содержания моноэфира:
| Содержание моноэфира, % 70 | 60 | 50 | 40 | 30 | 10 |
| Значение ГЛБ 15 | 13 | 11 | 8 | 6 | 2 |
Эфиры сорбитана (Е491–Е495) — сложные эфиры шестиатомного спирта сорбита в ангидроформе (ангидросорбита) с природными высшими жирными кислотами — лауриновой, пальмитиновой, стеариновой, олеиновой. Сложные эфиры ангидросорбита и жирных кислот (табл. 11) имеют название сорбитаны (спаны, или спены):
Добавки этой подгруппы являются липофильными неионогенными эмульгаторами. ГЛБ для сорбитанмоностеарата лежит в интервале 3–6.
Основные области использования — производство мучных кондитерских изделий, сливок для кофе, сухих дрожжей. В производстве маргаринов эти добавки применяют для модификации кристаллов жира.
Таблица 11. Пищевые сорбитаны
| Код | Название | R’ | R»
и R'» |
| Е491 | Сорбитанмоностеарат | Н | |
| Е492 | Сорбитантристеарат | ||
| Е493 | Сорбитанмонолаурат | н | |
| Е494 | Сорбитанмоноолеат | н | |
| Е495 | Сорбитанмонопальмитат | н |
Эфиры полиоксиэтиленсорбитана (Е432–Е436) представляют собой оксиэтилированные сорбитаны — эфиры ангидросорбита с жирными кислотами, в молекулах которых свободные ОН-группы замещены группами О–[CH2–CH2–O]n–H полностью или частично. В добавках для пищевых продуктов n равно 20. Общая формула молекулы имеет вид:
Коммерческие препараты добавок этой группы имеют название полисорбаты или твины.
В перечень добавок, разрешенных к применению в производстве пищевых продуктов, включены 5 полисорбатов.
Эти неионогенные эмульгаторы получают взаимодействием окиси этилена с эфирами ангидросорбита и жирных кислот в среде 1,4-диоксана. Этоксилирование молекул сорбитанов повышает гидрофильность ПАВ, зависящую от числа ацилов высших жирных кислот в структуре сорбитана. ГЛБ для полиоксиэтиленсорбитанмоностеарата (полисорбата 60) составляет 14,4, для тристеарата (полисорбата 65) соответствует 10–11. Основные области применения — мороженое, сливки для кофе, замороженные десерты, кексы и другие кондитерские изделия.
Эфиры молочной кислоты (лактилаты, Е481 и Е482) — производные молочной кислоты с высшими жирными кислотами (стеариновой или олеиновой) в виде их натриевых или кальциевых солей.
Общая формула, описывающая структуру основного вещества:
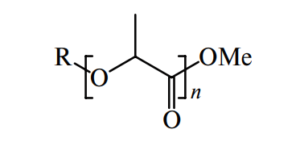
где R — ацил стеариновой или олеиновой кислоты; Me — Na или 1/2Са.
В основе получения этих добавок лежит взаимодействие карбоксильной группы стеариновой кислоты с гидроксильной группой пищевой молочной кислоты с последующей нейтрализацией гидроксидом натрия или кальция свободных карбоксильных групп в молекулах синтезированных эфиров.
Стеароиллактаты натрия и кальция могут быть отнесены к группе анионактивных ПАВ с отрицательным зарядом на поверхностно-активной части молекулы.
Значение ГЛБ для стеароиллактата натрия составляет 10–12, для кальциевой соли — 5–6. Основные области использования — производство хлеба и хлебобулочных изделий, пудингов, взбитых сливок и других продуктов.
Допустимая суточная доза лактилатов составляет 20 мг на 1 кг массы тела.


