Содержание страницы
1. Роль белков в организме
Белки – сложные азотистые высокомолекулярные соединения, в состав которых входят аминокислоты. Они относятся к незаменимым эссенциальным веществам, без которых невозможна жизнь, рост и развитие организма. Они являются основной составной частью клеток всех органов и тканей. Белки составляют примерно 20 % массы тела человека и 50 % сухой массы клеток. Роль белков в организме человека чрезвычайно велика, что обусловлено их различными физиолого-гигиеническими функциями.
Основное назначение белков пищи – это построение новых клеток и тканей, что обеспечивает развитие молодых организмов, которые растут. Белки входят в состав ядра, протоплазмы, мембран клеток всех органов и тканей, т. е. выполняют важнейшую – пластическую функцию.
Белки входят в состав всех простых и сложных ферментов, которые катализируют все биологические реакции в организме человека.
Некоторые белки плазмы крови выполняют транспорт газов крови и продуктов обмена. Например, белок крови гемоглобин транспортирует кислород от легких к органам и тканям, а углекислый газ – от органов и тканей к легким.
Защитные реакции организма связаны с белками: в частности, антитела, которые образуются во время поступления в организм посторонних веществ, являются белками.
Белки образуют с токсинами малоактивные комплексы, которые выводятся из организма, следовательно, они выполняют антитоксическую функцию. Процесс коагуляции крови, который происходит при участии белка сыворотки крови – фибриногена, препятствует большим кровопотерям. Это преобразование осуществляется с участием белков тромбина и тромбокиназы и других факторов свертывания, которые также являются белками.
Внутренние стенки пищевода, желудка покрыты защитным слоем слизистых белков – муцинов.
Некоторые гормоны по своему строению относятся к белкам, например инсулин – гормон поджелудочной железы, а также гормоны гипофиза – АКТГ, окситоцин, вазопрессин, т. е. белки выполняют гормональную роль.
Любые формы движения в живом организме (работа мышц, движение протоплазмы в клетке и др.) осуществляются белковыми структурами клеток – моторная функция.
Сухожилия, суставы, кости скелета, которые выполняют в организме опорную функцию, в основном являются белками.
Живые организмы способны образовывать запасные отложения белков (овоальбумин яиц, казеин молока, белки семян растений).
Белкам присуща рецепторная функция, которая особенно присутствует у гликопротеинов. Они выполняют очень важную функцию определения и присоединение отдельных веществ.
Во время окисления 1 г белка выделяется 4 ккал тепла. В тканях человека белки не откладываются «про запас», поэтому необходимо их ежедневное поступление с пищей.

Без достаточного количества белков не могут быть использованы витамины, минеральные вещества, необходимые для процесса обмена веществ. Таким образом, белки относятся к жизненно необходимым веществам, без них невозможна жизнь, рост и развитие организма.
Белки участвуют в поддержании гомеостаза – при их участии поддерживается единый баланс и нормальный рН биологических сред организма.
2. Классификация и характеристика пищевых белков
В природе существует большое количество белков, различных по химическому составу и структуре, физико-химическим и биологическим свойствам. В настоящее время все белки разделяют на две группы – простые (протеины) и сложные (протеиды).
Протеины – это белки, в состав которых входят только остатки аминокислот. Протеины состоят из простого белка и содержат еще и другие небелковые компоненты – простетические группы. Например, в состав нуклеопротеидов помимо простого белка входят нуклеиновые кислоты. В составе липопротеидов в качестве простетической группы содержатся липиды.
Альбумины. Самыми распространенными и наиболее изученными простыми белками являются альбумины. Они содержатся в крови, лимфе, тканевом соке, клетках тканей и органов всех животных, растений и микробов. Альбумины хорошо растворимы в воде. Наиболее распространенными альбуминами являются альбумин молока (лактальбумин) и альбумин сыворотки крови. Около 50 % всех белков крови составляют альбумины. Высокое содержание альбумина (до 50 %) также в белках яиц.
Глобулины также очень распространены среди белков продуктов питания. Они содержат все аминокислоты. Почти всегда находятся вместе с альбуминами. Глобулинов много в крови, различных органах, тканях и жидкостях человека и животных. Их много у бобовых и в семенах масличных растений (подсолнечника). В отличие от альбуминов глобулины почти совсем не растворяются в воде, но хорошо растворяются в водных растворах солей, щелочей и кислот.
Проламины – это простые белки, хорошо растворимые в воде и солевых растворах. В своем составе содержат много пролина и глутаминовой кислоты. Они есть в составе злаков, где выполняют роль запасных веществ. Проламины имеют специфическое название в соответствии с тем источником, из которого они были выделены: глиадин – белок пшеницы и ржи, гордеин – белок ячменя, зеин – белок кукурузы.
Кератины – белки кожи, волос, рогов и копыт. Практически нерастворяются в водных, кислотных, щелочных и солевых растворах.
Коллагены – белки соединительной ткани, составляют 1/3 всех белков организма человека. Они являются компонентами сухожилий, связок, хрящей, костей, кожи, чешуи рыб. Они нерастворимы в воде, но легко набухают с образованием гелей. При кипячении в воде образуют желатин.
Эластины – белки соединительной ткани, составляют основу сухожилий и связок. Нерастворимы в воде и не способны набухать даже при нагревании. По своим свойствам эластины прочнее по сравнению с коллагенами.
Глютелины – специфические белки растений, содержащиеся в семенах мака и других культур, а также в зеленых частях растений.
Сложные белки имеют определенные особенности строения и функций.
Хромопротеиды – сложные белки, молекулы которых состоят из простого белка и окрашенной простетическая группы, которая может быть представлена атомом железа, меди, магния, флавоноидами. Важнейшим хромопротеидом является гемоглобин эритроцитов крови, который транспортирует кислород из легких в органы и ткани организма, а углекислый газ – от органов и тканей до легких. К хромопротеидам относится также хлорофилл растений.
Металлопротеиды – это сложные белки, которые содержат металлы. Они относятся к классу хромопротеидов. Наиболее изучены ферритин печени и селезенки, трансферин сыворотки крови (содержат железо), а также церулоплазмин сыворотки крови (содержит медь).
Нуклеопротеиды – сложные белки, в состав которых кроме белка входят нуклеиновые кислоты. Делятся они на рибонуклеопротеиды и дезоксирибонуклеопротеиды в зависимости от того, какая нуклеиновая кислота и углевод входит в их состав.
Фосфопротеиды – сложные белки, которые состоят из простых белков и ортофосфорной кислоты. Наибольшее значение имеют такие фосфопротеиды, как казеин и пепсин. Казеин – белок молока и молочных продуктов. Он не растворяется в воде. Под действием кислот выпадает в осадок, который используется для изготовления сыров. Пепсин – основной фермент желудочного сока. Разлагает белки пищи до пептонов и альбумоз.
Липопротеиды – сложные белки, молекулы которых состоят из простого белка и липидов. Они растворимы в воде. Липопротеиды являются основой клеточных мембран, миелиновых оболочек нервных волокон, хлоропластов. Обеспечивают транспортировку липидов и жирорастворимых витаминов.
Гликопротеиды – сложные белки, состоящие из простого белка и углеводной простетическая группы (гиалуроновая, гепарин, некоторые другие гликополисахариды). Эти белки содержатся во всех тканях животных и растений, в микробах. Наибольшее значение из этой группы имеют муцины и мукоиды.
Муцины выполняют защитную функцию. Они представляют собой слизистые выделения эпителия слизистых оболочек пищеварительного тракта, дыхательных и мочеполовых путей, слюнных желез. К этой группе сложных белков относятся также мукоиды. Они представляют собой гликопротеиды, которые содержатся в хрящевой и костной тканях, а также в белке яиц.
3. Аминокислоты и их значение в питании
Сейчас выделено и описано более 130 аминокислот.
Все белки пищевых продуктов построены из 20 α-аминокислот, которые соединены между собой пептидной связью.
Аминокислоты – основные составные части и структурные компоненты белков. Соединяясь между собой в различных комбинациях, они образуют белки разнообразного строения и свойств.
Пищевая ценность белков обусловлена содержанием и количественным соотношением отдельных аминокислот. Аминокислоты, обнаруженные в пищевых продуктах в зависимости от влияния их на процесс роста, подразделяются на две группы: заменимые и незаменимые.
К незаменимым (эссенциальным) аминокислотам относятся:
- триптофан,
- лизин,
- лейцин,
- изолейцин,
- метионин,
- фенилаланин,
- треонин,
- валин.
Аргинин является незаменимой аминокислотой у детей. Некоторые авторы предлагают отнести к незаменимым еще и цистеин и тирозин.
Основным критерием определения биологической ценности аминокислот является их способность поддерживать рост животных. Изъятие из основного рациона хотя бы одной из незаменимых аминокислот приводит к торможению роста и уменьшению массы тела. Незаменимые аминокислоты должны поступать в готовом виде с белками пищи. Заменимые аминокислоты могут синтезироваться в организме и таким образом дополнять поступление их с пищей, а в случае отсутствия их в пище полностью компенсировать их недостаток за счет эндогенного синтеза.
В зависимости от содержания незаменимых аминокислот белки делятся на полноценные и неполноценные. Полноценные белки содержатся в большинстве продуктов животного происхождения. Большинство белков растительного происхождения, кроме белков бобовых, орехов, семян подсолнечника, картофеля, являются неполноценными. Они содержат мало лизина, изолейцина и треонина.
Лизин. В основе изменений, возникающих в организме при дефиците лизина, является нарушение синтеза белков, так как лизин является необходимым строительным блоком для всех белков в организме. При недостатке лизина в пищевых рационах нарушается процесс кроветворения, уменьшается концентрация гемоглобина и количество эритроцитов в крови. Основными источниками лизина являются мясо, рыба, молочные продукты.
Валин. Дефицит валина приводит к потере аппетита, а также к нарушению координации движений, повышенной чувствительности кожи (гиперестезия). Введение валина в пищевой рацион ликвидирует эти изменения. Валин участвует в синтезе алкалоидов, пантотеновой кислоты. Значительное количество валина содержат эластин, казеин молока и миоглобин мышц.
Гистидин играет важную роль в образовании гемоглобина. При недостатке гистидина снижается его уровень в крови. Недостаток гистидина, как и его избыток, ухудшает условно-рефлекторную деятельность и работу почек, приводит к развитию анемии (тормозится синтез гемоглобина), нарушения функции мышц, потому что гистидин входит в состав активных центров многих ферментов.
Лейцин играет важную роль как промежуточное соединение при биосинтезе холестерина, стероидов. При недостатке лейцина у животных, кроме торможения процессов роста, выявлены патологические изменения в почках и щитовидной железе. В белках лейцин содержится в незначительном количестве. Он используется при лечении анемий.
Метионин играет важную роль в нормализации процессов метилирования и трансметилирования. Метионин – основной донатор лабильных метильных групп, которые используются в организме для этих процессов. Как липотропное вещество он влияет на обмен жиров и фосфолипидов в печени и таким образом играет важную роль в предотвращении и лечении атеросклероза.
Триптофан больше всего связан с процессами тканевого синтеза. Триптофан тесно связан с обменом никотиновой кислоты и необходим для ее образования. После декарбоксилирования триптофана образуется триптамин – регулятор кровяного давления и других процессов в организме. Триптофан может вызвать снотворный эффект или влиять на продолжительность сна, потому что он является источником для образования нейромедиатора серотонина. Основными источниками триптофана являются животные продукты: мясо, рыба, творог, яйца). В 100 г этих продуктов содержится около 0,2 г триптофана.
Фенилаланин связан с функцией щитовидной железы и надпочечников. Дает ядро для синтеза тирозина – основной аминокислоты, из которой образуются йодсодержащие гормоны щитовидной железы. Из тирозина образуется адреналин. Высокое содержание фенилаланина содержится в гормоне инсулин.
Аргинин играет важную роль в белковом обмене. Он участвует в образовании мочевины и креатина. В значительном количестве содержится в белках – гистонах и протаминах. Его много в эмбриональной ткани и опухолях.
4. Показатели биологической ценности белков
Биологическая ценность отражает качество белков, содержащихся в продуктах: аминокислотный состав, в частности, наличие незаменимых аминокислот, их соотношение с заменяемыми, скорость атакованности пищеварительными ферментами (переваривание в пищеварительном тракте). Чем выше биологическая ценность пищи, тем больше она отвечает физиологическим потребностям организма.
Содержание белка и незаменимых аминокислот в продуктах животного и растительного происхождения приведены в таблицах 1–2.
Очень важно достаточное поступление с пищей заменимых аминокислот, потому что из-за их нехватки в рационе для образования спецефических белков расходуются в увеличенном количестве незаменимые аминокислоты. Таким образом, имеет значение не только определенная сбалансированность незаменимых аминокислот в продукте, но и соотнесение их с заменяемыми аминокислотами. Соблюдение этого требования будет способствовать удовлетворению потребности в незаменимых аминокислотах вследствие их сохранения.
Таблица 1 – Содержание белка и незаменимых аминокислот в продуктах животного происхождения (на 100 г)
| Название продукта | Белок, г | Валин, мг | Изолейцин, мг | Лейцин, мг | Лизин, мг | Метионин, мг | Треонин, мг | Триптофан, мг | Фенилаланин, мг |
| Молоко пастер. 2,5 % жир. | 2,82 | 163 | 161 | 276 | 222 | 74 | 130 | 43 | 146 |
| Сливки 20 % ж. | 2,80 | 185 | 162 | 249 | 198 | 62 | 117 | 36 | 124 |
| Сметана 30 % ж. | 2,40 | 153 | 139 | 217 | 170 | 54 | 100 | 31 | 106 |
| Творог мягкий жирный | 14,0 | 838 | 690 | 1282 | 1008 | 384 | 649 | 212 | 762 |
| Творог мягкий нежирный | 18,0 | 990 | 1000 | 1850 | 1450 | 480 | 800 | 180 | 930 |
| Кефир жирный | 2,80 | 135 | 160 | 277 | 230 | 81 | 110 | 43 | 141 |
| Сыр твердый голландский | 26,8 | 1414 | 1146 | 1780 | 1747 | 865 | 1067 | 788 | 1280 |
| Сыр пошехонский | 26,0 | 1274 | 988 | 1957 | 1572 | 983 | 894 | 700 | 1195 |
| Говядина II кат. | 20,0 | 1100 | 862 | 1657 | 1672 | 515 | 859 | 228 | 803 |
| Свинина мясная | 14,3 | 831 | 708 | 1074 | 1239 | 342 | 654 | 191 | 580 |
| Баранина I кат. | 15,6 | 820 | 754 | 1116 | 1235 | 356 | 688 | 198 | 611 |
| Печень говяжья | 17,9 | 1247 | 926 | 1594 | 1433 | 438 | 812 | 238 | 928 |
| Колбаса молочная | 11,7 | 742 | 417 | 798 | 858 | 60 | 458 | 164 | 397 |
| Сосиски молочные | 11,4 | 630 | 313 | 757 | 839 | 111 | 357 | 203 | 369 |
| Цыплята бройлеры I кат. | 17,6 | 818 | 621 | 1260 | 1530 | 447 | 783 | 283 | 649 |
| Куры I кат. | 18,2 | 877 | 653 | 1412 | 1588 | 471 | 885 | 293 | 744 |
| Утки | 15,8 | 766 | 662 | 1278 | 1327 | 370 | 705 | 174 | 608 |
| Яйца куриные | 12,7 | 772 | 597 | 1081 | 903 | 424 | 610 | 204 | 652 |
| Карп свежий | 6,0 | 1100 | 800 | 1800 | 1900 | 500 | 900 | 180 | 800 |
| Минтай морской | 15,9 | 900 | 1100 | 1300 | 1800 | 600 | 900 | 200 | 700 |
| Окунь морской | 18,2 | 1100 | 1100 | 1600 | 1700 | 500 | 900 | 170 | 700 |
Таблица 2 – Содержание белка в наиболее распространенных продуктах растительного происхождения (на 100 г)
| Название продукта | Содержание белка, г | Название продукта | Содержание белка, г |
| Хлеб из ржаной муки | 6,6 | Чеснок | 6,5 |
| Хлеб из пшеничной муки | 7,9 | Тыква | 1,0 |
| Батон нарезной из пшеничной муки I сорта | 7,7 | Арбуз | 0,7 |
| Горох зеленый | 5,0 | Дыня | 0,6 |
| Капуста белокочанная | 1,7 | Абрикосы | 0,9 |
| Картофель | 2,0 | Вишня | 0,9 |
| Лук репчатый | 1,4 | Груша | 0,4 |
| Морковь красная | 1,3 | Слива | 0,8 |
| Перец зеленый сладкий | 1,3 | Яблоки | 0,4 |
| Петрушка (зелень) | 3,7 | Виноград | 0,2 |
| Редис | 1,2 | Малина | 0,8 |
| Свекла | 1,5 | Смородина черная | 1,0 |
| Томаты грунтовые | 1,1 | Шиповник (сухой) | 3,4 |
Комитет по питанию и сельскому хозяйству при ООН (ФАО) предложил стандарты сбалансированности незаменимых аминокислот для детей, и людей в возрастных периодах, когда процессы роста прекращаются. Величины потребности, приведенные в этих стандартах, близки к естественной сбалансированности незаменимых аминокислот в белке яиц и женского молока («идеальный белок»).
Для взрослого человека рекомендуются следующие нормы употребления аминокислот, которые обеспечивают их сбалансированность (г/сут): триптофана – 1, лейцина – 4–6, изолейцина – 3–4, метионина – 2–4, фенилаланина – 2–4, лизина – 3–5, треонина – 2–3, валина – 4, гистидина – 1,5–2, аргинина – 6. Поскольку заменимые аминокислоты могут синтезироваться в организме, определение потребности в них затруднено, ориентировочно человеку необходимо (г/сут): цистеина – 2– 3, тирозина – 3–4, аланина – 3, серина – 3, глутаминовой кислоты – 16, аспарагиновой кислоты – 6, пролина – 5, глицина – 3.
Источниками биологически ценных белков являются молоко и молочные продукты, яйца, мясо, рыба, печень и субпродукты первой категории. Биологическая ценность продуктов растительного происхождения значительно ниже. По аминокислотному составу белки сои, картофеля, риса и ржи приближаются к животным белкам.
Для определения биологической ценности белков используют химические, биологические и расчетные методы. Химические методы основаны на экспериментальном определении количества всех аминокислот, содержащихся в исследуемом продукте, например, на аминокислотном анализаторе. Полученные данные сравнивают с гипотетическим «идеальным» белком, полностью сбалансированным по аминокислотному составу. ФАО / ВОЗ предложила стандартную аминокислотную шкалу, с которой сравнивают состав исследуемого белка. Подсчитывают процентное содержание каждой из аминокислот по отношению к ее содержанию в белке, принятом за стандарт по формуле:
Аминокислотный скор = (Мг АК в 1 г исследуемого белка / Мг АК в 1 г идеального белка) х 100 %
Расчет выражают или в долях единицы, или в процентах. Это значение названо аминокислотным числом – скором (скор-счет). Аминокислотой, которая ограничивает биологическую ценность белка, считается та, скор которой ( %) имеет наименьшее значение.
Обычно, скор рассчитывают для трех наиболее дефицитных аминокислот (триптофан, лизин, метионин – 1:3:3). В куриных яйцах и женском молоке скор для всех эссенциальных аминокислот близок к 100 %.
Достоверность результатов, полученных с помощью этого метода, зависит от аминокислотной шкалы, которая принимается за идеальную.
ФАО/ВОЗ принято, что 1 г «идеального» белка содержит (мг):
| Аминокислоты | мг/1 г белка |
| Изолейцин | 40 |
| Лейцин | 70 |
| Лизин | 55 |
| Серосодержащие соединения (метионин + цистин) | 35 |
| Ароматические соединения (фенилаланин + тирозин) | 60 |
| Трипрофан | 10 |
| Треонин | 40 |
| Валин | 50 |
Используют также отношение суммы незаменимых аминокислот к сумме заменимых. Этот показатель не должен быть ниже 0,4.
Более точную оценку биологической ценности выражает такой показатель, как КРАС (коэффициент рассчета аминокислотного скора). КРАС показывает среднюю величину избытка аминокислотного скора незаменимых аминокислот по сравнению с наименьшим уровнем скора какой-либо незаменимой аминокислоты (избыточное количество незаменимых аминокислот, не используемых на пластические нужды).
Расчет производится по формуле:
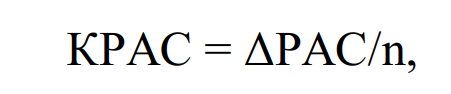
где n – количество незаменимых аминокислот; ΔРАС – отличие аминокислотного скора аминокислоты, %.
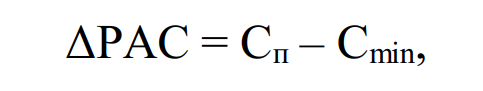
где Сп – аминокислотный скор n-й незаменимой аминокислоты, %; Cmin – минимальный из скоров незаменимых аминокислот исследуемого белка по отношению к эталону %.
Биологическая ценность (БЦ) пищевого белка (%) определяют по формуле:
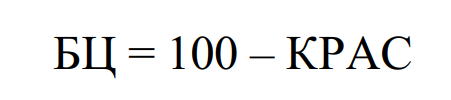
Биологические методы определения ценности основаны на изучении влияния одних и тех же количеств различных белков (исследованных и стандартных) на развитие организмов, рост.
Показатель, который характеризует биологическую ценность белка – коэффициент эффективности белка – КЭБ (Protein Efficiency Ratio – PER) – определяет увеличение массы тела животных в граммах на 1 г потребленного белка.
Для удовлетворения потребностей организма в аминокислотах целесообразно использовать комбинации пищевых продуктов по принципу дополнения лимитирующих аминокислот, например зерновых продуктов – молочными продуктами. Введение молочных продуктов способствует более полному усвоению белка зерновых продуктов, которые вследствие дефицита лизина усваивается не более чем на 60 %.
Важным показателем биологической ценности белков является их атакованность пищеварительными ферментами – свойство подлежать гидролизу в желудочно-кишечном тракте. Переваривание белков животного происхождения лучше, чем растительных.
В среднем белки пищи усваиваются на 92 %; усвоение белков животного происхождения составляет 97 %, растительных – лишь 83– 85 %. Это обусловлено значительным содержанием балластных веществ в продуктах растительного происхождения.
При выборе источников белков в пищевом рационе надо учитывать, что при наличии в них нуклеопротеинов в пищеварительном тракте освобождаются нуклеиновые кислоты. Конечным продуктом обмена этих соединений в тканях является мочевая кислота. Вследствие плохой растворимости она может задерживаться в организме, особенно при ограничении физической активности, а также у пожилых людей, способствует развитию подагры.
5. Рекомендуемые средние нормы белков в суточном рационе
В России приняты нормы белков, согласно которым благодаря белку пищи обеспечивается 11–13 % общей энергетической потребности организма; 50 % рекомендуемой нормы белка должно быть животного происхождения.
Потребность в белке зависит от возраста, пола, характера трудовой деятельности, климатических и национальных особенностей питания. Экспериментально установлен белковый минимум: в балансовых исследованиях определяют, при каком минимальном поступлении белков с пищей устанавливается азотистое равновесие. Белковый минимум равен 0,3–0,4 г/сут идеального белка на 1 кг массы тела.

У взрослого, практически здорового человека азотистое равновесие поддерживается при поступлении за 1 сут с пищей не менее 55–60 г белка, биологическая ценность которого равна 70 %. Однако, при разных обстоятельствах потеря белков в организме может усиливаться и потребления в пределах установленного минимума приведет к отрицательному азотистому балансу. При этом, согласно рекомендации ФАО/ВОЗ, белка нужно употреблять 85–90 г/сут.
Достаточный состав белков в питании улучшает противодействие организма вредным факторам, обеспечивает нормальный рост, психическое и физическое развитие. В среднем потребность в белке определяют равной не менее чем 1 г пищевого белка на 1 кг веса тела.
Потребность детей в белке значительно выше, чем у взрослых. Она составляет от 4,0 до 1,5 г/кг массы тела в связи с преобладанием в организме пластических процессов. Возрастает потребность в белке при тяжелом физическом труде, беременности, лактации. Обеспечение белками – проблема сугубо социальная, особенно в отношении детей.
Избыточное содержание белков в рационе питания приводит к увеличению образования аммиака в тканях, токсических продуктов в толстом кишечнике, повышению нагрузки на печень, в которой происходит их обезвреживание, и на почки, через которые они выводятся из организма. При низком уровне белка в рационе снижается уровень альбуминов в крови, возрастают потери аминокислот с мочой. Играют роль и метаболические нарушения, возникающие при белковой недостаточности, обусловленные глубокими изменениями активности различных ферментных систем клеток.
В последние годы за рубежом широкое распространение получили молочно-белковые концентраты, пищевой казеин, казеинаты, копрецепитаты в растворимой форме, белковые концентраты. Применяют также белковые изоляты и текстурированные продукты (искусственную говядину, свинину, птицу, молоко, сыры).
Большое внимание уделяют также нетрадиционным источникам белков (жмыхи подсолнечника, хлопка, рапса, кунжута, семена томатов, винограда, кукурузы и др.), которые раньше не использовались. До недавнего времени важным источником белка считали рыбные и нерыбные продукты мирового океана. Однако, его ресурсы небезразмерны. Промыслы основных видов рыб превысили допустимый уровень, который обеспечивает воспроизведение.
На степень усвоения организмом пищевых веществ, в том числе белков, значительно влияют характер и продолжительность кулинарной обработки продуктов. Применяя те или иные ее способы можно повысить степень усвоения пищевых веществ и снизить количество употребляемой пищи или, наоборот, ухудшить ее усвоение. Денатурация белковых молекул, которая вызывается тепловым воздействием, кислотами (во время маринования), сбиванием, облегчает доступ пищеварительных ферментов к пептидным связям и улучшает таким образом усвоение этих пищевых веществ.
После нагрева продукта (t не выше 70 ºС) переваривание происходит наиболее интенсивно, но этого недостаточно для того, чтобы довести блюдо до полной готовности. Длительная тепловая обработка (например, жарка) ухудшает усвоение белков, вследствие их чрезмерной денатурации, которая затрудняет проникновение ферментов через плотную кожуру, образующуюся на поверхности продуктов.
Вареное мясо или рыба усваиваются лучше, чем жареные, потому что соединительная ткань, которая содержится в них, во время варки приобретает желеобразное состояние, белки при этом частично растворяются в воде и легче расщепляются протеолитическими ферментами. Измельчение мяса облегчает процесс пищеварения, поэтому блюда из котлетной массы усваиваются лучше, чем из натурального мяса.
В настоящее время назрела необходимость пересмотра ряда традиционных рецептур, подбора целесообразного (с позиции физиологии питания) сочетания продуктов в блюдах, использования адекватных методов технологической обработки, которые будут экономить биологическую и пищевую ценность сырья, улучшать усвоение организмом его компонентов.


