Содержание страницы
1. Поглотительная способность почв
Способность почвы поглощать ионы и молекулы различных веществ из раствора, а также коллоидно-распыленные частички минерального и органического вещества, живые микроорганизмы и грубые суспензии и удерживать их называется поглотительной способностью почв.
Различают пять видов поглотительной способности: биологическую, механическую, физическую, химическую, физико-химическую или обменную.
Биологическая поглотительная способность связана с наличием в почве живых корней растений и микроорганизмов, которые избирательно поглощают из почвенного раствора азот и зольные элементы и переводят их в различные органические соединения своих тел. Вследствие этого питательные вещества предохраняются от выщелачивания из почвы. В результате биологической деятельности в почве накапливается органическое вещество, азот и зольные элементы.
Используя в качестве пищи и энергетического материала органические вещества, микроорганизмы разлагают их, переводят содержащиеся в них элементы питания в минеральную, доступную для растений форму. В то же время они сами потребляют некоторое количество питательных веществ для построения своих тел, переводят их в органическую форму и в этом смысле являются конкурентами растений.
При внесении в почву удобрений некоторая часть содержащихся в них питательных веществ также потребляются почвенными микроорганизмами. Считается, что биологическое поглощение азота и других элементов питания явление временное, так как после отмирания микроорганизмов их плазма быстро минерализуется, содержащиеся в ней элементы питания освобождаются в минеральной форме и могут использоваться растениями.
Однако если в почве находится достаточное количество легкодоступных органических веществ, служащих источником энергии для микроорганизмов, то происходит усиленное их размножение – часть поглощенного микроорганизмами азота передается из поколения в поколение и длительное время не освобождается в минеральной форме. Если процесс биологического поглощения питательных веществ микроорганизмами выражен слишком сильно, то это может неблагоприятно отразиться на питании культурных растений. Таким образом, в зависимости от конкретных условий биологическое поглощение питательных веществ микроорганизмами может иметь положительное значение или же играть отрицательную роль в питании растений.
Механическая поглотительная способность – это свойство почвы задерживать из раствора взмученные частицы твердого вещества. При фильтрации суспензии через почву частицы взвесей задерживаются в тонких и извилистых порах почвы.
Механическое поглощение – важное свойство почвы. Потоки весенних талых вод обычно несут большое количество взмученных почвенных частиц; но фильтруясь через почвы, они очищаются, и мелкозем, задержанный почвой, предохраняется от выноса в реки и моря. Вносимые в почву тонко размолотые удобрения (например, фосфоритная мука) не вымываются из её верхнего слоя вследствие механического поглощения.
Физическая поглотительная способность – это положительная или отрицательная адсорбция частицами почвы целых молекул различных веществ. Физическое поглощение главным образом зависит от суммарной поверхности твердых частиц почвы.
Энергетическим фактором, обусловливающим, явление адсорбции, служит свободная энергия молекул и ионов, находящихся на поверхности твердой фазы почвы. Почва стремится уменьшить величину свободной поверхностной энергии.
Уменьшение величины свободной поверхностной энергии происходит в основном за счет уменьшения поверхностного натяжения (ПН).
Благодаря этой поверхностной энергии почва способна адсорбировать газы, жидкости, твердые вещества.
Поглощение паров и газов может осуществляться только сухими почвами.
Кроме воды и газов на поверхности частиц могут сорбироваться растворимые в ней соли и органические вещества.
Если молекулы растворимого вещества притягиваются частицами почвы сильнее, чем молекулы воды, то у самой поверхности частиц, в пленке окружающего его раствора, создается повышенная концентрация этого вещества, а на некотором расстоянии от поверхности частиц концентрация будет ниже. В этом случае отмечается положительное физическое поглощение. Положительно поглощаются спирты, органические кислоты и пестициды, высокомолекулярные органические вещества. Из минеральных соединений почва положительно поглощает только щелочи. Для растворимых минеральных солей и неорганических кислот характерна, наоборот, отрицательная молекулярное физическое поглощение.
Отрицательное физическое поглощение наблюдается при взаимодействии почвы с растворами хлоридов и нитратов.
Отрицательное физическое поглощение хлоридов и нитратов обуславливает их высокую подвижность в почве. Поэтому при внесении удобрений, содержащих хлор и азот в нитратной форме это надо учитывать, т.е. хлорсодержащие удобрения желательно вносить с осени под основную обработку почвы, а удобрения, содержащие нитратный азот, — весной перед посевом.
Химическая поглотительная способность – это закрепление в почве ионов почвенного раствора в виде труднорастворимых соединений.
Химическое поглощение анионов и катионов в почве зависит от их способности образовывать нерастворимые или труднорастворимые соли при их взаимодействии, это следует учитывать при внесении удобрений в почву.
При химическом поглощении, в результате образования нерастворимых соединений, изменяется состав, соотношение и общая концентрация ионов в почвенном растворе. Образование нерастворимых солей в почве приводит к значительному снижению их доступности сельскохозяйственным растениям.
Соли, состоящие из двухвалентных катионов и анионов, как правило, слаборастворимые. Для поливалентных металлов характерно образование труднорастворимых комплексных органических и минеральных соединений. Например, химическое поглощение анионов фосфорной кислоты в почве происходит в результате образования широкого спектра труднорастворимых солей практически со всеми двух- и трехвалентными катионами.
При внесении в почву растворимых фосфорсодержащих удобрений в присутствии карбонатов происходит ретроградация (переход в нерастворимую форму) фосфора.
Са(Н2РО4)2 + Са(НСО3)2 → 2СаНРО4 ↓ + 2Н2СО3 Са(Н2РО4)2 + 2Са(НСО3)2 → Са3(РО4)2 ↓ + 4Н2СО3
В кислых дерново-подзолистых, серых лесных почвах, отличающихся высоким содержанием подвижных форм алюминия, железа и марганца, химическое поглощение фосфора преимущественно связано с образованием нерастворимых фосфатов железа, алюминия и марганца.
Таким образом, в результате химического поглощения растворимый фосфор минеральных и органических удобрений переходит в почвах в менее доступные для растений фосфаты.
В карбонатных почвах степной и сухостепной зоны с нейтральной, слабощелочной реакцией среды химическое поглощение тяжелых металлов происходит в результате образования труднорастворимых гидроксидов и карбонатов металлов, что значительно снижает их поступление в растения.
Физико-химическая или обменная поглотительная способность – это способность мелкодисперсных коллоидных частиц почвы, как минеральных, так и органических, несущих отрицательный заряд, поглощать различные катионы из раствора. При этом поглощение одних катионов сопровождается вытеснением в раствор эквивалентного количества других, ранее поглощенных твердой фазой почвы.
Обменному поглощению подвержены как катионы, так и анионы. Но в силу того, что в почвах преобладают отрицательно заряженные коллоиды, имеющие в диффузном слое мицеллы катионы, катионный обмен в почвах имеет наибольшее проявление.
При этом виде поглощения концентрация почвенного раствора не изменяется, а меняется только его состав, в то время как при химическом поглощении изменяются и состав, и общая концентрация почвенного раствора.
Основные закономерности обмена.
1. Обмен катионов происходит строго эквивалентно. Эквивалентность обмена катионами означает, что ионы почвенного раствора обмениваются с ионами диффузного слоя коллоидной частицы в строгом соотношении: грамм-эквивалент одного на грамм-эквивалент другого. Если, например, к почве, содержащей в коллоидной части в поглощенном состоянии катион кальция, прилит раствор нейтральной соли (например, KNO3), то реакция пойдет следующим образом:
ППК)Са + 2KNO3 ↔ ППК)2K + Ca(NO3)2
Калий из раствора поглотится почвой, а в растворе в эквивалентном количестве появится кальций.
Эквивалентность обмена катионов имеет большое значение. Она позволяет точно рассчитывать дозы мелиорирующих веществ.
2. Реакция обмена обратима и протекает в почве с большой скоростью.
3. Разные катионы обладают неодинаковой энергией к обменному поглощению. Энергия обмена зависит от валентности катионов. Чем выше валентность, тем выше энергия обмена, тем активнее катион обменивается с почвой и прочнее ею удерживается. В соответствии с этим имеется следующий ряд поглощения:
7Li < 23Na < 18NH4+ < 39K < 89Pb < 24Mg < 40Ca < 27Al < 56Fe
(NH4 + – исключение: имея меньшую массу, он занимает третье место после натрия).
В ряду катионов однозначной валентности активность их возрастает с увеличением атомной массы и уменьшением степени гидратации иона.
Исключение представляет водород; как одновалентный катион, он по своей активности приближается к трехвалентным ионам. Его активность объясняется тем, что он способен связываться только с одной молекулой воды и вступает в реакции обмена как гидроксоний (Н3О+). Вследствие чего, он оказывается практически негидратированным и имеет очень малый размер.
Катионы с большой активностью быстрее поглощаются почвой и прочнее удерживаются ею.
4. Реакция обмена подчиняется закону действующих масс. Если в растворе имеются различные катионы, но одной валентности, то при установившемся равновесии по завершении реакции обмена отношение поглощенных катионов в почве будет пропорциональным отношению между ними в растворе.
В случае разновалентных катионов в почвенном растворе характер поглощения будет зависеть от концентрации раствора. При увеличении концентрации раствора относительно больше поглощается одновалентных катионов, а при уменьшении концентрации раствора активнее поглощаются двухвалентные катионы. Следовательно, если почва просыхает и теряет влагу, то концентрация раствора в ней повышается, а это повышает поглощение одновалентных катионов. При химической мелиорации солонцовых почв это обстоятельство необходимо учитывать и всеми возможными средствами поддерживать в почве высокую влажность, тем самым активизируя поглощения почвой двухвалентного катиона кальция.
На ход обменных реакций и характер поглощения существенное влияние оказывают и индивидуальные свойства коллоидов.
В обменном поглощении катионов принимают участие главным образом высокодисперсные частицы почвы, как минеральные, так и органические.
Всю совокупность высокодисперсных почвенных частиц, обладающих обменной поглотительной способностью, К.К. Гедройц назвал ППК.
Физико-химическое поглощение катионов играет существенную роль в почвенных процессах, определяет важные физические свойства, физико-химические свойства почвы, ее структурное состояние, реакцию, буферность, имеет большое значение при взаимодействии с удобрениями.
Поглощение катионов почвой может сопровождаться их закреплением и переходом в необменное состояние. Необменно поглощаться почвой могут все катионы, но наиболее сильно способность к закреплению в необменной форме характерна для катионов K+ и NH4 +.
Необменное поглощение – явление неблагоприятное, так как калий и аммоний исключаются из раствора и становятся малодоступными для растений.
Необменная реакция обусловлена проникновением катионов в межпакетные пространства кристаллической решетки глинистых минералов. При последующем ее сокращении они оказываются замкнутыми.
2. Емкость катионного обмена (ЕКО)
Это одна из интегральных агрономических и экологических характеристик почв.
Общее количество способных к обмену поглощенных катионов в почве называется емкостью катионного обмена. Ее выражают в милиграмм-эквивалентах на 100 г почвы.
Величина емкости катионного обмена характеризует обменную поглотительную способность почв.
Емкость катионного обмена зависит от минералогического и гранулометрического составов почвы, от содержания гумуса в почве, от реакции почвы и соотношения в ней отрицательнозаряженных коллоидов к положительнозаряженным.
ЕКО обусловливает буферность почв по отношению к различным электролитам. Буферная способность почвы определяется зависимостью между концентрацией ионов, адсорбированных на твердой фазе, и концентрацией ионов в растворе. Ее рассчитывают по данным изотермы адсорбции.
С емкостью катионного обмена связывается устойчивость почв к техногенным воздействиям, в частности, к химическому загрязнению. По возрастающей степени устойчивости к антропогенному воздействию почвы разделяются на пять групп: 1) с ЕКО менее 10 мгэкв/100 г почвы; 2) 10…20; 3) 21…30; 4) 31…40; 5) более 40 мгэкв/100 г почвы.
Емкость катионного обмена у разных почв различная. Наиболее высокую емкость катионного обмена имеют богатые гумусом мощные черноземы. В почвах, расположенных к северу и к югу от типичного чернозема, количество емкость катионного обмена уменьшается. Различные почвы отличаются не только емкостью катионного обмена, но и по составу обменных катионов. Все почвы содержат в поглощенном состоянии Са и Мg. В черноземах на долю этих катионов приходится до 90 % емкости катионного обмена, а ионов водорода, алюминия и натрия содержится небольшое количество. В солонцах и солончаках наряду с Са и Мg присутствует много Na. В подзолистых и дерново-подзолистых почвах среди поглощенных катионов большое место занимают Н+ и Al3+ (до 50 %).
В оценке состава обменных катионов наибольшее значение имеют ионы Са2+, Mg2+, Na+, Н+, А13+. Первые три относятся к обменным основаниям. Водород и алюминий обусловливают гидролитическую кислотность, поглощенный натрий и повышенное количество магния — солонцеватость почв. Состав обменных катионов во многом определяет физические свойства почв.
В зависимости от состава обменных катионов К.К. Гедройц разделил все почвы на две группы: почвы, насыщенные основаниями, в составе обменных катионов которых присутствуют Са2+, Мg2+ и Na+, и почвы, ненасыщенные основаниями, содержащие наряду с Са2+ и Мg2+ катионы Н+ и Al3+.
Состав поглощѐнных катионов в почвах зонального ряда (таблица 1) определяется условиями почвообразования и, прежде всего, водным режимом.
Для почв экстрагумидных и rумидных областей с коэффициентом увлажнения (Ку) > 1 в составе ППК основную роль играют катионы Са2+, Мg2+, Н+, Аl3+; для семигумидных с Ку < 1 – Са2+, Mg2+ и для почв аридных областей с Ку < 0,5 – Са2+, Мg2+, Na+, иногда с существенным участием К+.
Таблица 1 – Физико-химические свойства пахотного слоя почв
| Почвы | ЕКО | Обменные катионы | V, % | pHH2O | pHKCl | ||
| Са2++Mg2+
(S) |
H++Al3+
(Нг) |
Na+,
% к ЕКО |
|||||
| мг-экв/100 г почвы | |||||||
| Дерновоподзолистые
суглинистые |
15–
25 |
10–15 | 5–10 | – | 60–
70 |
4,0–
6,0 |
3,0–
5,5 |
| Дерновоподзолистые песчаные
и супесчаные |
3–6 | 2–4 | 1–2 | – | 50–
70 |
5,0–
6,0 |
4,0–
5,0 |
| Серые лесные | 20–
30 |
16–26 | 2–5 | – | 70–
85 |
5,5–
6,5 |
5,0–
6,0 |
| Черноземы выщелоченные
и оподзоленные |
25–
40 |
18–35 | 5–7 | – | 80–
90 |
6,0–
6,5 |
6,0–
6,5 |
| Черноземы
типичные |
40–
70 |
37–75 | 3–5 | – | 90 | 6,8–
7,0 |
– |
| Черноземы
обыкновенные и южные |
25–
50 |
25–50 | – | 0,1–
15 |
100 | 7,0–
7,3 |
– |
| Каштановые | 20–
35 |
20–35 | – | 1–15 | 100 | 7,1–
7,5 |
– |
| Солонцы | 15–
25 |
15–25 | – | 15–
60 |
100 | 8,0–
10,0 |
– |
Емкость катионного обмена (ЕКО) колеблется от нескольких мгэкв/100 г почвы в экстрагумидных и экстрааридных областях до 50– 70 мг-экв/100 г почвы в чернозѐмах семигумидных (полувлажных) областей. Зональные показатели ЕКО прежде всего связаны с содержанием гумуса (наибольшее в черноземах, оно постепенно понижается к северу и югу от зоны их распространения). Кроме того ЕКО сильно зависит от гранулометрического состава (чем тяжелее, тем выше ЕКО), от минералогического и химического состава почв (ЕКО глинистых минералов варьирует от 5 мг-экв до 100–150 мг-экв/100 г). Наконец, ЕКО тесно связано с величиной рН. С ростом рН возрастает ионизация функциональных групп ацидоидов, снижается положительный заряд базоидов и возрастает ЕКО.
Состав обменных катионов оказывает большое влияние на свойства почвы и условия произрастания растений. Состав обменных катионов влияет на физические свойства и структурообразование почвы. У почв, насыщенных Са и Мg, реакция нейтральная, почвы хорошо оструктурены и обладают благоприятными физическими свойствами (черноземы, дерновые почвы). Почвы, содержащие в составе катионов наряду с Са2+ и Мg2+ значительное количество Na+ характеризуются щелочной реакцией, они плохо оструктурены и имеют неблагоприятные водно-физические свойства (солонцы, солонцеватые почвы).
Почвы, ненасыщенные основаниями, в составе обменных катионов которых кроме Са2+ и Мg2+ присутствуют Н+ и Al3+, имеют кислую реакцию, в них легко разрушаются коллоиды в результате кислотного гидролиза, они плохо оструктурены (подзолы).
3. Кислотность и щелочность
Характерным свойством почвы является ее реакция. Реакция почвы оказывает большое влияние на развитие растений и почвенных микроорганизмов, на скорость и направленность происходящих в ней химических и биохимических процессов.
Усвоение растениями питательных веществ, минерализация органических веществ, разложение почвенных минералов и растворение труднорастворимых соединений, коагуляция и пептизация коллоидов и другие физико-химические процессы в сильной степени зависят от реакции почвы.
Реакция почвенного раствора зависит от соотношения в нем ионов водорода (Н+) и гидроксила (ОН—). Концентрацию ионов водорода в растворе приято выражать символом рН, который обозначает отрицательный логарифм концентрации ионов водорода. В зависимости от концентрации ионов водорода и величины рН реакция почвенного раствора подразделяется следующим образом:
- Сильнокислая рН – < 4,5
- Кислая рН – 4,6–5,0
- Слабокислая рН – 5,1–5,5
- Близкая к нейтральной рН – 5,6–6,0
- Нейтральная рН – 6,1–7,1
- Слабощелочная рН – 7,2–7,5
- Щелочная рН – 7,6–8,5
- Сильнощелочная рН – > 8,5
В природных условиях реакция почвенного раствора колеблется от рН 3–3,5 (в сфагновых торфах) до рН 9–10 (в солонцовых почвах), но чаще всего она не выходит за пределы рН 4–8. Щелочную реакцию раствора имеют почвы сухих степей, полупустынь и пустынь – южные черноземы и каштановые почвы (рН 7,5), сероземы (рН до 8,5) и солонцы (рН до 9 и более). Нейтральная (рН 6,5–7,0) реакция раствора у обыкновенного и типичного чернозема. Оподзоленные черноземы и серые лесные почвы имеют слабокислую реакцию (рН 5,1–5,5), а дерново-подзолистые, подзолистые и торфяные почвы – кислую или сильнокислую (рН 4–5 и ниже).
Многие сельскохозяйственные культуры и почвенные микроорганизмы отрицательно относятся к повышенной кислотности и щелочности. В связи с этим важное значение имеет выяснение природы почвенной кислотности и щелочности и разработка способов их устранения.
Кислые атмосферные осадки являются внешним источником кислотности. Внутренние источники кислотности почвы многообразны и обусловлены протекающими в ней биологическими и химическими процессами. Одной из причин подкисления почв является жизнедеятельность растений и микроорганизмов. Корни растений и микрофлора в процессе дыхания выделяют значительное количество СО2, который, растворяясь в почвенном растворе, образует Н2СО3. Угольная кислота довольно слабая (К = 5–10-5) и заметно диссоциирует лишь при pH > 5, поэтому может быть важным источником Н+ лишь в нейтральных и щелочных почвах.
Наряду с дыханием корневая система растений и почвенная микрофлора в процессе жизнедеятельности выделяют в почву различные органические кислоты, подкисляющие почвенный раствор. Размер таких выделений за вегетационный период, по данным разных авторов может достигать 30–60 кг/га.
Значительное количество Н+ образуется в процессе минерализации растительных остатков и гумусовых веществ до органических и минеральных (HNО3, H2SО4, Н3РО4) кислот.
Корпи растений в ходе поглощения элементов питания выделяют Н+ и НСО3—, следовательно, могут быть источником как кислот, так и оснований
Наряду с минеральными и органическими кислотами большое подкисляющее действие почвенного раствора оказывают алюминий, железо, марганец и их соли:
Аl3+ + 3Н2O = Аl(ОН)3 + 3Н+
АlСl3 + 3Н2O = Аl(ОН)3 + 3НСl Аl(ОН)3 + 3Н+ + 3Сl—
Кислотность почвы тесно связана с содержанием в ППК кислотных обменных катионов (А1 и Н) и оснований. pH почвы снижается при увеличении их концентрации и увеличивается при повышении в ППК доли оснований.
Содержание подвижного алюминия в почвенном растворе при pH > 5 обычно незначительно, и кислотность почвы обусловливается в основном ионами Н+, однако его роль становится доминирующей в сильнокислых почвах в связи со значительным увеличением растворимости Аl(ОН)3 при pH < 4,5 и высвобождением алюминия из кристаллической решетки глинистых минералов. Содержание в почве подвижного алюминия более 20 мг/кг оказывает токсическое действие на рост и развитие большинства сельскохозяйственных культур. Наиболее чувствительны к алюминию овес, кукуруза, люцерна и сахарная свекла. Токсичности алюминия можно избежать, поддерживая pH почвы на уровне выше 5,5.
Многие минералы (алюмосиликаты и силикаты) при химическом выветривании образуют гидроксиды (Аl(ОН)3, Fe(OH)3, H4SiO4 и др.), являющиеся источником подкисления почв.
Сельскохозяйственное использование земель существенно нарушает равновесие между поступлением и выносом оснований, Распашка естественной растительности и обработка почвы вызывает активизацию микробиологических процессов, ускоренное разложение органического вещества и развитие кислотности. Влияние растительности на pH почвы носит неоднозначный характер. С одной стороны, образующиеся при разложении растительных остатков различные органические кислоты подкисляют почву, с другой – повышение гумусированности почвы за счет растительных остатков увеличивает емкость поглощения, что предотвращает вымывание оснований из почвы.
Кроме того, растения в значительной степени компенсируют выщелачивание, перехватывая корневой системой элементы питания в подпахотных слоях почвенного профиля. Питательные вещества, используемые растениями из всех горизонтов корнеобитаемого слоя почвы перераспределяются преимущественно в надземные органы растений и превосходящую по массе верхнюю часть корней, после отмирания которых большая часть элементов питания вновь возвращается в верхний (пахотный) слой почвы.
Значительное влияние на подкисление почвы оказывают минеральные удобрения – азотные, калийные и комплексные, не содержащие кальций или магний. Подкисляющее действие удобрений связано, с одной стороны, с пропорциональным урожаю увеличением выноса оснований (Са, Mg) из почвы. Применение минеральных удобрений увеличивает урожайность сельскохозяйственных культур, а, следовательно, и отчуждение оснований с товарной частью урожая.
Если при внесении удобрений урожай сена клевера увеличился в 3 раза, предположим, с 2 до 6 т/га, то суммарное отчуждение кальция и магния так возрастает примерно в 3 раза с 50–60 до 140–180кг/гa.
С другой стороны, вносимые с азотными и калийными удобрениями «балластные» анионы (Сl— и SO42-) при их вымывании из почвы вовлекают в этот процесс эквивалентное количество катионов (в основном Са2+и Mg2+).
В интенсивных овощных севооборотах потери кальция из почвы в результате отчуждения его с урожаем и вымывания составляют 150–200 кг/га, что приводит к интенсивному подкислению почвы и необходимости повторного известкования почв через 4–5 лет.
Заметное подкисление почвы вызывает систематическое применение физиологически кислых удобрений: NH4Cl, (NH4)2SO4, КСl и K2SO4, а также нитрификация аммонийных, амидных (NH2)2CO и аммиачных (NH3) удобрений.
При внесении извести, металлургических шлаков, фосфоритной муки и физиологически щелочных азотных удобрений – NaNO3, Ca(NO)2 – происходит нейтрализация почвенной кислотности.
В зависимости от локализации и степени подвижности ионов водорода в почве различают активную (актуальную) кислотность и потенциальную, которая в свою очередь подразделяется на обменную и гидролитическую.
Актуальная кислотность – это кислотность почвенного раствора, обусловленная повышенной концентрацией в ней ионов Н+ по сравнению с ионами ОН—.
Актуальная кислотность почвенного раствора зависит от наличия в ней свободных кислот, кислых солей и степени их диссоциации. В почвенном растворе свободные минеральные кислоты встречаются редко. В целинных, болотных и подзолистых почвах с высоким содержанием в почвенном растворе органических кислот (фульвокислота) роль их в создании концентрации ионов водорода возрастает. В большинстве почв актуальная кислотность обусловлена угольной кислотой и ее кислыми солями. Величину кислотности почвенного раствора выражают в мг-экв., и определяется она титрованием водной вытяжки из почвы, или выражается через величину рНН2О.
Потенциальная кислотность характерна для твердой фазы.
Потенциальная кислотность обусловливается наличием в твердой фазе почвы обменно-поглощенных ионов Н+ и Al3+. При взаимодействии почвы с растворами солей эти катионы вытесняются в раствор и подкисляют его.
ППК)Н+ + КСl → ППК)К+ + НСl ППК)Al3+ + 3 KCl → ППК)3К+ + АlCl3
Хлористый алюминий является гидролитически кислой солью и в водном растворе расщепляется на кислоту и основание.
АlCl3 + 3 Н2О → Аl(ОН)3 + 3 НCl
В зависимости от характера вытеснения различают две формы потенциальной кислотности – обменную и гидролитическую.
Обменная кислотность обусловливается наличием ионов водорода в твердой фазе почвы, которые вытесняются при обработке последней раствором нейтральной соли.
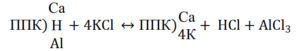
Обменная кислотность наиболее ярко выражена в подзолистых и красноземных почвах (рН 3–4).
При обработке почвы раствором нейтральной соли вытесняются не все поглощенные ионы водорода, то есть в этом случае не выявляется вся потенциальная кислотность. Более полно ионы водорода из ППК можно вытеснить, действуя на почву нормальным раствором гидролитически щелочной соли, например, уксуснокислым натрием (СН3СООNa).
ППК)Н+ + СН3СООNa ↔ ППК)Na+ + CH3COOH
При обработке почвы раствором такой соли вследствие щелочной реакции среды происходит более полное вытеснение поглощенного водорода.
Количество уксусной кислоты, определяемое титрованием, характеризует величину гидролитической кислотности.
Гидролитическая кислотность обычно больше обменной. Она может рассматриваться как суммарная кислотность почвы, состоящая из потенциальной и актуальной. Величина гидролитической кислотности измеряется в мг-экв. на 100 г почвы.
Доля участия в ППК поглощенных водорода и алюминия определяет степень насыщенности почв основаниями.
Степень насыщенности почв основаниями – это количество поглощенных оснований (S), выраженное в процентах от емкости катионного обмена (Е).
V = S : E ∙ 100
Щелочность почв подразделяется на актуальную и потенциальную щелочность.
Актуальная щелочность обусловливается наличием в почвенном растворе гидролитически щелочных солей (Na2CO3, NaНCO3, Ca(НCO3)2 и др.), которые при диссоциации определяют преобладающую концентрацию гидроксильных ионов.
Na2CO3 + 2Н2О ↔ Н2CO3 + 2NaОН NaОН ↔ Na+ + ОН—
Потенциальная щелочность обнаруживается в почвах, содержащих поглощенный натрий. При взаимодействии такой почвы с угольной кислотой, которая всегда имеется в почвенном растворе, происходит следующая реакция:
ППК)2Na + Н2CO3 ↔ ППК)2H + Na2CO3
В результате в почвенном растворе накапливается сода и происходит подщелачивание раствора.
Щелочность почвенного раствора выражается в мг-экв. Щелочность, как и кислотность, также является неблагоприятным свойством почвы.
Избыточная кислотность и щелочность почвы являются одной из причин ухудшения агромелиоративного состояния почв и снижения продуктивности сельскохозяйственных культур.
