Содержание страницы
- 1. Определение хлористого натрия (поваренной соли)
- 2. Определение концентрации водородных ионов (рН)
- 3. Определение продуктов первичного распада белков в бульоне (реакция с сернокислой медью)
- 4. Реакция на пероксидазу (бензидиновая проба)
- 5. Определение аммиака (качественная реакция)
- 6. Определение сероводорода (качественная реакция)
- 7, Определение массовой доли белковых веществ (сырого протеина)
- 8. Люминисцентно-спектральный метод
- 9. Метод определения содержания воды
- 10. Метод определения содержания жира по обезжиренному остатку (стандартный метод)
- 11. Определение содержания золы
- 12. Химические методы обнаружения и измерения радиоактивного излучения
В результате протекания сложных биохимических реакций и деятельности бактерий в процессе созревания и порчи рыбы образуются разнообразные химические соединения. По содержанию некоторых из них можно судить о доброкачественности рыбы и рыбных товаров, например, по общему азоту летучих оснований. Однако сложная цепь превращений веществ тканей рыбы и продуктов их распада не позволяет полагаться на химический анализ как универсальный объективный метод определения качества рыбных товаров.
Физические и химические лабораторные методы применяются, когда нужно определить содержание отдельных веществ (поваренной соли, воды, азота, солей тяжелых металлов, жира, белков и их состав и др.). Лабораторные методы используются также при разногласиях в оценках, полученных органолептическими методами.
При порче морских костистых рыб образуется большое количество аминов и, в частности, триметиламина (в результате восстановления триметиламиноксида), в то время как при порче мяса пресноводных рыб основную массу летучих оснований составляет аммиак. У хрящевых рыб также образуется триметиламин, но в меньшем количестве, чем у костистых морских рыб, для которых характерно образование большого количества аммиака за счет разложения мочевины.
1. Определение хлористого натрия (поваренной соли)
В упрощенном аргентометрическом методе навеску рыбного фарша 2–5 г, взвешенную с абсолютной погрешностью, не более 0,01 г помещают в химический стакан и приливают соответственно 98–95 см3 или 248–245 см3 дистиллированной воды, размешивают стеклянной палочкой, настаивают и через 25–30 мин фильтруют через бумажный слой, вату или двойной слой марли в мерную колбу.
В две колбы для титрования отбирают пипеткой 10–25 см3 фильтрата, добавляют 3–4 капли раствора хромового калия и титруют из бюретки раствором азотнокислого серебра до неисчезающей красновато-бурой окраски.
Массовую долю хлористого натрия (%) вычисляют по формуле
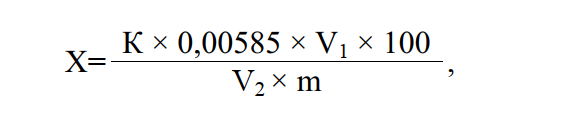
где V – объем водной вытяжки в мерной колбе, см3;
V1 – объем раствора азотнокислого серебра 0,1 моль/дм3, израсходованный на титрование исследуемого раствора, см3;
V2 – объем водной вытяжки, взятой для титрования, см3; m – навеска исследуемого образца, г;
0,00585 – количество хлористого натрия, соответствующее 1 см3 раствора 0,1 моль/дм3 азотнокислого серебра;
К – коэффициент перерасчета на точный раствор 0,1 моль/дм3 азотнокислого серебра.
За окончательный результат принимают среднее арифметическое значение результатов двух параллельных определений, допускаемые расхождения между которыми не должны превышать 0,2 % (рис. 1).

Рисунок 1 – Набор реактивов для ветеринарно-санитарной экспертизы рыбы
2. Определение концентрации водородных ионов (рН)
К 5 г рыбного сырья добавляют 50 мл дистиллированной воды и настаивают в течение 30 мин при периодическом помешивании, фильтруют через бумажный фильтр. Фильтрат используют для исследования, где рН определяют рН-метром колориметрическим методом или индикаторной бумажкой (рис. 2).
У свежей рыбы фильтрат слегка ополесцирует, рН – до 6,9, у рыбы сомнительной свежести фильтрат слегка мутноватый, рН – 7–7,2, у несвежей рыбы фильтрат мутный, запах неприятный, рН – 7,3 и более.
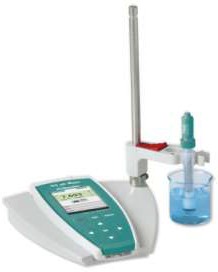
Рисунок 2 – рН-метр
3. Определение продуктов первичного распада белков в бульоне (реакция с сернокислой медью)
В коническую колбу Эрленмейера помещают 20 г рыбного фарша из спинных мышц рыб, добавляют 60 мл дистиллированной воды и тщательно перемешивают. Колбу накрывают часовым стеклом и нагревают в течение 10 мин на кипящей водяной бане. Бульон фильтруют через бумажно-ватный фильтр в пробирку, помещенную в стакан с холодной водой. В 2 мл бульона добавляют три капли 5 %-го раствора сернокислой меди, встряхивают 2–3 раза и выдерживают 3–5 мин. Оставшийся бульон служит контролем.
Бульон из мяса свежей рыбы – слегка мутный, из мяса рыбы сомнительной свежести – заметно мутный, бульон из мяса несвежей рыбы содержит хлопья и желеобразный сгусток сине-голубого цвета.
4. Реакция на пероксидазу (бензидиновая проба)
В бактериологическую пробирку вносят 2 мл водной вытяжки (1:10) из жаберной ткани и добавляют пять капель 0,2 %-го спиртового раствора бензидина. Содержимое пробирки взбалтывают, после чего вносят 2 капли 1 %-го раствора перекиси водорода. Вытяжка из жаберной ткани свежих рыб, дает синюю окраску, переходящую через 1–2 мин в коричневую (положительная реакция). Вытяжка из жаберной ткани сомнительной свежести дает менее интенсивную окраску и переходит в коричневый цвет через 3–4 мин (сомнительная реакция). Вытяжка из жаберной ткани несвежей рыбы не дает синей окраски, а сразу переходит в коричневый цвет (отрицательная реакция).
5. Определение аммиака (качественная реакция)
Метод основан на взаимодействии аммиака, образующегося при порче рыбы, с соляной кислотой и появлении при этом облачка хлористого аммония.
В широкую пробирку наливают 2–3 см3 реактива Эбера (смесь одной части соляной кислоты, трех частей этилового спирта и одной части серного эфира), закрывают пробкой и встряхивают два-три раза. Вынимают пробку из пробирки и сразу же закрывают ее другой пробкой, через которую продета тонкая стеклянная палочка с загнутым концом. На конец палочки должен быть прикреплен кусочек исследуемого мяса рыбы, имеющий температуру, близкую к температуре воздуха лаборатории. Мясо вводят так, чтобы оно не касалось стенок пробирки и находилось на расстоянии 1–2 см от уровня жидкости.
Через несколько секунд в результате реакции аммиака с соляной кислотой образуется облачко хлористого аммония. Время появления и устойчивость облачка зависят от концентрации аммиака. Свежая рыба дает отрицательную реакцию (отсутствие облачка). Реакция на аммиак показательна только у несоленой рыбы и соленой не созревающей – воблы, леща, сазана, судака и других. Она непригодна для исследования соленой созревающей рыбы (сельди), так как при посоле ее происходит глубокий автолиз, и образуются амины жирного ряда (моно- и триметиламины), NH3, реагирующие с реактивами на аммиак.
6. Определение сероводорода (качественная реакция)
Метод основан на взаимодействии сероводорода, образующегося при порче рыбы, со свинцовой солью с появлением темного окрашивания.
15–25 г исследуемого рыбного фарша помещают рыхлым слоем в бюксу вместимостью 40–50 см3. В бюксу подвешивают горизонтально над фаршем полоску плотной фильтровальной бумаги, на поверхность которой, обращенной к фаршу, нанесены 3–4 капли раствора свинцовой соли. Диаметр капли 2–3 см. Расстояние между бумагой и поверхностью фарша должно быть 1 см. Бюксу сверху закрывают крышкой, зажимая фильтровальную бумагу между крышкой и корпусом бюксы и оставляют стоять при комнатной температуре.
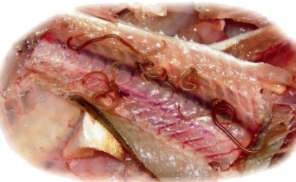
Глубокий распад белков определяют по содержанию азота летучих оснований и качественными реакциями на присутствие аммиака и сероводорода (ГОСТ 7636-85) (рис. 3).
Рисунок 3 – Определение содержания азота и летучих оснований
Параллельно проводят контрольный анализ без навески продукта.
По истечении 15 мин бумагу снимают и сравнивают ее окраску с окраской бумаги, смоченной тем же раствором свинцовой соли (контрольный анализ). При наличии в исследуемом образце свободного сероводорода происходит побурение или почернение участков бумаги, смоченных раствором свинцовой соли.
7, Определение массовой доли белковых веществ (сырого протеина)
Макрометод основан на окислении органического вещества при сжигании его в серной кислоте в присутствии катализатора, отгонке образующегося аммиака паром, улавливании его раствором серной кислоты и определении содержания азота методом титрования.
Навеску мяса рыбы, взвешенную с абсолютной погрешностью до 0,0005 г в закрытой с одной стороны трубочке из фильтровальной бумаги или из станиоля, помещают в колбу для сжигания. Добавляют несколько мелких кристаллов медного купороса и приливают 10–20 см3 концентрированной кислоты.
Колбу с содержимым осторожно нагревают в вытяжном шкафу, не допуская разбрызгивания жидкости. Когда содержимое колбы станет однородным, прекращают нагревание, дают остыть, добавляют 0,5 г сернокислого калия и продолжают нагревать до тех пор, пока жидкость в колбе не станет прозрачной, зеленовато-голубой окраски без бурого оттенка.
По окончании сжигания содержимое колбы охлаждают и переносят в отгонную колбу, приливают раствор гидроокиси натрия и бросают кусочек лакмусовой бумаги (реакция жидкости должна быть резко щелочной), закрывают пробкой, соединенной с холодильником. Приемная колба содержит раствор серной кислоты, конец отгонки определяют по лакмусовой бумаге (капля дистиллята не должна вызывать посинения красной лакмусовой бумаги).
Белковое вещество определяют, умножая рассчитанное количество общего азота на 6,25.
8. Люминисцентно-спектральный метод
При проведении люминисцентно-спектрального анализа под люминисцентным микроскопом непосредственно исследуют кусочки глубоких слоев спинных мышц рыб. Под действием ультрафиолетовых лучей длиной волны 360–370 нм мышечная ткань свежих рыб флюоресцирует сине-голубоватым цветом, а капельки крови дают темно-коричневую окраску. При хранении рыбы без воды в течение 10 ч при комнатной температуре окраска мышечной ткани и крови приобретает более интенсивный оттенок. Мясо несвежей рыбы светится тусклым сине-голубым цветом с желто-зеленоватым оттенком. Кровь имеет оранжевое свечение (рис. 4).
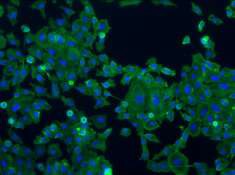
Рисунок 4 – Свечение мяса несвежей рыбы
9. Метод определения содержания воды
Количество воды в рыбных продуктах нормируется стандартами и, следовательно, является одним из показателей их качества. В гидробионтах и вырабатываемых из них продуктах формы связи воды с другими веществами различные (химическая, адсорбционная, капиллярная, осмотически связанная, свободная вода). Прочность указанных форм связи и количество удерживаемой ими воды в материале различны, поэтому нет и не может быть единого метода определения содержания воды в продуктах. Выбор метода зависит от природы исследуемого материала, цели исследования, сложности и степени точности метода, а также продолжительности анализа.
Метод определения содержания воды высушиванием пробы при температуре плюс 100–105 °С (арбитражный метод). Метод применяется при определении содержания воды в рыбе, морских млекопитающих, беспозвоночных, водорослях, а также вырабатываемых из них пищевых, кормовых и технических продуктах, кроме жира.
Навеску анализируемой пробы около 2 г (для паюсной икры 3–4 г), взвешенную с погрешностью не более 0,001 г, следует поместить в чистую, высушенную и тарированную бюксу, снабженную в случае необходимости стеклянной палочкой с оплавленными концами, при помощи которой навеска материала распределяется в бюксе ровным тонким слоем. В случае использования высушенной навески для последующего определения содержания жира масса анализируемой пробы может быть увеличена до 5 г. Бюкса должна быть закрыта притертой крышкой и взвешена на аналитических весах. Высушивание навески до постоянной массы следует проводить в сушильном шкафу при температуре плюс 100–105 °С.
В течение первых 2 ч навеску рыбы (за исключением сушеной рыбы, вяленной и холодного копчения) или другого продукта, с содержанием жира до 20 % рекомендуется сушить при температуре плюс 60–80 °С. Если жирность исследуемого образца более 20 %, то первые 2 ч высушивание необходимо проводить при температуре плюс 60–65 °С, а при содержании жира более 40 % (например, печень тресковых рыб) – при температуре плюс 60–65 °С в потоке инертного газа. Первое взвешивание должно проводиться через 3 ч после начала высушивания, а последующие взвешивания – через 30–40 мин. Постоянство массы считается достигнутым, если разница между двумя взвешиваниями не превышает 0,001 г. Перед каждым взвешиванием
бюкса с пробой должна быть закрыта крышкой и охлаждена до комнатной температуры (около 30 мин) в эксикаторе. При исследовании рыбы и других продуктов, способных при высушивании спекаться в плотную массу, в бюксу предварительно необходимо вносить 5–6 г кварцевого песка, чистого и прокаленного, и навеску материала тщательно перемешивать с песком.
Содержание воды Х (%) рассчитывается по формуле
X = (m1–m2)×100 / (m2–m), (2)
где m – масса бюксы с навеской пробы исследуемого материала и песком до высушивания, г;
m1 – масса бюксы с навеской пробы исследуемого материала и песком после высушивания, г;
m2 – масса бюксы с песком, г.
Расхождение между параллельными определениями не должно превышать 0,5 %. Чем выше общее содержание воды в мясе рыбы, тем ниже ее качество. Такая рыба начинает быстро разлагаться. Неживая рыба при хранении в воде легко впитывает жидкость. Снулые карпы через 20 ч увеличивают массу на 2–3 %, а растительноядные до 5 %. Увеличение массы на 1–2 % за счет накопления воды мышцами отмечается у живых ослабленных рыб: больных, отравленных, утомленных, травмированных, выращенных в плохих гидротехнических условиях.
10. Метод определения содержания жира по обезжиренному остатку (стандартный метод)
Количество жира в продукте определяется по уменьшению массы сухой навески рыбного сырья после экстракции растворителем. Навеску исследуемого объекта в количестве 2–5 г, взвешенную с погрешностью 0,001 г, следует высушить в сушильном шкафу при температуре плюс 100–105 °С и перенести в пакет из фильтровальной бумаги размером 8×9 см. Стенки бюксы протереть небольшим количеством ваты, смоченной в эфире. Вату вместе с навеской рыбного сырья поместить в пакет из фильтровальной бумаги.
Пакет с навеской вложить во второй пакет размером 9×10 см так, чтобы линии загиба пакетов не совпадали, и перевязать их ниткой. Наружный пакет пронумеровать простым графитовым карандашом, поместить в ту же бюксу, в которой ранее высушивалась навеска, и поставить в сушильный шкаф. Высушить до постоянной массы при температуре плюс 100–105 °С. Можно сушить навеску непосредственно в пакете. Высушенный пакет с навеской должен быть помещен в экстрактор аппарата Сокслета. В один аппарат можно помещать несколько пакетов при условии, что все они полностью погружены в эфир и хорошо омываются им.
Продолжительность экстрагирования составляет 10–12 ч. Окончание процесса устанавливается следующим образом. Каплю раствора (мисцеллы), вытекающего из экстрактора аппарата, следует нанести на часовое стекло. При полном извлечении жира из навески на стекле после испарения растворителя не должно быть жирного пятна. Пакеты с обезжиренной навеской перенести в ту же бюксу и выдержать в вытяжном шкафу 20–30 мин для удаления эфира, а затем высушить в шкафу при температуре плюс 100–105 °С до постоянной массы. Длительность процесса от 1 до 3 ч.
Содержание жира Х (в %) рассчитывается по формуле
x = (m1–m2)×100/m, (3)
где m2 – масса высушенных бюксы, пакета и навески продукта до проведения экстракции, г;
m1 – масса высушенных бюксы, пакета и навески продукта после экстракции жира.
Расхождение между параллельными определениями не должно превышать 0,5 %.
11. Определение содержания золы
Метод основан на полном сжигании органических веществ, удалении продуктов их сгорания и определении оставшейся минеральной составной части (золы) исследуемого материала [22, 23].
Навеску рыбного сырья массой 3–5 г, взвешенную с погрешностью не более 0,0001 г, следует поместить в предварительно прокаленный до постоянной массы платиновый или фарфоровый тигель, и озолить, предварительно обуглив. Если исследуемое вещество влажное, тигель с навеской поместить в сушильный шкаф для подсушивания навески. При анализе сухого рыбного белка брать навеску массой 1–1,5 г.
Для обугливания тигель с исследуемой навеской необходимо нагреть на слабом огне (на песочной бане или асбестовой сетке нагревательного прибора), избегая вспучивания и разбрызгивания содержимого тигля, а затем на более сильном огне до прекращения выделения газов, не давая веществу воспламеняться. Окончательное озоление навески проводить в муфельной печи при температуре плюс 300–400 °С, повышая ее к концу процесса озоления до плюс 500 °С (начало темно-бурого каления). Если при озолении частицы угля исчезают очень медленно, тигель следует охладить, содержимое смочить горячей дистиллированной водой или 3 %-м раствором перекиси водорода. Затем осторожно выпарить воду, не доводя ее до кипения во избежание потерь золы при разбрызгивании. После выпаривания золу подсушить и прокалить до исчезновения частиц угля. Смачивание и прокаливание продолжать до тех пор, пока частицы угля не исчезнут.
При значительном содержании солей в сжигаемом веществе (соленые продукты) последнее нужно сначала осторожно обуглить, прибавить примерно 10 см3 горячей дистиллированной воды и нагреть на кипящей водяной бане (1–20 мин). Затем отфильтровать через беззольный фильтр в колбу или стакан и промыть уголь и фильтр небольшим количеством кипящей воды. Фильтр с обугленными частицами перенести обратно в тигель и полностью озолить. К остатку прибавить фильтрат, выпарить досуха на водяной бане, высушить в сушильном шкафу, слабо прокалить и взвесить. Полученная после сжигания зола должна быть однородной, белой или слегка окрашенной и не должна содержать частичек несгоревшего угля.
По окончании озоления тигель охладить в эксикаторе и взвесить. Прокаливание повторить до получения постоянной массы тигля с золой. Содержание золы Х (в %) рассчитывается по формуле
x = (m2-m1)×100/m, (4)
где m2 – масса тигля с золой, г; m1 – масса пустого тигля, г;
m – масса исследуемого вещества, г.
Расхождение между параллельными определениями не должно превышать 0,05 %.
12. Химические методы обнаружения и измерения радиоактивного излучения
Природная радиоактивность обусловлена радиоактивными изотопами естественного происхождения, присутствующими во всех оболочках земли, – литосфере, гидросфере, атмосфере и биосфере.
Естественная радиоактивность растений и пищевых продуктов обусловлена поглощением ими радиоактивных веществ из окружающей среды. Из естественных радиоактивных веществ наибольшую удельную активность в растениях составляет К40, особенно в бобовых растениях. Многие наземные растения, особенно водоросли, обладают способностью концентрировать в своих тканях радий из почв и воды, некоторые накапливают уран. Анализы различных продуктов питания показали, что радий постоянно присутствует в хлебе, овощах, мясе, рыбе и других продуктах питания. Так как в морях и океанах тонут атомные подводные лодки, происходит разлив отходов, вода разносит опасность по Земле, а гидробионты являются неотъемлемым продуктом нашего рациона.
Накопление радиоактивных веществ органами и тканями рыб, а также распределение и выделение их зависит от целого ряда условий, основными из которых являются:
- химическая природа радиоизотопов и периоды их полураспада;
- концентрация радиоизотопов в воде;
- вид, возраст и физиологическое состояние рыб;
- экологические условия.
Различные радиоизотопы, попадая в организм рыб, распределяются по органам и тканям неравномерно.
Концентрация в тканях определяется в первую очередь их химическими свойствами. Встречаясь с различными химическими соединениями, входящими в состав тканей рыб или являющимися продуктами обмена веществ, радиоизотопы вступают с ними в обменные реакции. Так, радиостронций очень близок в химическом отношении к кальцию и, попадая в животный организм, откладывается в кальцийсодержащих тканях (главным образом в костях). Повышение содержания нерадиоактивного кальция в окружающей воде ведет к снижению кумуляции радиостронция рыбами.
Ход направленности обменных реакций в организме рыб определяется соотношением между процессами накопления и выведения радиоизотопов организмом.
Отбор проб производится согласно СТБ 1050-98 «Радиационный контроль. Отбор проб продукции животноводства. Общие требования», утвержденному постановлением Государственного комитета по стандартизации, метрологии и сертификации Республики Беларусь от 5 февраля 1998 г. № 3 [25].
Поглощение энергии ионизирующих излучений в веществе может вызывать различные химические реакции, приводящие к необратимым изменениям в химическом составе вещества. Измеряя выход химических реакций, то есть количество вновь образованных конечных продуктов реакций, можно определить поглощенную энергию.
На этом принципе основаны химические методы обнаружения и измерения радиоактивного излучения (рис. 5).

Рисунок 5 – Определение радиации рыбы
Достоинство химических детекторов заключается в возможности выбора таких веществ, которые по воздействию на них ионизирующих излучений мало отличаются от тканей.
Следовательно, химические изменения, происходящие в этих веществах под действием излучения, могут непосредственно служить мерой энергии излучения, поглощенной тканью. Химические детекторы могут быть использованы для измерений больших доз гаммаизлучения (рис. 6).

Рисунок 6 – Проведение масс-спектрометрии