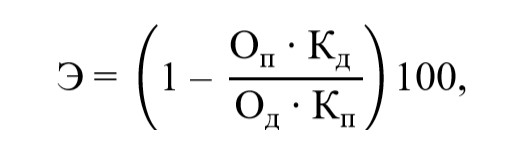Содержание страницы
- 1. Синтетические пиретроиды
- 2. Фосфорорганические инсектициды
- 3. Карбаматы
- 4. Неоникотиноиды
- 5. Фенилпиразолы
- 6. Оксадиазины
- 7. Семикарбазоны
- 8. Антраниламиды
- 9. Растительные инсектициды
- 10. Авермектины
- 11. Тетроновые кислоты (кетоенолы)
- 12. Пиридины
- 13. Сера
- 14. Изотиоцианаты
- 15. Пиразолы
- 16. Тетразины
- 17. Эфирсульфиты
- 18. Бутенолиды
- 19. Родентициды
- 20. Моллюскоциды
- 21. Нематициды
1. Синтетические пиретроиды
По масштабам производства и числу выпускаемых препаратов для борьбы с вредителями первое место занимают синтетические пиретроиды. Высушенные цветки некоторых видов ромашки использовались в качестве инсектицида еще в Древнем Китае и затем в средние века в Персии. Началом научных исследований этих веществ можно считать 1694 г., когда впервые были описаны растения далматской, или пепельнолистной, ромашки, которая в диком виде росла на Кавказе и в Далмации (район Югославии).
Предшественником синтетических пиретроидов является природный пиретрум (Pyrethrum) – получаемый из цветков кавказской, персидской, далматской и других видов ромашки «персидский порошок». В 30-х гг. XX столетия на основе извлечения пиретринов органическими растворителями из цветков ромашки начато производство препаратов пиретрума – вязких, тяжелых, белых масел почти без запаха, нерастворимых в воде и содержащих от 2–10 до 90 % смеси пиретринов.
Действующим началом пиретрума являются шесть близких по химическому строению веществ: пиретрин-1 и пиретрин-2, циперин-1 и циперин-2, жасмолин-1 и жасмолин-2, объединенных под общим названием – пиретрины. Это сильнодействующие контактные яды для насекомых. В настоящее время используются как добавка к пиретроидам для усиления их действия.
Природные пиретрины хоть и обладают высокой инсектицидной активностью, но быстро разлагаются на свету, поэтому непригодны для использования в сельскохозяйственном производстве. Их применение возможно в бытовых условиях для борьбы с домашними насекомыми.
Синтез первого пиретроида (аллетрина) был осуществлен в 1949 г. Шехтером, Грином и Ла Форжем. С тех пор синтезировано более 8000 пиретроидов, но лишь немногие из них выпускаются в промыш-ленных масштабах.
В настоящее время существует несколько альтернативных классификаций синтетических пиретроидов. Мы остановимся на двух из них, по которым пиретроиды подразделяют на три группы (поколения).
По первой классификации пиретроиды первого поколения – это эфиры хризантемовой кислоты. Их получают взаимодействием хлорангидрида хризантемовой кислоты со спиртовой компонентой в присутствии третичных аминов или переэтерификацией этилового эфира хризантемовой кислоты в присутствии натрия. Наиболее токсичные для насекомых соединения найдены среди эфиров циклопентенонов, замещенных бензиловых спиртов и N-оксиметилимидов.
На основе пиретроидов первого поколения выпускаются препараты: аллетрин, фуретрин, циклетрин, бартрин, неопинамин. Эти соединения обладают высокой инсектицидной активностью, но, как и природные пиретрины, легко окисляются на свету, и поэтому их использование возможно лишь в закрытых помещениях. Их также включают в состав противомоскитных тлеющих спиралей, пластин типа «Москитол» и «Фумитокс», а также аэрозольных баллончиков, предназначенных для борьбы с бытовыми насекомыми. В сельскохозяйственном производстве они не используются.
В результате многолетних исследований пиретринов в 1976–1977 гг. ученым удалось получить фотостабильные пиретроиды второго поколения, применение которых стало возможным в сельском хозяйстве. Это были пиретроиды на основе перметрина, циперметрина, дельтаметрина, фенвалерата.
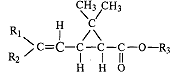
Их синтез основан на использовании эфиров 3-замещенной
2,2-диметилциклопропанкарбоновой (хризантемовой) кислоты или изостерической кислоты, потерявшей пропановый цикл, и соответствующего спирта, содержащего одну или две насыщенные связи (рис. 1).
 |
 |
| а | б |
| Рис. 1. Структурные формулы кислот, на которых основан синтез современных синтетических пиретроидов: а – хризантемовая кислота; б – изостерическая кислота | |
Особенностью данных пиретроидов является наличие 4–8 оптических или геометрических изомеров, которые отличаются по биологической активности. Так, современные пиретроиды на основе циперметрина, альфа-, бета-, зета-циперметрина в своем составе имеют различное содержание изомеров. Причем цис-изомеры, как правило, более токсичны для теплокровных животных, чем транс-изомеры.
В основе хризантемовой кислоты построены молекулы перметрина, циперметрина, дельтаметрина, изостерической кислоты – фенвалерата.
У перметрина R1 и R2 = Cl.
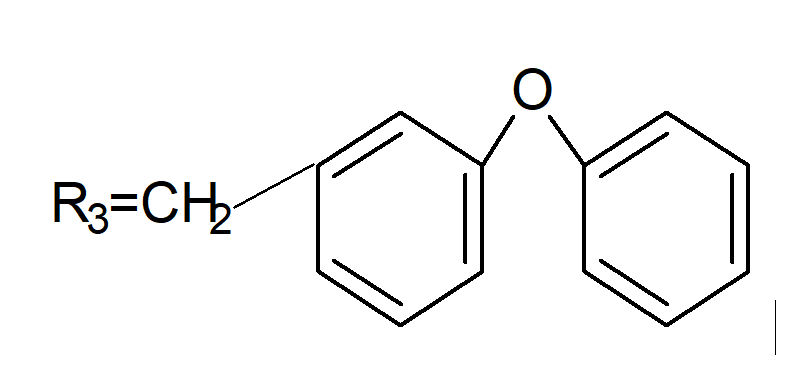
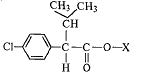
У циперметрина R1 и R2 = Cl.
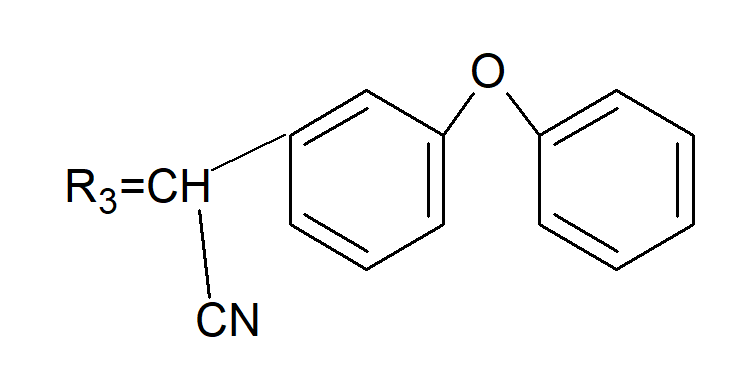
У дельтаметрина R1 и R2 = Вr, R3 такой же, как R3 у циперметрина.
У фенвалерата X такой же, как R3 у циперметрина.
Высокая инсектицидная активность, продолжительное защитное действие при низких нормах расхода, составляющих не килограммы, как у хлорорганических соединений, и даже не сотни граммов, как у фосфорорганических соединений, а всего лишь десятки граммов, позволили синтетическим пиретроидам занять лидирующее место в защите растений.
Все пиретроиды второго поколения значительно превосходят
пиретрины по инсектицидным свойствам. (Так, оптически активный дельтаметрин активнее природного пиретрина в 900 раз.) Их широко используют для борьбы с вредителями зерновых, технических, овощных, ягодных и плодовых культур. Кроме того, они находят применение против бытовых насекомых, для обработки тканей и тарных материалов. К их недостаткам относится высокая токсичность для пчел и рыб, отсутствие системного действия и низкая эффективность в качестве протравителей в борьбе с почвообитающими насекомыми.
К синтетическим пиретроидам третьего поколения относятся цигалотрин, флуцитринат, флувалинат, тралометрин, цифлутрин, фенпропатрин, бифентрин, циклопротрин, а также этофенпрокс, который, в отличие от других пиретроидов, не содержит сложноэфирной группы. Некоторые из этих пиретроидов обладают высокой активностью против клещей (акарициды), меньшей токсичностью для пчел, птиц и рыб. Наибольшее распространение из пиретроидов третьего поколения нашел цигалотрин, который в 2,5 раз активнее дельтаметрина. В Беларуси, кроме цигалотрина, на пестицидном рынке также присутствуют препараты на основе флувалината, цифлутрина и бифентрина.
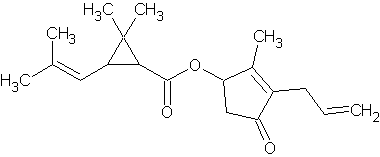
По второй классификации к пиретроидам первого поколения относятся вещества, которые имеют общую формулу CnHnOn и в которых отсутствуют токсофорные и цианогруппы. Например, действующее вещество аллетрин имеет брутто-формулу C19H26O3, а его структурная формула имеет следующий вид:
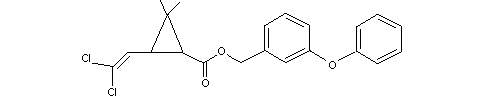
К синтетическим пиретроидам второго поколения относятся вещества, в состав которых входит токсофорная группа. Токсофорная группа – это химические радикалы или атомы, которые увеличивают токсичность веществ. К ним можно отнести галоиды (Cl, Br, J, F), нитрогруппу, атомы тяжелых металлов (Hg, Sn, Cu), группу родана (SCN)2 и некоторые другие. Например, действующее вещество инсектицида Цифум, насыпная шашка, перметрин имеет брутто-формулу C21H20Cl2O3, а его структурная формула имеет следующий вид:
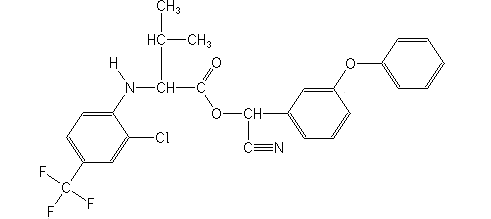
Синтетические пиретроиды третьего поколения имеют в своем составе цианогруппу C≡N, наличие которой приводит к повышению инсектицидных свойств. При этом действующие вещества имеют общую формулу R–C≡N. Так, химическая формула тау-флювалината имеет вид C26H22ClF3N2O3, а структурная представлена ниже.
Синтетические пиретроиды – липофильные вещества, хорошо удерживаются кутикулой листьев, ограниченно проникая в них. Они нелетучи, на неживой поверхности могут сохраняться до 12 месяцев (перметрин). Синтетические пиретроиды нетоксичны для растений, период их полураспада на разных растениях составляет 2–20 дней.
Пиретроиды плохо передвигаются в почве и разлагаются в ней с участием микроорганизмов. По данным В. Г. Каплина, в лабораторных условиях Децис, к. э. в рекомендуемых нормах расхода в первые 3–5 дней после воздействия вызывал незначительное угнетение почвенных микроорганизмов, в частности жгутиконосцев, в дальнейшем, напротив, стимулировал их развитие. Период полураспада синтетических пиретроидов в почве 1–10 недель. Основными метаболитами синтетических пиретроидов являются продукты их гидролиза (3-феноксибензойная и соответствующие карбоновые кислоты), которые нетоксичны и выделяются у млекопитающих с мочой в свободном виде и в виде конъюгатов.
Синтетические пиретроиды – препараты контактно-кишечного действия. Обладают высокой инсектицидной активностью, эффективны против чешуекрылых, жесткокрылых, двукрылых и других отрядов. Современные пиретроиды обладают также и акарицидным действием.
Часто пиретроиды комбинируются с действующими веществами, которые относятся к другим химическим классам. При этом наблюдается синергетический эффект, позволяющий снизить норму расхода компонентов при сохранении высокой эффективности и не допустить возникновения устойчивости насекомых-вредителей к инсектицидам.
Синтетические пиретроиды почти нерастворимы в воде. Их применяют для опрыскивания растений в период вегетации, складских помещений, зерна при хранении в основном в виде концентратов эмульсий, реже концентратов суспензий, масляных эмульсий, водных эмульсий, микрокапсулированных суспензий, водно-диспергируемых гранул, водорастворимых гранул, насыпных шашек.
Механизм действия. Пиретроиды нарушают функцию нервной системы, действуя на натрий-калиевые каналы и обмен кальция в пресинаптической мембране аксонов, что приводит к выделению излишнего количества ацетилхолина при прохождении нервного импульса. Действие инсектицида проявляется в сильном возбуждении, поражении двигательных центров с последующим параличом и смертельным исходом. Другой причиной смерти является подавление активности ферментов монооксигеназ.
Пиретроиды считаются менее токсичными для человека и теплокровных животных, чем инсектициды других групп. Это обусловлено тем, что они либо сразу элиминируются, либо метаболизируются, после чего выводятся из организма, а эстеразы, гидролизующие пиретроиды, в печени теплокровных гораздо более активны, чем у насекомых. Так, токсичность пиретроидов для животных и человека примерно в 100–1000 раз ниже, чем для насекомых. При этом коэффициент селективности (ЛД50 теплокровных / ЛД50 насекомых) у них в 10–200 раз выше, чем у фосфорорганических соединений. Пиретроиды аллетрин и неопинамин в концентрациях, в 50–70 раз превышающих те, что применяются для борьбы с насекомыми, не вызывают никаких значимых изменений функциональных, биохимических и морфологических показателей у мелких лабораторных животных. Допустимая суточная доза поступления синтетических пиретроидов в организм человека составляет 0,002–0,035 мг/кг.
При введении в желудок пиретроиды могут быть высоко-, средне- и малотоксичными для теплокровных животных. В картине интоксикации преобладают симптомы нарушений со стороны нервной системы, печени, отмечено влияние на оксигеназную систему. Пиретроиды способны индуцировать гибель тимоцитов, что ведет к снижению массы тимуса на 22–41 % и оказывает иммуносупрессивное действие.
Некоторые пиретроидные соединения (дельтаметрин) обладают кожной резорбцией и аллергенным потенциалом, а некоторые имеют слабое канцерогенное, тератогенное и эмбриотоксическое действие (Сумицидин, к. э.). Почти все исследованные пиретроиды не проявляют кумулятивности (Ккум > 5). Исключение составляют Сумицидин, к. э., Децис, к. э. (Ккум соответственно 2,5 и более 3). Установлено слабое мутагенное действие неопинамина, дельтаметрина и фенвалерата на клетки костного мозга мышей при введении веществ внутрижелудочно в достаточно высоких дозах: 1/5 и 1/50 ЛД50.
При этом литературные данные о возможности отдаленных эффектов, индуцируемых пиретроидами, немногочисленны и получены, как правило, при внутрижелудочном, а не ингаляционном введении пестицидов в организм животных.
Синтетические пиретроиды отличаются невысокой стоимостью, сравнительно низкими нормами расхода, малой токсичностью в отношении микроорганизмов. Однако при нерациональном применении у многих вредителей вырабатывается резистентность (групповая и перекрестная) к ним, что приводит к увеличению кратности обработок и загрязнению окружающей среды.
Инсектицидная активность пиретроидов усиливается при низкой температуре среды (отрицательный температурный коэффициент). Повышение температуры способствует их быстрому распаду, возможно, этим тоже объясняется относительно низкая токсичность пиретроидов для теплокровных животных.
Однако, несмотря на все преимущества синтетических пиретроидов, сегодня уже существует проблема их остатков в почве, воде и продуктах питания, а также их влияния на обитателей водоемов, животных и человека. По данным Национального исследовательского центра в Каире, пиретроиды (перметрин, циперметрин и др.) обнаруживаются в экстрактах пылевидных частиц воздуха в концентрациях 0,60–15,67 мкг/м3. В реках и озерах Греции, используемых для водоснабжения, содержание прометрина достигает 0,8 мкг/л.
Долгое время изобретение пиретроидов оставалось революционным событием в сфере защиты растений. Наиболее очевидным изменением стало резкое (более чем в 100 раз) сокращение нормы расхода препаратов на основе пиретроидов по сравнению с существовавшими в то время инсектицидами (при сохранении того же уровня эффективности). В 80-х гг. применение пиретроидов росло быстрыми темпами и к 1986 г. препараты данного класса занимали уже 20 % рынка инсектицидов. В стоимостном выражении продажи пиретроидов достигли 17 % от объема рынка. Этот уровень продаж сохранился до настоящего времени, несмотря на появление новых классов инсектицидов и распространение устойчивых к вредителям генномодифицированных сортов. С 2002 г., когда потребители стали предъявлять более высокие требования к качеству продуктов питания, объемы продаж многих устаревших групп пестицидов резко снизились, а пиретроидов – снова выросли и достигли 1,4 млрд. долларов. Площадь земель, обрабатываемых пиретроидами в период с 1996 по 2006 г., варьировалась от 175 до 245 млн. гектаров. В настоящее время продажи пестицидов на основе пиретроидов достигли наиболее высоких значений за всю историю.
В Беларуси разрешены к применению 28 препаратов из группы синтетических пиретроидов, основу которых составляют 12 дейст-вующих веществ: альфа-, бета-, зета-циперметрин, циперметрин, перметрин, дельтаметрин, бифентрин, лямбда-, гамма-цигалотрин, эсфенвалерат, тау-флювалинат и тефлутрин. Синтетические пиретроиды входят также в состав 13 препаратов, изготовляемых на основе двух действующих веществ (Сиванто Энерджи, КЭ, Амплиго, МКС; Борей, СК; Велес, КС; Декстер, КС; Кинфос, КЭ; Линкер, КЭ; Норил, КЭ; Нурелл Д, КЭ; Пиринекс Супер, КЭ; Простор, КЭ; Протеус, МД и Эфория, КС), и в состав комбинированных инсектицидных протравителей (Имидалит, ТПС и Форс Zea, КС).
2. Фосфорорганические инсектициды
История обнаружения токсических свойств фосфорорганических соединений (ФОСов) восходит к началу ХХ в. Широкое исследование этих веществ началось в 1930-х гг. в лаборатории Герхарда Шрадера в Германии. Вначале они обратили на себя внимание как боевые отравляющие вещества (в 1938 г. в Германии был синтезирован газ зарин). В конце Второй мировой войны были сделаны промышленные установки по синтезу первых пестицидов.
До появления синтетических пиретроидов фосфорорганические соединения были наиболее широко применяемыми и разнообразными по ассортименту пестицидами. В сельскохозяйственное производство они были введены с 1965 г. взамен персистентных и низкоэкологичных ДДТ, гексахлорана и других хлорорганических соединений (ХОСов). ФОСы оказались просты в синтезе и высокоэффективны против насекомых. В 1970-е гг. половина из 20 наиболее распространенных в мире инсектицидов принадлежала фосфорорганическим соединениям.
Фосфорорганические соединения – инсектициды производные пятивалентного фосфора, имеющие сходные механизмы действия на насекомых.
В настоящее время ассортимент препаратов из группы ФОСов, разрешенных к применению в Беларуси, выпускается на основе действующих веществ, среди которых преобладают производные тио- и дитиофосфорных кислот, общие формулы которых приведены ниже.
![]()
Радикалы R1 и R2 у большинства веществ представлены метильной группой (СН3) и только у диазинона, хлорпирифоса – этильной (С2Н5). Радикал R3 у всех соединений разный (алкильный, циклический, гетероциклический), что во многом и определяет специфику биологической активности, избирательности действия и поведения ФОСов в разных организмах и окружающей среде.
К производным тиофосфорной кислоты относятся действующие вещества: пиримифос-метил, диазинон, хлорпирифос, а к производным дитиофосфорной кислоты – малатион, фозалон, диметоат.
Из производных тиофосфорной кислоты более широко применяются препараты с пиримифос-метилом (Актеллик, КЭ), а у дитиофосфорной кислоты – на основе малатиона (Фуфанон, КЭ; Новактион, ВЭ) и диметоата (Би-58 Новый, КЭ).
В настоящее время по масштабам производства и числу выпускаемых препаратов для борьбы с вредителями второе место после синтетических пиретроидов занимают фосфорорганические соединения.
Фосфорорганические инсектициды действуют на нервную систему животных, в частности насекомых, клещей. Они ингибируют активность фермента ацетилхолинэстеразы, взаимодействуя с эстеразным центром фермента (путем фосфорилирования), гидролизующего один из основных медиаторов нервных импульсов – ацетилхолин. Фосфорилированная таким образом холинэстераза – достаточно устойчивое соединение, поэтому фермент не может осуществлять свою обычную функцию – гидролиз ацетилхолина. Таким образом, он после взаимодействия с холинорецепторами не разрушается, как обычно, а продолжает оказывать на них непрерывное воздействие. Накопление ацетилхолина в синаптической щели приводит к гипертрофированной возбудимости, нарушению функций различных органов и в конечном счете к отравлению организма. Отравление ФОСами способствует перевозбуждению холинорецепторов, что вызывает судорожную активность мышц, переходящую в паралич, и другие признаки самоотравления организма избыточным количеством ацетилхолина.
Для высокотоксичных фосфорорганических инсектицидов характерны узость зоны токсического действия (т. е. близость доз смертельных и пороговых), быстрота нарастания симптомов интоксикации. Отсутствие местнораздражающих свойств определяет коварность этих веществ, так как попадание их на кожу может остаться незамеченным. При длительном влиянии на организм в малых концентрациях и дозах ФОСы способны оказывать хроническое действие. Фосфорорганические инсектициды могут поступать в организм через неповрежденные кожные покровы, органы дыхания и желудочно-кишечный тракт, поэтому клиническая картина интоксикации имеет свои особенности в зависимости от пути поступления яда. Вследствие блокирующего действия всех ФОСов на фермент холинэстеразу в крови накапливается избыточное количество ацетилхолина, возбуждающего холинореактивные системы, что нарушает нормальную функцию центральной и периферической нервной системы. Патологические симптомы, развивающиеся при интоксикации ФОСами, можно разделить на три группы: мускарино-, никотиноподобное и центральное действие.
К группе симптомов мускариноподобного действия относят сужение зрачков, одышку, бронхоспазм, повышение бронхиальной секреции, потливость, слюнотечение, снижение и потерю аппетита, тошноту, рвоту, замедление сокращений сердца. К группе симптомов никотиноподобного действия относят подергивание век, языка, мышц лица. К симптомам центрального действия относят головные боли, нарушение сна, судороги, кому. Клиническая картина интоксикации, вызванной различными ФОСами, во многом сходна. Различие проявляется в основном в быстроте проявления тех или иных симптомов отравления и тяжести их течения.
Диагностика отравлений ФОСами основывается на анамнестических данных и на характерных симптомах отравления. Для распознавания отравлений важное значение имеет определение активности холинэстеразы. Принято считать, что при легком отравлении активность этого фермента может быть снижена до 50 %, при среднем – до 70 %, а при тяжелом – до 90 %. Однако строгого параллелизма между степенью отравления и степенью угнетения холинэстеразы не наблюдается.
Высокий коэффициент распределения большинства ФОСов между маслом и водой обеспечивает их проникновение через различные биологические мембраны, хорошую резорбцию через неповрежденную кожу, проникновение в мозг через гематоэнцефалический барьер, способность подавлять активность не только внеклеточной, но и внутриклеточной ацетилхолинэстеразы.
Как и в случае с любым другим ядовитым веществом, отравление ФОСами может быть вызвано не всегда. Существует ряд факторов, способствующих отравлению ФОСами: возраст животного (молодняк и старые животные более чувствительны к ФОСам); функции органов (при хронической почечно-печеночной недостаточности действие ФОСов будет усиливаться); вид животного (кошки более чувствительны к ФОСам, чем собаки); индивидуальные особенности организма (сюда следует отнести не только физиологические параметры, но и приобретенные особенности: например, кастрированные бычки менее чувствительны к хлорпирифосу (Пиринекс, КЭ), чем быки-производители).
После разрушения до нетоксичных водорастворимых веществ в организме теплокровных ФОСы быстро выводятся из организма с мочой. Для самого стойкого вещества из производных ФОСов – хлорпирифоса – характерна опасность накопления в организме и выделения с грудным молоком.
Большинство ФОСов плохо растворимы в воде. Хорошо растворяется в воде лишь диметоат.
Многие из ФОСов значительно менее устойчивы во внешней среде и быстро разрушаются в почве, водоемах и пищевых продуктах, что обусловлено способностью гидролизоваться под влиянием различных факторов среды (щелочная среда, воздействие высокой температуры и т. д.). Разложение ФОСов протекает в течение нескольких суток при 25–35 °С и нескольких часов при 60–70 °С с образованием таких простейших продуктов распада, как фосфорная кислота, сера и др. Однако в кислых почвах и при наличии слабокислой среды в растениях и животных тканях некоторые ФОСы могут сохраняться длительное время.
Мнение, что фосфорорганические инсектициды быстро разрушаются, позволило допустить в свое время наличие во всех пищевых продуктах остаточных количеств продуктов разложения таких высокотоксичных фосфорорганических препаратов, как Тиофос и Метафос.
В связи с этим ряд ученых выдвигали гипотезу, что посредством фосфорорганических препаратов появится возможность решить проблему «идеального пестицида», т. е. такого пестицида, который, оказав негативное действие на истребляемый объект, не задержится на обработанных растительных объектах и в короткие сроки инактивируется. При этом полностью исключались бы остаточные количества пестицидов в продуктах питания и можно было бы осуществить основное гигиеническое требование – чтобы продукты питания человека полностью были свободны от химических включений, в том числе и от остаточных количеств пестицидов, даже самых незначительных. Такой подход к оценке пестицидов привел к широкому допуску высоко-
токсичных пестицидов для использования в сельском хозяйстве.
Но дальнейшее изучение ФОСов показало, что свойствами малой устойчивости во внешней среде и быстрым распадом на обрабатываемых объектах обладали контактные фосфорорганические препараты, которые не проникают внутрь растительных объектов (Тиофос, Карбофос, Метафос). Другие фосфорорганические соединения, относимые к группе системных, или внутрирастительных, пестицидов, характеризуются выраженной способностью проникать внутрь растений и распространяться во все их части, в том числе и в съедобную часть. Системные препараты, как правило, отличаются значительно большей устойчивостью во внешней среде, по некоторым данным, – до двух лет.
Летучесть ФОСов сравнительно невелика, однако некоторые из них могут создавать в воздухе токсические концентрации паров при температуре 20–40 °С.
При систематическом применении препаратов на основе фосфор-
органических соединений для защиты от клещей и насекомых, дающих много поколений за сезон, вредители быстро приобретают групповую устойчивость.
В свободном состоянии в крови и тканях ФОСы задерживаются на очень короткое время и обычно, при поступлении в организм в небольших количествах, в крови не определяются. Даже в токсических дозах их можно выявить в крови в сравнительно короткие промежутки времени. Так, через несколько часов даже при внутримышечном введении белым крысам хлорофоса в дозе 200 мг/кг, составляющей около половины смертельной, в крови были обнаружены только следы вещества. Та же закономерность характерна для большинства ФОСов. Это значит, что они не обладают способностью к материальной кумуляции, исключение составляет малатион (Новактион, ВЭ; Фуфанон, КЭ).
При этом некоторые разрешенные в настоящее время препараты (Би-58 Новый, КЭ; Данадим Эксперт, КЭ и др.) обладают слабо выраженной функциональной кумуляцией. Однако то, что ФОСы в большинстве своем являются веществами со слабой кумуляцией, еще не исключает возможности хронической интоксикации ими.
Если в продуктах питания есть остаточные количества ФОСов, то все продукты должны быть хорошо промыты в проточной воде, по возможности подвергнуты действию высокой температуры. Фрукты и ягоды, после предварительного мытья, надо пускать в переработку на джем, повидло, варенье, сухофрукты. Фрукты, содержащие ФОСы в значительно превышающих разрешенные концентрациях, необходимо первоначально освобождать от кожуры.
Овощи могут быть переработаны на консервы. Поскольку многие ФОСы могут длительно сохраняться в кислой среде, то овощи, содержащие их, не рекомендуется использовать для квашения и маринования. Кожуру цитрусовых с остатками ФОСов запрещается использовать в кондитерском производстве. Зерно нужно подвергать тщательному проветриванию и термической обработке. Из мяса делают вареные колбасы, технология приготовления которых требует применения высоких температур. Молоко подвергают кипячению.
Фосфорорганические инсектициды могут оказывать непродолжительное воздействие на почвенную фауну. Так, в исследованиях российских ученых в лабораторных условиях диметоат в рекомендуемых нормах расхода вызывал сильное угнетение почвенных микроорганизмов и приводил к гибели всех опытных простейших.
Фосфорорганические инсектициды, как правило, применяются в виде эмульсий, так как большинство из них в воде нерастворимы. Для превращения в эмульсии к ним добавляют подходящие растворители и эмульгаторы. В Беларуси разрешены для применения фосфор-органические инсектициды в виде концентратов эмульсий, водных эмульсий и гранул, которые вносятся в почву против почвообитающих вредителей, в частности медведки обыкновенной.
Фитотоксичность препаратов, применяемых в форме концентратов эмульсий, может проявляться в повреждении (ожогах) листьев и особенно цветков и бутонов.
ФОСы представляют собой либо твердые кристаллические вещества, либо прозрачные или желтовато-коричневые, часто маслянистые, жидкости. Многие из них имеют специфический неприятный запах. Большинство ФОСов тяжелее воды, их плотность находится в пределах от 1,1 до 1,7.
Действие их не зависит от температурного режима, что повышает их надежность. Хорошо комбинируются с другими препаратами. Многие ФОСы хорошо растворимы в органических растворителях – ксилоле, толуоле, ацетоне, хлороформе и др.
ФОСы – это инсектициды контактного, кишечного и фумигантного действия. Фосфорорганические препараты сильнее действуют на постэмбриональные стадии развития насекомых и клещей (личинки, нимфы, взрослые особи) и слабее – на яйца. Все ФОСы, за исключением диазинона, обладают не только инсектицидным, но и акарицидным действием.
По способу проникновения в организм малостойкие фосфорорганические пестициды на основе пиримифос-метила, малатиона относятся к контактным с глубинным эффектом, способны проникать внутрь ткани листа и вызывать гибель минирующих вредителей. Кроме того, эти вещества обладают фумигационным действием. Продолжительность защитного действия 2–6 дней. Наиболее быстродействующее и малостойкое из них – пиримифос-метил (Актеллик, КЭ). Кишечное действие его выражено слабо, поэтому он эффективен только против гусениц младших возрастов. Более стойкие в окружающей среде ФОСы проявляют более длительное кишечное действие, и чем дольше они сохраняют свою активность, тем эффективнее против грызущих насекомых. Продолжительность их защитного действия нарастает в ряду веществ от 10–14 дней у диазинона до 40–70 дней у хлорпирифоса: диазинон → диметоат → фозалон → хлорпирифос.
Кроме того, среди ФОСов имеются вещества системного действия, (диазинон и диметоат). Препараты на основе диметоата применяют для опрыскивания растений. Они распространяются по сосудистой системе растений и оказывают на определенное время токсическое действие на вредителей сельскохозяйственных культур.
Препараты на основе диазинона применяют для внесения в почву с целью защиты растений от почвообитающих вредителей. Внесенный в почву диазинон хорошо поглощается корневой системой сельскохозяйственных культур и поступает во всходы растений, защищая их от вредителей в первые две-три недели. Эти свойства веществ являются очень важными, так как в современном ассортименте пестицидов отсутствуют другие инсектициды, обладающие таким действием.
В Беларуси разрешены к применению 14 препаратов из группы ФОСов, основу которых составляют 6 действующих веществ: пиримифос-метил, диазинон, фозалон, диметоат, малатион, хлорпирифос. Фосфорорганические инсектициды входят также в состав шести препаратов, изготовляемых на основе двух действующих веществ (Кинфос, КЭ; Линкер Д, КЭ; Норил, КЭ; Нурелл Д, КЭ; Пиринекс Супер, КЭ; Простор, КЭ).
3. Карбаматы
Карбаматы – производные эфиров, стойкие соединения с низким давлением пара и слаборастворимые в воде. В свободном состоянии карбаминовая кислота не существует – это амид угольной кислоты.
Биологическая активность карбаматов была обнаружена в 1923 г. Тогда впервые была описана структура физостигмина (physostigmine), или алкалоида эзерина (alkaloid eserine), который содержится в зернах калабарских бобов. Аналоги физостигмина были синтезированы в 1929 г. и сегодня известно более тысячи производных карбаминовой кислоты. Около 50 из них широко используются как инсектициды, фунгициды, гербициды и нематициды.
Первые производные карбаминовой кислоты, которые имеют свойства инсектицида, были синтезированы в 1947 г. До начала 80-х гг. производство карбаматных инсектицидов постоянно увеличивалось. Некоторые тиокарбаматы доказали свою эффективность в качестве ускорителей вулканизации, а производные дитиокарбаминовой кислоты были применены для лечения злокачественных опухолей, гипоксии, нейропатии, радиационных поражений и других заболеваний.
Первым инсектицидом класса карбаматов, получившим применение в сельском хозяйстве и ветеринарии, был Карбарил (М-метил-М-(нафт-1-ил)карбамат). Но уже через 15–20 лет их популярность пошла на убыль. Кроме того, в результате катастрофы в г. Бхопал (Индия), приведшей к большим человеческим жертвам, на многих заводах мира было приостановлено производство карбаматов, промежуточным продуктом получения которых является взрывоопасное соединение метилизоцианат.
Из-за высокой токсичности веществ, связанной с инсектицидной активностью, многие карбаматы сегодня запрещены к применению. Одним из возможных выходов из этого положения является разработка так называемых пропестицидов, которые при попадании в биологический объект образуют метаболиты с более высокой, чем исходное соединение, физиологической активностью. Пропестициды – вещества со сравнительно низкой активностью, иногда порядка на два меньше, чем конечный карбамат, и это в какой-то степени решает проблему их применения.
Первым из продуктов данного типа был разработанный фирмой ФМС (США) карбосульфан (Эдвентидж, Маршал). Он разлагается в почве с образованием карбофурана и, по всей вероятности, именно карбофуран в конечном итоге воздействует на насекомых, тем более что спектр инсектицидной активности у обоих продуктов приблизительно одинаков. Сам же карбосульфан в 10 раз менее токсичен, чем карбофуран. Положительным его свойством было то, что он способен поступать в растения из почвы и обработанных семян, хорошо передвигаться в надземные органы и длительно (6–10 недель) защищать всходы, пока растения не окрепнут и повреждения их насекомыми будут не столь губительны (системное свойство). Карбофураном обрабатывали семена на специальных промышленных установках. До недавнего времени в Беларуси использовались протравители на основе карбофурана для обработки семян сахарной свеклы, столовой свеклы, рапса, капусты и горчицы. Также препараты на основе карбаматов обладают контактным и фумигационным действием.
Механизм действия карбаматных инсектицидов на членистоногих заключается в блокирующем действии на функции нервно-мышечной системы (они угнетают ацетилхолинэстеразу нервной системы путем карбомоилирования). Ацетилхолинэстераза способствует гидролизу ацетилхолина в холин и уксусную кислоту. При ингибировании АХЭ эфиром карбамата гидролиза АХ не происходит. Таким образом, концентрация АХ остается высокой в связках, вызывая непрекращающуюся стимуляцию мышц, приводящую к крайнему истощению и тетании. По биологической активности карбаматы близки к фосфорорганическим инсектицидам.
В практике медицинской дезинсекции зарегистрированные препараты на основе пропоксура и бендиокарба применяются в борьбе с синантропными насекомыми.
Инсектициды – производные карбаминовой кислоты, хотя и характеризуются широким спектром инсектицидной активности и длительным защитным действием, имеют ограниченное применение в связи с высокой токсичностью для теплокровных животных и человека.
Для этой группы препаратов характерным является поражение нервной, кроветворной и эндокринной систем млекопитающих. Большинство инсектицидов обладает эмбриотоксическим, бластомогенным и мутагенным действием, а также аллергенными свойствами.
Механизм токсического воздействия на организмы теплокровных животных до конца не выяснен. Определяющую роль в токсикодинамике играют нарушение функции нервной системы, обмена нуклеиновых кислот, угнетение окислительных процессов, поражение желез внутренней секреции, печени и других паренхиматозных органов.
Отравление карбаматами проявляется в виде интоксикации с характерными холинергическими симптомами, вызванными угнетением ферментной активности ацетилхолинэстеразы. Симптомы отравления могут быть диагностированы через несколько минут после воздействия и продолжаться в течение нескольких часов. После этого начинается выздоровление, и симптомы через несколько часов исчезают, активность ХЭ в эритроцитах и плазме крови возвращается к норме. Это связано с довольно быстрым метаболизмом карбаматов и выведением их метаболитов из организма.
При работе с препаратами на основе карбаматов следует исключить возможность их контакта со слизистыми глаз, открытыми участками кожи и возможность их попадания в дыхательные пути и в пищевые продукты.
Клиническая картина интоксикации карбаматами определяется аккумуляцией АХЭ в нервных окончаниях. Симптомы интоксикации можно классифицировать по следующим трем группам: мускарино-
подобные проявления (повышение бронхиальной секреции, обильное пото- и слюноотделение, слезотечение, сужение зрачков, бронхоспазм, рвота и диарея, брадикардия); никотиноподобные проявления (фасцикулярные подергивания мелких мышц (в тяжелых случаях также дыхательных и диафрагмальных мышц), тахикардия); симптомы и признаки поражения центральной нервной системы (головная боль, головокружение, беспокойство, потеря памяти, тонические или тонико-клонические судороги, нарушение движений, кома, угнетение деятельности дыхательного центра, одышка).
Все перечисленные симптомы проявляются в различных сочетаниях и могут варьироваться в проявлении и последовательности в зависимости от вещества, дозы и пути воздействия.
На сегодняшний день из большого разнообразия веществ, применявшихся в ХХ в., разрешены для использования в сельском хозяйстве два препарата на основе двух действующих веществ – Ланнат 20 Л, КЭ (метомил) и Пиримикс Р. С. (пиримикарб).
4. Неоникотиноиды
Неоникотиноиды (Neonicotinoide или Neonikotinoide) по химическому строению принадлежат к классу нитрометилен-гетероцикли-ческих соединений. Это относительно новый класс инсектицидов, которые за два десятилетия получили широкое распространение в ветеринарии, быту и в сельском хозяйстве для внесения в период вегетации и обработки посевного и посадочного материала.
История современных неоникотиноидов уходит в давние времена. Так, препараты на основе никотина, получаемые путем настоев из махорки и табака, использовали достаточно давно. Первые химические никотины (анабазин и никотин) применяли в борьбе с насекомыми-вредителями до Второй мировой войны. Они имели большую токсичность для насекомых и в определенных условиях могли вызывать шок и у человека. Например, в некоторых литературных источниках начала XX в. приводится рецепт приготовления табачного настоя для борьбы с вредителями запасов. Таким образом, неоникотиноиды представляют собой такой же пример синтеза и использования новых никотинов, как пиретроиды – новых пиретринов. В настоящее время на основе никотина выпускается четыре инсектицида, разрешенных для применения в личном подсобном хозяйстве.
До 2000 г. в структуре мирового производства инсектицидов 80 % занимали фосфорорганические соединения, пиретроиды и карбаматы. Необходимость преодоления резистентности, экономические и экологические причины привели к тому, что в конце 80-х гг. ХХ столетия начали широко изучать в качестве инсектицидов производные пиридина – нитроимидазолидины. В Японии, в университете г. Гифа, в ре-зультате синтеза и испытания более двух тысяч веществ была обнаружена высокая инсектицидная активность соединений, содержащих
6-хлорникотиниловую группу. Эти соединения получили название неоникотиноиды. Нитиазин был первым инсектицидом из этой группы и не имел коммерческого значения.
Введение фрагмента молекулы алкалоида эпибатидина, выделенного у лягушки-древолаза (Epipedobates tricolor), значительно повысило инсектицидную активность соединений и привело к созданию имидаклоприда и тиаклоприда. Вскоре были синтезированы соединения, содержащие открытое пирролидиновое кольцо (нитенпирам, ацетамиприд, клотианидин). В ходе экспериментов было показано, что оксидиазины, содержащие кислород, более ста-бильны в окружающей среде, чем амины. В результате чего был синтезирован тиаметоксам. Широкое распространение неоникотиноиды получили с начала 90-х гг. Они уже зарегистрированы почти в 100 странах мира и разрешены для защиты более 60 видов полезных культур.
В мировой ветеринарной практике применяют препараты на основе двух действующих веществ неоникотиноидов – нитенпирама (таблетки Capstar®, фирма «Новартис», Швейцария) и имидаклоприда. Для ветеринарного применения имеются следующие препараты, содержащие имидаклоприд: Адвантейдж, Адвантикс, Моксидектин и др., рекомендуемые для уничтожения блох, вшей, власоедов, паразитирующих на кошках и собаках.
Главным в химической структуре имидаклоприда, ацетамиприда и тиаклоприда является наличие пиридинового кольца с одним атомом хлора в 6-м положении. Кольцо благодаря метиленовому мостику связано с терминальной (электронодонорной этеновой или иминовой) группой, что, собственно, и обусловливает биологические особенности действия представителей данной группы инсектицидов.
На белорусском рынке пестицидов неоникотиноиды представлены пятью действующими веществами: имидаклопридом, ацетамипридом, тиаметоксамом, тиаклопридом и клотианидином. По химической структуре их делят на две группы: нитрозосодержащие соединения (имидаклоприд, тиаметоксам, клотианидин) и цианосодержащие (ацетамиприд, тиаклоприд).
Неоникотиноиды по сравнению с инсектицидами других классов химических соединений обладают принципиально иным механизмом воздействия на организм членистоногих, ингибируя никотин-ацетилхолиновые рецепторы постсинаптической мембраны, пролонгируя открытие натриевых каналов. В результате у насекомых происходит чрезмерное возбуждение нервных клеток, таким образом нарушается проводимость нервного импульса через синапс, и они погибают от нервного перевозбуждения.
При этом никотин, имидаклоприд и тиаклоприд лишь частично ингибируют никотин-ацетилхолиновые рецепторы. Возбуждение рецепторов от их воздействия составляет около 20–25 % в сравнении с возбуждением, вызываемым ацетилхолином. В то же время ацетамиприд и клотианидин относятся к группе более полных агонистов никотин-ацетилхолиновых рецепторов и эффективность их воздействия на специфические рецепторы от 60 до 100 %. Особенности взаимодействия неоникотиноидов с рецепторами определяют развитие клинической картины отравления насекомых. Так, при воздействии на насекомых пестицидами с низкой эффективностью связывания с никотин-ацетилхолиновыми рецепторами преобладают эффекты возбуждения, а воздействие высокоэффективных агонистов этих рецепторов приводит к угнетению и параличу насекомых.
Установлено, что тиаметоксам не является конкурентным агонистом или антагонистом никотин-ацетилхолиновых рецепторов. На основании экспериментальных данных о биотрансформации в организме насекомых и растений тиаметоксама в клотианидин высказывают предположение о том, что инсектицид является проинсектицидом.
Благодаря необычному механизму воздействия неоникотиноиды являются очень эффективными против резистентных (выработавших устойчивость) популяций вредоносных видов членистоногих к иным классам пестицидов. Поэтому они не имеют выраженной перекрестной резистентности с карбаматами, пиретроидами и фосфорорганическими инсектицидами. Таким образом, на современном этапе развития защиты растений от вредителей неоникотиноиды являются очень актуальной группой, по праву заслуживающей занять свое почетное место в интегрированных системах защиты.
Особенности химической структуры молекул неоникотиноидов и различная чувствительность у насекомых и млекопитающих к ним (терминальная электронодонорная группа хорошо аккумулируется рецепторами, имеющимися у насекомых, и плохо – рецепторами, име-ющимися у человека и других млекопитающих) обусловливают выборочное действие. Вследствие этого неоникотиноидные инсектициды являются очень токсичными для вредителей и умеренно или малотоксичными для млекопитающих. Коэффициент их избирательного действия составляет более 2000.
Кроме этого неоникотиноиды очень плохо проникают через плацентарный и гематоэнцефалический барьер млекопитающих. Действующие вещества препаратов очень быстро метаболизируются в организме посредством окисления монооксигеназами (происходит индукция ферментов монооксигеназной системы). Главными метаболитами являются гидрокси- и олифенпроизводные, 6-хлорникотиновая и гиппуровая кислоты, конъюгат 6-хлорникотиновой кислоты с глюкозой.
В организм животных неоникотиноиды могут попадать с кормами, водой и при нанесении их на кожу. Острое отравление никотиноидами у животных характеризуется нарушением ритма дыхания, координации движения, тремором, диареей, судорогами, саливацией, что свидетельствует об их общетоксическом действии на организм. Имидаклоприд и тиаклоприд быстро всасываются из желудка и кишечника и, распространяясь по организму с кровью и лимфой, накапливаются в кератиновых образованиях кожи, внутренних органах, мышцах, лимфатических узлах и головном мозгу.
В высоких дозах для тиаклоприда и имидаклоприда характерно нарушение работы щитовидной железы. Тиаклоприд и ацетамиприд имеют гормональный механизм возникновения опухолей у крыс.
Экспериментально зафиксировано, что имидаклоприд не обладает аллергизирующим и раздражающим действием на дыхательные пути, а также мутагенной, тератогенной и канцерогенной активностью. Он у кроликов не вызывает раздражения кожи и слизистой оболочки глаз. Эмбриотоксический эффект наблюдают только при введении токсических доз препарата. Выведение имидаклоприда происходит преимущественно в течение 3 суток, в крови и печени его остаточные количества регистрируют через 30 суток. Тиаклоприд выводится в те-чение 7 суток.
Влияние никотиноидов на различные органы и системы зависит как от периферического, так и от центрального действия. Возбуждение центра блуждающего нерва и интрамуральных парасимпатических ганглиев приводит сначала к снижению частоты сердечных сокращений, а затем к увеличению за счет стимулирующего действия никотиноидов на симпатические ганглии и выделения из мозгового слоя надпочечников адреналина. В низких дозах никотиноиды повышают артериальное давление, что обусловлено возбуждением симпатических ганглиев и сосудодвигательного центра, повышением выделения адреналина и прямым сосудосуживающим миотропным влиянием вещества, а также повышают моторику кишечника, вызывают рвоту Высокие дозы неоникотиноидов снижают тонус кишечника. Секреторная функция слюнных и бронхиальных желез сначала повышается, затем угнетается.
Неоникотиноиды – это контактно-кишечные инсектициды, обладающие системным и трансламинарным действием. Наличие системных свойств предоставляет возможность их использования не только посредством опрыскивания, но и предпосевной обработки посевного и посадочного материала (для борьбы с почвообитающими вредителями и вредителями всходов), что, в свою очередь, позволяет уменьшить гектарную норму внесения препарата, сократить расходы на применение, снизить гибель полезных насекомых.
Изучение динамики остаточных количеств неоникотиноидов в растениях показало, что они проникают по сосудистой системе преимущественно в листья, но практически не поступают в плоды. Этот факт свидетельствует о гигиенической безопасности использования неоникотиноидов при капельном поливе овощных культур в закрытом грунте. Еще одной положительной особенностью внесения неоникотиноидов в теплицах через систему капельного полива растений является возможность их сочетания с выпуском акарифага фитосейулюса, который используется для защиты от обыкновенного паутинного клеща.
Неоникотиноиды не ионизируются при обычных рН, а также устойчивы к гидролизу.
Неоникотиноиды относительно стабильны при высоких дневных температурах, имеют период защитного действия 14–21 день. В то же время ацетамиприд, обладая сильными системными свойствами (даже большими, чем у имидаклоприда), на поверхности растений малостоек и разрушается в течение 3–4 дней.
Они обладают высокой стойкостью в почве. Исчезновение их из почвы и водоемов происходит в основном из-за фотолиза. Скорость фотолиза возрастает при высокой влажности почвы и высокой инсоляции.
В рекомендованных нормах расхода неоникотиноиды не фитотоксичны.
Главным недостатком неоникотиноидов является их токсичность для пчел и многих других полезных насекомых. Остатки действующих веществ после обработки ими сельскохозяйственных растений накапливаются в нектаре и пыльце растений, попадая затем в организм пчел, вызывают у них расстройство кишечника и впоследствии их гибель, так называемый химический токсикоз.
Воздействие неоникотиноидов может помешать воспроизводству медоносных пчел и их способности ориентироваться и летать. В исследованиях по определению токсичности неоникотиноидов для пчел установлено, что гибель пчел-сборщиц отмечалась при контакте насекомых с растениями, обработанными тиаметоксамом или имидаклопридом в рекомендованных нормах расхода, в день применения препаратов. По данным зарубежных исследователей, наиболее опасными для пчел являются нитрозамещенные соединения – клотианидин, динотефуран, имидаклоприд и его метаболиты, тиаметоксам, нитенпирам.
Во Франции с 1999 г. запрещены все неоникотиноиды всего лишь после года их применения. Клотианидин, имидаклоприд и тиаметоксам были запрещены Европейской комиссией в мае 2013 г. для применения на территории ЕС. Однако до сих пор ведутся дискуссии между пчеловодами и представителями сельского хозяйства, касающиеся этого запрета. Последние считают запрет неоправданным, так как он влияет на урожайность: обработка растений ведется в более поздние сроки, по завершении цветения, когда насекомые уже успевают нанести вред.
Вообще отравление неоникотиноидами трудно доказать. Смертельная доза имидаклоприда и клотианидина для медоносной пчелы составляет от 4 до 5 нанограмм на особь (в 10 000 меньше, чем у пестицида ДДТ). Проблема заключается в том, что отравление из-за очень малых количеств активного ингредиента в степени 1 нанограмм на 100 г массы тела (около 1000 пчел) очень трудно обнаружить.
Крупнейший на сегодняшний день несчастный случай с неоникотиноидами произошел весной 2008 г. в Германии. По данным опросов, в Баден-Вюртемберге пострадало около 11 500 роев. В качестве причины этого отравления были определены обработанные неоникотиноидами семена кукурузы, что было подтверждено с помощью химических анализов пчел и образцов растений. Доказано, что активное вещество (клотианидин) происходило из обработанных зерен кукурузы, где активный ингредиент недостаточно закрепился на зернах, что в итоге привело к сильному осыпанию и накоплению в виде пыли в некоторых партиях семян. В Верхнем Рейне также использовались пневматические сеялки с распылительно-всасывающей системой, которые из-за своей специальной конструкции распыляли содержащую клотианидин пыль через воздухоотвод непосредственно в воздух и на цветущие растения, находившиеся в зоне распределения пылевого облака. Этот материал настолько концентрирован, что даже маленькие его объемы, попадающие на цветущие растения, могут убить пчелу-сборщицу или переместиться в улей в загрязненном нектаре.
Также имеются данные, что неоникотиноиды – одна из возможных причин синдрома разрушения колоний. Немецкие ученые обнаружили, что воздействие неоникотиноидов в низких концентрациях снижает содержание ацетилхолина в маточном молочке. Более же высокие дозы их нарушают работу микротрубочек железы, вырабатывающей маточное молочко, в которых и производится ацетилхолин.
Подозревается, что неоникотиноиды могут причинить вред даже птицам. Как сообщается на сайте Pflanzenforschung.de, исследователи в Нидерландах заметили косвенную связь между концентрацией в окружающей среде часто используемых имидаклопридных пестицидов и снижением численности птиц.
В Беларуси разрешен к применению 21 инсектицид из группы неоникотиноидов, основу которых составляют четыре действующих вещества: тиаметоксам, ацетамиприд, тиаклоприд, имидаклоприд. Они входят также в состав шести препаратов, изготовляемых на основе двух действующих веществ (Борей, СК; Велес, КС; Декстер, КС; Мовенто Энерджи, КС; Протеус, МД; Эфория, КС).
К тому же на основе вышепредставленных действующих веществ, а также на основе клотианидина на сегодняшний день имеется 24 протравителя инсектицидного и инсектно-фунгицидного действия. При этом преобладают препараты, действующим веществом которых является имидаклоприд, – 15 протравителей.
5. Фенилпиразолы
Данная группа веществ была разработана сравнительно недавно для борьбы с вредителями, устойчивыми к воздействию фосфорорганических, карбаматных соединений и пиретроидов.
В группу входят препараты контактно-кишечного действия на основе активного вещества фипронил (Регент, Регент 20Г, Адонис). Препараты хорошо себя зарекомендовали против почвенных вредителей, а также против представителей отрядов прямокрылых и жесткокрылых.
До недавнего времени (Государственный реестр средств защиты растений, 2014) в Беларуси были зарегистрированы два препарата на основе фипронила (Регент и Регент 20Г) для борьбы соответственно с картофельным колорадским жуком и почвообитающими вредителями. Но в последнем Государственном реестре средств защиты растений (2017) присутствует только гранулированная форма препарата Регент 20Г, а также протравитель Табу Супер, в который кроме фипронила входит и действующее вещество имидаклоприд.
Фенилпиразолы – это контактно-кишечные вещества, не имеющие системного действия. Они медленно разлагаются во внешней среде и за счет этого свойства остаются на растениях и в почве 3–4 недели, продолжая оказывать защитное действие.
Механизм действия фенилпиразолов заключается в блокировании гамма-аминомасляной кислоты, которая является важнейшим тормозным нейромедиатором центральной нервной системы. Она выполняет в организме функцию ингибирующего медиатора центральной нервной системы. При выбросе ГАМК в синаптическую щель происходит активация ионных каналов ГАМК-A и ГАМК-C рецепторов, приводящая к ингибированию нервного импульса. В результате насекомые перестают питаться, теряют подвижность (или слегка передвигаются несколько часов) и погибают.
Фенилпиразолы более избирательны по отношению к ГАМК-рецепторам насекомых, чем млекопитающих, что обеспечивает значительно больший запас надежности при использовании их в качестве противопаразитарного средства. Это дает возможность использовать фенилпиразолы в ветеринарии.
Канцерогенные и эмбриотические эффекты зафиксированы на крысах только в дозах, близких к летальным.
Репеллентными свойствами фипронил не обладает.
При длительном применении препаратов на основе фипронила могут появиться устойчивые популяции насекомых.
6. Оксадиазины
Оксадиазины – это относительно новый класс инсектицидов на мировом рынке. Первым продуктом из этого класса является Авант, КЭ (индоксакарб). Данный инсектицид разработан и выведен на рынок швейцарской компанией «Дюпон». Он же в настоящее время является единственным представителем оксадиазинов, зарегистрированным в Беларуси.
Индоксакарб – это контактно-кишечное вещество, не обладающее системными свойствами. Гибель насекомых происходит при контакте с обработанной листовой поверхностью и при попадании препарата в кишечник. Действие индоксакарба более выраженно при опрыскивании уже отложенных яиц (овицидное действие) и в период начала отрождения личинок (погибают при прогрызании оболочки яйца). Основным фактором для проявления овицидного эффекта является влага.
Имеются данные о частичном трансламинарном действии вещества, которое, проникая в мезофильные клетки листа, контролирует сосущих и минирующих вредителей.
Индоксакарб прекращает перенос ионов натрия в нервных клетках насекомых, в результате чего блокируются натриевые каналы. В результате насекомые-вредители прекращают питаться (0–4 часа), у них нарушается координация, затем наступает паралич и смерть в течение 4–60 часов.
Продолжительность защитного действия индоксакарба 10–15 дней.
Для данного инсектицида характерен эффект биоактивации, когда с появлением влаги (роса, дождь, туман) высохшее на поверхности плодов и листьев вещество возобновляет инсектицидную активность.
Эффективен как в прохладную, так и в жаркую погоду, но с повышением температуры активность индоксакарба возрастает (положительный температурный коэффициент).
Индоксакарб не фитотоксичен для обрабатываемых культур. У него очень низкая вероятность возникновения перекрестной резистентности.
7. Семикарбазоны
Семикарбазоны (от семикарбазид и гидразон) – соединения общей структуры R2C=N-NH-CO-NH2, формально являющиеся продуктами конденсации семикарбазидов с карбонильными соединениями – альдегидами и кетонами.
Семикарбазоны – твердые, хорошо кристаллизующиеся вещества, имеющие, как правило, четкие температуры плавления. Данные вещества практически нерастворимы в воде, растворимы в низших спиртах, полярных органических растворителях и водных растворах сильных кислот.
При нагревании с кислотами семикарбазоны разлагаются, легко гидрируются по связи C=N, при нагревании в присутствии щелочей или алкоголятов щелочных металлов образуют углеводороды.
Семикарбазоны используют в аналитической химии для идентификации альдегидов и кетонов по температурам плавления образуемых ими семикарбазонов и для выделения в чистом виде альдегидов и кетонов (через образование, перекристаллизацию и гидролиз семикарбазонов).
Ряд семикарбазонов нашел применение в качестве лекарственных средств. Так, семикарбазон-5-нитрофурфурола (фурацилин) применяется как антисептик местного действия, амбазон (фарингосепт) – какместный бактериостатик.
В защите растений семикарбазоны используются в качестве инсектицидов (Альверде, КС (метафлумизон)) и гербицидов (дифлуфензопир).
В Беларуси из группы семикарбазонов разрешен один инсектицид –Альверде, КС – для применения на картофеле против колорадского жука.
Метафлумизон – это контактно-кишечное вещество, не обладающее системным действием. Механизм действия метафлумизона заключается в воздействии на ключевой энзим и блокировании прохождения ионов через регулируемый напряжением натриевый канал в нервной системе насекомого. В результате происходит блокирование прохождения импульсов возбуждения в нервной системе насекомого, что в конечном счете приводит к параличу и смерти вредителя. Этот механизм действия уникален и является причиной того, что метафлумизон был признан группой экспертов IRAC оригинальным веществом с новым механизмом действия и включен в новую группу IRAC 22В.
Сразу же после попадания действующего вещества в организм вредители прекращают питаться, таким образом культуре не наносится дальнейший вред (AntiFeeding-Effekt). Период защитного действия составляет 2–4 недели. Метафлумизон эффективен как при относительно низких, так и при температурах от 25 °С и выше, так как действующее вещество является практически нелетучим.
8. Антраниламиды
Первое действующее вещество из группы антраниламидов – хлорантранилипрол – официально зарегистрировано в 2007 г. американской компанией «Дюпон». Второе вещество называется циантранилипрол. Его относят к антраниламидам второго поколения, чьей отличительной особенностью является высокая эффективность в отношении вредителей не только с грызущим, но и с колюще-сосущим ротовым аппаратом (трипсы, тли, белокрылки и др.).
Антраниламиды воздействуют на рианидин-рецепторы, регулирующие нервную и мышечную активность насекомых посредством изменения уровня кальция в клетках. Они способствуют активации высвобождения внутренних запасов ионов кальция из мышц (рецептор заставляет рецепторный канал приоткрываться на более продолжительный период времени). Неконтролируемое выделение ионов кальция значительно и резко сокращает его внутренние запасы. Вследствие этого насекомое перестает сокращать мышцы, наступает паралич. Вредитель перестает питаться в течение нескольких минут после поедания отравленной пищи и погибает в течение 2–4 дней.
Антраниламиды имеют контактно-кишечное действие и способны передвигаться трансламинарно, благодаря чему они достаточно стойки к смыванию осадками. К тому же циантранилипрол способен передвигаться по ксилеме (акропетально), что позволяет использовать его в качестве протравителя. Также антраниламиды обладают овицидным и ларвицидным действием, зависящим от времени, в которое проводится обработка. Период их защитного действия составляет 15–20 дней.
Антраниламиды имеют высокие показатели безопасности для полезных насекомых и насекомых-опылителей (пчелы, шмели, хищные клещи). Благодаря высокому селективному действию на рианидин-рецепторы, они являются низкотоксичными для человека, млекопитающих, птиц и рыб. Эти характеристики обеспечивают высокую степень защиты для людей и безопасность для окружающей среды.
9. Растительные инсектициды
Растительные инсектициды – пестициды, получаемые при переработке (размоле, экстрагировании) ядовитых для вредителей растений.
Высушенные цветки некоторых видов ромашки использовались в качестве инсектицида еще в Древнем Китае и затем в средние века в Персии. В 30-х гг. XX столетия на основе извлечения пиретринов органическими растворителями из цветков ромашки начато производство препаратов пиретрума, которые впоследствии стали прародителями современных синтетических пиретроидов.
Кроме природных пиретринов, в пятидесятых годах ХХ столетия в мире широко производились и использовались инсектициды на основе дерриса, которые получали путем размола корней растения деррис. Он содержит вещество ротенон, обладающее сильным инсектицидным действием. Позже препараты дерриса изготовляли из ротенона, полученного из молотых корней путем экстракции. Они были эффективны против многих вредных насекомых, включая блошек, рапсового цветоеда, тлей, медяниц, паутинных клещей и многих гусениц.
Другим распространенным препаратом растительного происхождения того времени был инсектицид Реания, получивший свое название благодаря растению Ryania speciosa, из которого он добывался. Это вещество оказалось очень полезным в борьбе с европейским кукурузным бурильщиком и сверлильщицей сахарного тростника. Было замечено, что Реания не только уничтожает стеблевого мотылька, но и способствует подавлению головни кукурузы.
В СССР находил применение анабазин – алкалоид, который содержится в безлистном ежовнике (Anabasis aphylla) из семейства лебедовых.
Однако в современной практике защиты растений нашел применение только никотин в качестве инсектицида, разрешенного для применения в личном приусадебном хозяйстве. Никотин – это сильнодействующий нейротоксин, особенно ядовитый для насекомых.
Никотин – алкалоид пиридинового ряда, содержащийся в растениях семейства пасленовых (Solanaceae), преимущественно в листьях и стеблях табака (концентрация в сухом веществе от 0,3 до 5 % по массе), махорки (2–14 %), в меньших количествах в томатах, картофеле, баклажанах и зеленом перце. Биосинтез никотина происходит в корнях, а накапливается он в листьях.
Наименование «никотин» происходит от латинского названия табака Nicotiana tabacum, которое, в свою очередь, придумано в честь Жана Нико – посла Франции при португальском дворе, который в 1560 г. отправил немного табака королеве Екатерине Медичи, порекомендовав его как средство от мигрени.
Никотин был издавна известен в неочищенном виде. Первое упоминание о масле табака принадлежит французскому алхимику, последователю Парацельса, старательно искавшему возможность изучить растения, привезенные из Америки. В его работе «Instruction sur l’herbe petum» (1572) находится первое описание перегонки листьев табака. Масло табака, упоминаемое в источниках XVII и XVIII вв. как наружное средство для лечения болезней кожи, в то время получали именно таким способом. Детальное описание получения никотина из листьев табака обнаружено в книге «Traité de la chymie» (1660) другого французского химика Николя Лефевра. В качестве иллюстрации принципа разделения веществ и из-за медицинской значимости он детально описывает процесс, являющийся по существу перегонкой с водяным паром. В результате этого процесса испаряющаяся вода уносит с паром никотин и в колбе-приемнике образуются два слоя: водный и органический. Органический слой отделяли, очищали и использовали для борьбы с астмой, воспалением селезенки и эпилепсией.
В 1809 г. французский химик-аналитик Луи Николя Воклен опубликовал работу, посвященную тщательному анализу виргинского табака. В рамках этой работы Воклен смог выделить достаточно чистый образец никотина, а также выделил яблочную кислоту, с которой никотин связан в табаке. Несмотря на отличную аналитическую работу, Воклена не считают первооткрывателем никотина, поскольку он не распознал в никотине алкалоид, а считал, что основные свойства вещества связаны с примесью аммиака, в то время как алкалоиды сами являются основаниями.
Никотин был открыт германскими химиками Посселтом и Райманном. В 1828 г. они выиграли ежегодный приз Гейдельбергского университета за лучшую работу. Но многие химики отказывались верить, что алкалоид может быть жидкостью, однако специально созданная комиссия перепроверила и подтвердила полученные результаты.
В 1843 г. была найдена эмпирическая формула никотина. Структура никотина широко обсуждалась в течение 80-х – начала 90-х гг. XIX в., и в 1893 г. она была установлена немецким химиком Адольфом Пиннером. Синтез данного вещества был реализован в 1904 г. В серии статей Пикте опубликовал не только метод получения синтетического никотина, идентичного природному, но также и двух продуктов его окисления – никотирина и дигидроникотирина.
Первый синтез оптически активного (S)-никотина был проведен в 1982 г. Исходным материалом служил оптически активный замещенный пирролидин, а пиридиновый цикл создавался в ходе синтеза.
С никотином связано нашумевшее дело об отравлении в Бельгии в 1850 г. В качестве консультанта выступил бельгийский химик Жан Серве Стас, который не только установил, что отравление было произведено никотином, но также разработал метод обнаружения алкалоидов, который с небольшими модификациями и сегодня применяется в аналитической химии. В расследование также был вовлечен французский химик Матьё Орфила, который, услышав о деле и проведя токсикологические эксперименты на животных, пришел к методу определения алкалоидов, похожему на метод Стаса. Более того, в промежутке между окончанием расследования и судом Орфила опубликовал свои результаты, в то время как Стас, являясь экспертом по делу, вынужден был молчать. Бельгийская пресса обвинила Орфилу в мошенничестве, но Стас в своих публикациях все же отдал Орфиле должное, тем не менее указав, что первооткрывателем является он сам.
Исторически никотин часто использовался в медицинских целях. В настоящее время также разрабатывается методика использования никотина для лечения различных заболеваний. Наиболее распространенным направлением является доставка никотина в организм альтернативными путями для лечения никотиновой зависимости. Исследуется возможность применения никотина и в других областях, например, в качестве болеутоляющего, средства от синдрома дефицита внимания, болезни Альцгеймера, болезни Паркинсона, колита, герпеса и туберкулеза.
В современном сельскохозяйственном производстве используются производные никотина – неоникотиноиды.
10. Авермектины
Авермектины – продукты жизнедеятельности почвенных грибов Streptomyces avermitilis. Токсические вещества, получаемые на их основе, сложно отнести только к химическим или только к биологическим соединениям.
В настоящее время в ряде стран подобные «двойственные» препараты классифицируются как биопестициды.
Инсектицидные и акарицидные свойства авермектинов были выявлены еще в 1976 г. специалистами фирмы «Мерк Шарп Дом Компани» под руководством Сатоси Омура при проведении оценки антигельминтного потенциала образцов почвы с площадок для гольфа. В процессе исследований было обнаружено, что авермектины имеют высокую активность и широкий спектр антипаразитарного действия. Первое описание культуры Streptomyces avermitilis как продуцента авермектинов появилось в 1978 г. в работах Берга, Миллера. В 1984 г. Остинд и Лэгг получили авермектины синтетическим путем.
Культура Streptomyces avermitilis продуцирует четыре основные формы авермектинов – А1, А2, В1, В2, которые отличаются радикалами. В свою очередь, каждый компонент имеет две формы изомеров: а и b. Комплекс, содержащий 8 авермектинов, получил название аверсектин, очищенный (степень очистки не менее 90 %) природный авермектиновый комплекс получил название аверсектин С.
Противопаразитарной активностью обладают все авермектины, но сильнее всего она выражена у авермектина В1. Но они не уничтожают инвазионных личинок нематод, а как репелленты дезориентируют их в поисках корней растения-хозяина в течение длительного времени.
Природный авермектин B1, изолированный из комплекса, получил название абамектин. Один из первых препаратов для защиты растений на основе действующего вещества абамектин (1,8 %) зарегистрировала швейцарская химическая компания «Сингента» под названием Вертимек.
Одним из направлений в научной работе с авермектинами стала селекционная работа с Streptomyces avermitilis и получение новых штаммов продуцента. Второе направление – получение синтетических авермектинов и химическая модификация с целью снижения токсичности для теплокровных. Дополнительно обнаружение противоопухолевых свойств авермектинов группы А стало началом научных экспериментов в лечении раковых заболеваний.
Авермектины – это нейротоксичные яды. Попадая в организм беспозвоночных контактно или через кишечник, они действуют на h-глю-тамин и гамма-аминомасляную кислоту, являющуюся в периферичес-кой нервной системе таким же регулятором-рецептором, как ацетилхолинэстераза для ацетилхолина.
Авермектины стимулируют освобождение ГАМК из нервных окончаний и повышение связи ГАМК с местами рецептора на постсинаптической мембране мышечных клеток насекомых. Это приводит к торможению и блокированию передачи нервного импульса, вследствие чего происходит паралич, а затем и гибель особей многих видов насекомых, клещей и нематод.
Авермектины эффективно действуют на вредителей при температурах 18–20 °С, а при температурах свыше 28 °С их эффективность возрастает.
Авермектины не являются стойкими соединениями, на поверхности растений, почвы и воды при действии солнечных лучей и кислорода их период полураспада составляет всего 12 часов.
Авермектины токсичны для большинства водных беспозвоночных и рыб, поэтому нельзя допускать попадания препаратов в естественные водоемы.
По отношению к пчелам обладают средней токсичностью, но уже через 2–4 часа после высыхания на поверхности листьев препараты не представляют опасности для насекомых-опылителей.
Авермектины не накапливаются в растительной продукции.
Препараты не вызывают кожно-раздражающих и аллергических реакций (однако возможна индивидуальная чувствительность). Но чистые авермектины очень опасны для людей и животных, поэтому препараты выпускаются в концентрации 0,2 %. Таким образом достигается умеренная токсичность.
Высокая активность авермектинов против членистоногих и нематод при малой концентрации послужила толчком для производства сотен препаратов для ветеринарии. Большая часть ветеринарных препаратов содержит действующее вещество полусинтетический ивермектин (Ивомек, Иверсект, Ивермек, Баймек, Цевамек, Иверген, Бимектин, Пандекс, Ивертин, Новомек, Гиподастин и др.).
Препараты для защиты растений выпускаются на основе аверсектина С (Фитоверм, КЭ; Актофит, к. э.), абамектина (Крафт, ВЭ) и эмамектин бензоата (Проклэйм, ВРГ). Все вышепредставленные препараты содержат растворитель – этиловый спирт. Поэтому, исходя из большой нормы расхода (в силу малой концентрации действующего вещества), обработка субстрата с растениями недопустима. Возможны ожоги корневой системы. При внекорневой обработке спирт быстро испаряется, а фитотоксичность минимальна.
В Беларуси авермектины не используются для борьбы с нематодами, но в странах, где они разрешены для применения, производят специальные авермектиновые препараты на твердой органической основе. Натуральные авермектины плохо растворимы в воде, поэтому не способны транспортироваться по сосудистой системе растений.
11. Тетроновые кислоты (кетоенолы)
Кетоенолы – это новый химический класс веществ, обладающих инсектицидными и акарицидными свойствами.
Они ингибируют синтез липидов, в результате чего замедляется развитие вредителя и наступает его гибель.
В Беларуси на сегодняшний момент разрешены для применения два действующих вещества из данного класса – спиротетрамат и спиродиклофен.
Спиротетрамат проявляет овицидную и трансовариальную активность по отношению к имаго (теряют способность к размножению), а спиродиклофен действует против всех стадий развития растительноядных клещей: яйца, личинки, протонимфы, дейтонимфы, взрослые клещи.
Спиротетрамат обладает контактно-кишечным и системным действием, а спиродиклофен – только контактным.
12. Пиридины
Пиридин был известен еще алхимикам, но первое письменное описание этого вещества было сделано шотландским химиком Томасом Андерсоном в 1851 г. Он обнаружил его при исследовании костяного масла, получающегося сухой перегонкой необезжиренных костей, среди прочих веществ была получена бесцветная жидкость с неприятным запахом. В 1869 г. Кернер высказал мысль, что пиридин может рассматриваться как бензол, в котором одна группа СН замещена азотом. По мнению Кернера, подобная формула не только объясняла синтезы пиридина, но указывала, почему простейший член ряда пиридиновых оснований имеет пять атомов углерода. Через год Дьюар, независимо от Кернера, пришел к той же формуле, которая затем нашла себе подтверждение и в более поздних работах других химиков. Позже изучением структуры пиридина занимались Томсен, Бамбергер и Пехманн, Чамичан и Деннштедт. В 1879 г. А. Вышнеградский высказал мнение, что, может быть, все растительные основания являются производными пиридина или хинолина, а в 1880 г. Кенигс предлагал даже алкалоидами называть только те растительные основания, которые могут рассматриваться как производные пиридина. Однако в настоящее время границы понятия «алкалоиды» значительно расширились.
В настоящее время пиридины применяют в синтезе красителей, лекарственных веществ, инсектицидов, в аналитической химии как растворители многих органических и некоторых неорганических веществ, для денатурирования спирта.
В качестве инсектицида в Беларуси из группы пиридинов зарегистрировано одно действующее вещество – пиметрозин (Пленум, ВДГ) – для защиты рапса, огурца, розы и других цветочно-декоративных культур защищенного грунта от насекомых-вредителей.
Пиметрозин – это контактно-кишечный инсектицид, имеющий трансламинарные и системные свойства. Он является нейроингибитором питательной активности, воздействуя одновременно на пищеварительную и нервную системы и вызывая спонтанную перистальтику и электрическую активность. Впоследствии насекомые гибнут от голода. При этом пиметрозин не обладает «нокдаун-эффектом», но питание вредителей прекращается почти сразу после приема пищи. Попадание пиметрозина в организм тлей обусловливает невозможность внедрения хоботка в растение сразу или в течение нескольких часов после питания.
13. Сера
С серой люди были знакомы еще задолго до того, как начали понимать, что это такое. На протяжении своей древней истории сера очень часто применялась при совершении различных обрядов, в том числе и религиозных. Куски самородной серы использовали экзорцисты, изгоняющие бесов, а серным дымом окуривали помещения храмов. Согласно легенде, даже Одиссей, вернувшись домой из дальних странствий, перво-наперво приказал окурить свое жилище серой. Во времена Средневековья алхимики считали, что любой металл состоит из серы и ртути, причем, чем меньше серы в нем содержится, тем он лучше и благороднее.
Словом, сера как элемент и как химическое вещество длительное время была окружена многочисленными домыслами. И лишь в
XIII–XIV вв., когда ее стали целенаправленно использовать в опытах при получении других соединений, она стала выглядеть в глазах человека куда менее загадочно. Киноварь и порох стали первыми примерами практического применения серы. Сейчас же спектр ее использования расширился еще больше: она необходима для изготовления серной кислоты, вулканизации каучука и протекания других реакций органического синтеза, в производстве красителей, сельскохозяйственных удобрений, реактивов для проведения лабораторных проб и др.
В природе сера встречается и в свободном состоянии, и в различных соединениях. Широко распространены соединения серы с различными металлами. Многие из них считаются ценными рудами (свинцовый блеск, цинковая обманка, медный блеск) и являются источниками получения цветных металлов. Сера принадлежит к широко распространенным в природе элементам. Встречается в горных породах, минералах, углях, нефти, почвах, присутствует и содержится во всех живых организмах.
В геологических отложениях насчитывается около 40 минералов группы сульфидов и столько же минералов группы сульфатов. В глубоких горизонтах почвы сера представлена в форме пирита, марказита; в сульфатах – в сочетаниях со щелочными и щелочноземельными металлами. Серу находили во множестве минеральных источников. Один из таких есть в Новой Зеландии; из-за присутствия соединений серы и особого состава обитающих там водорослей вода в нем имеет ядовито-зеленый цвет. Естественно, еще с незапамятных времен этому источнику дали зловещее название «Ванна Дьявола».
Большое количество серы поступает в почву с атмосферными осадками. В форме органических соединений сера совершает долгий путь в цикле почвообразования и становится доступной растениям при разложении органических веществ и образовании минеральных соединений. Этот процесс называют сульфофикацией. Он имеет сезонный характер – минимальный весной, максимальный летом и затихающий к осени. Высвобождение серы идет в том же соотношении, в котором она находится в органических остатках и гумусе.
Сера активно участвует в окислительно-восстановительных процессах, активировании энзимов, белковом обмене. Она способствует фиксации азота из атмосферы путем усиления образования клубеньков у бобовых. Сера является составной частью белков и содержится в важнейших аминокислотах – цистине и метионине. Сера входит также в состав гликозидов, витамина В, биотина, некоторых антибиотиков (пенициллина).
Источником питания серой для растений служат соли серной кислоты. Частично сера в виде сернистого газа (SO2) поглощается растениями из воздуха. Окисленная форма серы – исходный продукт для синтеза белков. Эта же форма является и конечным продуктом при распаде белковой молекулы.
Недостаток серы приводит к задержке синтеза белков, поскольку затрудняется образование аминокислот, содержащих данный элемент. Из-за этого визуальные проявления недостаточности серы похожи на признаки азотного голодания: замедляется развитие растений, уменьшается размер листьев, стебли удлиняются, листья и черешки становятся деревянистыми. В отличие от азотного голодания, при серном листья не отмирают, хотя их цвет становится бледным.
Сера как химический элемент фармакодинамически неактивна.
Однако после поступления в организм, а также при попадании на кожу, слизистые оболочки имеются условия для включения ее в химические соединения, обладающие высокой фармакодинамической и инсектоакарицидной активностью.
На коже и слизистых оболочках сера действует раздражающе на экстероцепторы с одновременным образованием ангидрида сернистого, который усиливает эффект раздражения и тем более при превращении его в сернистую кислоту. Сернистый ангидрид – сильное противочесоточное вещество и слабый антисептик. Частично на коже образуется сероводород.
Сера, введенная внутрь, проходит через желудок в кишечник без существенных химических превращений. В кишечнике, особенно толстом, 10 % серы используется на синтез сероводорода и других сульфитов. Сероводород образуется в кишечнике в небольших количествах постоянно, так как он является физиологическим раздражителем рецепторов слизистой оболочки, обеспечивающим определенный уровень секреторно-моторной функции кишечника. Дополнительное введение серы в организм способствует накоплению сероводорода в кишечнике, что усиливает секреторно-моторную функцию кишечника, размягчает каловые массы и ускоряет их эвакуацию, т. е. обеспечивает легкий слабительный эффект.
Некоторая часть образовавшихся сульфитов всасывается через слизистую кишечника. В крови и тканях они используются для биосинтеза белков с усилением интенсивности обменных процессов в организме и особенно в кератинсодержащих образованиях (волосы, шерсть, копыта, рога, перья, кожа и др.).
Небольшая часть серосодержащих веществ выделяется из организма с выдыхаемым воздухом, молекулы которых, раздражая рецепторы слизистой дыхательных путей, повышают секрецию желез с одновременной активизацией мерцательного эпителия и улучшением отхаркивания. Из организма неиспользованная сера выделяется с калом, а сернистые соединения – с мочой и калом.
Сера высокоэффективна как противопаразитарное и антитоксическое вещество, оказывающее также кератолитическое и раздражающее действие.
Для перорального введения применяют серу очищенную, так как она постепенно включается в химические реакции и в меньших количествах образует сероводород, поэтому и резорбция его в кровь меньше. Сера же осажденная более активно включается в химические реакции с образованием в больших количествах сероводорода, следствием чего является его повышенная резорбция с возможным проявлением токсического эффекта.
Очищенную и осажденную серу в форме мази 10–30%-ной концентрации первой и 5, 10 и 20%-ной концентрации второй применяют наружно для лечения животных, больных чесоткой, трихофитией, себореей, экземой, фурункулезом, микроспорией, дерматитом. Обе серы для лечебных целей применяют наружно в линиментах, дустах и порошках.
14. Изотиоцианаты
Изотиоцианаты (горчичные масла) – это органические соединения, содержащие функциональную группу –N=C=S.
Данная группа насчитывает более 300 соединений: этилмеркаптан, изопропилтиоцианат, этилизотиоцианат, аллилизотиоцианат, метилдисульфид, третичный бутил-бромид, эпихлоргидрин, 2-хлорэтиловый эфир, 2-бромметилэтиловый эфир, аллилбромид, 2-бромэтилацетат и др.
Изотиоцианаты встречаются в различных растениях, образуясь в них при гидролизе S-гликозидов – гликозинолатов, катализируемом ферментом мирозиназой. В растениях семейства капустных – различных сортах капусты, хрене, семенах черной горчицы – содержится гликозилат синигрин (R = –CH2CH=CH2), образующийся при гидролизе аллилизотиоцианат, обусловливающий жгучий вкус горчицы и хрена. На этом основано применение горчичников как раздражающего средства. Но этот гидролиз быстро протекает лишь при температуре не ниже 37 °С, поэтому горчичники непосредственно перед употреблением опускают на несколько секунд в воду указанной температуры и накладывают на кожу в нужном месте. Через 3–5 минут начинается покраснение и жжение кожи. Аллилизотиоцианат также применяют для приготовления мазей и горчичных пластырей. Он раздражает кожу и слизистые ткани, обладает кожно-нарывным и слезоточивым действием.
В давние времена люди, употреблявшие в пищу горчицу, заметили, что начало, придающее ей остроту, не содержится в семенах в свободном состоянии. Они также заметили, что для появления запаха семена надо растереть с водой. Эту работу следует рассматривать как начало современных исследований, посвященных горчичному маслу и его получению из растительного сырья. Исследователи Бутрон и Фрем сделали значительный шаг вперед, когда, применив экстракцию холодным спиртом, выделили из семян черной горчицы твердое вещество, которое Бюсси назвал мирозином. Последнее, как это было показано позднее, содержит фермент мирозиназу.
Аллилизотиоцианат применяют в сельскохозяйственном производстве для консервирования свежескошенной или подвяленной травы и ботвы свеклы в виде 1%-ной водной эмульсии с добавлением
0,05–0,1%-ного эмульгатора. Норма расхода от 0,3 до 2 л на 10 000 кг растительных кормов.
Было проведено много исследований для выявления из изотиоцианатов эффективных фумигантов. Некоторые изотиоцианаты растительного происхождения являются биологически активными соединениями. Так, например, сульфорафан в экспериментальных моделях проявляет широкий спектр активности, включая антибактериальную, противораковую и радиосенсибилизирующую.
Изотиоцианаты имеют промышленное значение, так как являются исходными материалами для целого ряда полимеров.
Также их используют в виноделии. Дозы аллилгорчичного масла 0,9 мг/дм3 в сухих и 1,2 мг/дм3 в полусухих и полусладких винах в сочетании с сернистой кислотой оказывают фунги- и бактериостатическое действие. Но, например, в России аллилгорчичное масло не применяется, так как оно иногда ощущается во вкусе вина. В Италии применяют парафиновые таблетки, содержащие аллилгорчичное масло, для защиты поверхности вина в неполной емкости от размножения аэробных микроорганизмов.
В Беларуси в настоящее время имеется одно действующее вещество из класса изотиоцианатов – аллилизотиоцианат, разрешенное для применения в защите растений. Данное вещество входит в состав инсектицида Табагор (горчично-табачная пыль), который рекомендован для борьбы с тлями и трипсами на цветочных культурах открытого грунта в личном подсобном хозяйстве.
15. Пиразолы
К химическому классу пиразолов относится действующее вещество тебуфенпирад (Масай, ВРП), эффективное в отношении клещей.
Тебуфенпирад – это контактно-кишечный, акарицид, обладающий трансламинарным и локально-системным действием. Попадая в растение, он способен проникать через внутренние ткани с обработанной стороны листа к необработанной части. Тебуфенпирад ингибирует митохондриальное окислительное фосфорилирование, нарушает в митохондриях транспорт электронов. Он действует не только на подвижные стадии развития клеща, но и эффективен в период летней яйцекладки, являясь очень мощным овицидом. Тебуфенпирад работает в широком диапазоне температур (10–30 °C). Период защитного действия – до пяти недель.
16. Тетразины
Под этим названием известны химические соединения, принадлежащие к полиазинам и имеющие замкнутое кольцо, состоящее из двух атомов углерода и четырех атомов азота.
В качестве акарицида используются действующие вещества клофентезин и флуфензин. На территории Беларуси зарегистрирован один препарат на основе клофентезина – Аполло, КС.
Клофентезин – это селективный контактный акарицид, который имеет очень узкий спектр действия. Он действует в основном против семейства Tetranychidae, в том числе всех паутинных клещей. Клофентезин останавливает все стадии развития вредителя, имеет овицидные свойства, стерилизует самок, но не убивает взрослых особей. Взрослые особи умирают своей смертью. Внешне эффект может быть заметен спустя несколько дней. Поэтому рекомендуется применение его в смеси с любым из препаратов, которые уничтожают и взрослые формы, например с авермектинами. Клофентезин против клещей из других семейств малоэффективен.
17. Эфирсульфиты
Представителем данной группы является действующее вещество пропаргит, официально зарегистрированное в 1969 г. Механизм действия заключается в ингибировании митохондриальной АТФ-синтазы.
Пропаргит – это специфический акарицид контактного действия, поражающий подвижные стадии развития клещей (личинка, нимфа и взрослая особь), но не действующий на стадию яйца. Пропаргит быстро проникает в восковое покрытие листьев растений, поэтому устойчив к осадкам. Период защитного действия составляет 14–21 дней. Во избежание фитотоксичности следует применять пропаргит в условиях, способствующих быстрому обсыханию растений (низкая влажность, теплая погода). Пропаргит имеет достаточно большой срок ожидания в открытом грунте (45–60 дней), что связано с его резко выраженными кумулятивными свойствами и выраженной кожно-резорб-тивной токсичностью.
В Беларуси на основе пропаргита зарегистрирован один акарицид – Омайт, СП, разрешенный для применения на сое, огурце, яблоне, вишне, винограде, хмеле, гвоздике и розе для борьбы с обыкновенным паутинным клещом.
18. Бутенолиды
Бутенолиды – это новый химический класс инсектицидов. Первым и пока единственным действующим веществом бутенолидов является флупирадифурон, который был разработан компанией «Bayer Crop-Science» в 2012 г. Сейчас данное действующее вещество зарегистрировано во многих странах мира: Гондурасе, Гватемале, США, Мексике, Никарагуа, Канаде, Австрии, Болгарии, Чехии, Дании, Финляндии, Ирландии, Италии, Нидерландах, Словении, Беларуси и др.
Бутенолидная последовательность, характерная для флупирадифурона, присутствует и у растительного алкалоида стемофолина, выделенного из растения Stemona japonica, произрастающего в основном в Юго-Восточной Азии. Давно известны инсектицидные свойства стемофолина, однако только исследователи «Bayer CropScience» выяснили, что инсектицидность алкалоиду обеспечивает именно бутенолидная последовательность. Немецкие ученые скомбинировали данную последовательность с двумя химическими последовательностями для повышения эффективности и селективности активного компонента: в дополнение к природной последовательности было присоединено хлорированное пиридиновое кольцо, которое, как было ранее установлено, эффективно против насекомых, а также новый активный ингредиент ‒ короткая флуориновая углеродная цепь. В итоге было создано вещество флупирадифурон с отличным экологическим профилем ‒ высокой селективностью по отношению к насекомым-вредителям и толерантностью к большинству полезных насекомых.
На территории Республики Беларусь исследования по эффективности и возможности включения комбинированного инсектицида Сиванто Энерджи, КЭ, который в своем составе имеет флупирадифурон, в Государственный реестр средств защиты растений проводились в 2016–2018 гг. и уже в настоящее время вышеназванный препарат зарегистрирован для применения на озимом и яровом рапсе. В декабре 2018 г. ожидается его регистрация на капусте белокочанной против крестоцветных блошек, капустной тли, капустной совки и капустной белянки и на озимой пшенице против пьявиц.
19. Родентициды
Родентицид – химическое средство для борьбы с грызунами.
Родентициды – собирательное название средств защиты растений, состоящее из двух латинских слов: rodent – грызун и caedo – сокращать (средства, сокращающие численность грызунов).
Грызуны очень давно находятся в противостоянии с человеком. Уничтожая запасы и повреждая культурные растения, они причиняют большой экономический ущерб наряду с другими вредоносными организмами.
Самыми древними методами борьбы с грызунами были механический (ловушки и капканы) и биологический (привлечение естественных врагов – кошки и собаки). Однако они помогали справиться с грызунами в личных подсобных хозяйствах, но не были достаточно эффективными в полевых (сельскохозяйственных) условиях и больших помещениях хранилищ. Чтобы сохранить урожай от вредителей, люди стали использовать различные токсические вещества для их уничтожения. Одним из первых был мышьяк, который не закрепился в качестве родентицида, так как был токсичным для других животных и человека. Позже стали применяться соединения мышьяка, входящие в состав отравленных приманок: арсенит и арсенат кальция.
В начале прошлого века начали также использовать газовые методы борьбы с грызунами. Так, в 1917 г. на полях Томской губернии
Семипалатинской области были впервые применены удушливые газы (хлор) для борьбы с сусликами. Помимо хлора, в дальнейшем применялись фосген и смесь хлора с фосгеном, а также хлор в сочетании с хлористым сульфурилом. После Первой мировой и Гражданской войн газовые методы стали едва ли не единственными из применяемых на практике способов борьбы с грызунами: события в стране практически пресекли возможность получать более совершенные химические препараты из-за рубежа.
До середины 1940-х гг. прошлого столетия для борьбы с грызунами применяли исключительно яды острого типа действия самых различных классов химических соединений и оценка их свойств проводилась главным образом по величине летальной дозы в желудке для серой крысы. Наиболее пригодным для использования оказалось применение нафтилтиокарбамида (крысида), фосфида цинка и, позже, глифтора в составе пищевых приманок. В России первый используется до сих пор, второй был на протяжении некоторого времени запрещен, но сейчас опять применяется с ограничениями, а последний вышел из обращения. В качестве родентицидов применяли также различные фумиганты, наиболее широко применялся бромистый метил в малых концентрациях. В результате их быстрого действия численность грызу-
нов начала резко сокращаться. Однако на яды, высокотоксичные для теплокровных животных и птиц, у зверьков образуется защитно-рефлекторная реакция, проявляющаяся в отказе от повторного поедания приманки. Данные недостатки предопределили появление в середине прошлого века новых родентицидов – антикоагулянтного действия. В настоящее время они являются наиболее предпочитаемыми родентицидами.
В зависимости от скорости действия родентицида выделяют:
- 1) родентициды острого действия – вызывают гибель грызунов за промежуток времени от нескольких минут до нескольких дней (α-нафтилтиокарбамид, фосфид цинка);
- 2) родентициды подострого и хронического действия – достаточно долгое время накапливаются в организме и вызывают эффект, только достигнув определенной концентрации. Срок наступления эффекта – до нескольких недель (варфарин, этилфенацин, дифацинон, трифенацин, хлорфасинон, тетрафенацин, бромадиолон, флокумафен, бродифакум).
По химическому строению родентициды бывают органическими и неорганическими (фосфид цинка).
К органическим родентицидам относятся антикоагулянты крови и производные тиомочевины (крысид).
В свою очередь, антикоагулянты крови подразделяются на два поколения. К первому поколению относятся варфарин и индандионовый ряд (этилфенацин, дифацинон, трифенацин, хлорфасинон, тетрафенацин). К антикоагулянтам второго поколения относятся вещества кумаринового ряда (бромадиолон, флокумафен, бродифакум).
В качестве «побочных» родентицидов используют также вещества, не входящие в состав пищевых приманок. В частности, препараты на основе фосфина используются для фумигации зерноперерабатывающих предприятий; целью фумиганта являются насекомые, однако при такой фумигации погибают и грызуны, не успевшие покинуть обрабатываемое помещение.
Родентициды уничтожают грызунов при поступлении в желудочно-кишечный тракт или, реже, ингаляционно (фумиганты). Кишечные родентициды съедаются вредителями вместе со смесями пищевых продуктов, к которым добавляют химические препараты, а ингаляционные непосредственно вдыхаются в легкие. Средства, используемые для газации (фумигации), тяжелее воздуха, поэтому они легко проникают в норы и другие места обитания грызунов.
Механизмы действия родентицидов различаются: фосфид цинка при смачивании кислотами образует токсичный газ (фосфин), вызывающий отравление грызуна; крысид повреждает легочные сосуды и нарушает процессы дыхания; антикоагулянты снижают свертываемость крови, блокируя тромбин и вызывая повышенную кровоточивость у животного, приводящую к его гибели; хлор и другие удушающие газы поступают через дыхательные пути и вызывают острую асфиксию; фосфин при вдыхании всасывается в кровь через легочные капилляры, парализует нервную систему и нарушает многие процессы метаболизма, оказывая острое и быстрое токсическое действие.
В настоящее время в Беларуси зарегистрированы два родентицида, которые относятся к антикоагулянтам крови (Гардентоп Паста и Шторм, восковые брикеты).
В целом антикоагулянты крови по химическому составу относятся к производным кумарина и индандионов и, как отмечалось выше, подразделяются на два поколения. Данное подразделение основано на количестве доз, вызывающих гибель грызунов.
К первому поколению относятся: варфарин (зоокумарин), дифенацин (ратиндан), куматетралил, этилфенацин, трифенацин, хлорфасинон. Для достижения эффективности приманка, включающая антикоагулянты первого поколения, должна поедаться мышевидными грызунами многократно.
К антикоагулянтам второго поколения относятся: дифенакум, бродифакум, дифетиалон, флокумафен, бромадиолон, изоиндан (изопропилфацинон, тетрафенацин, изоцин). Антикоагулянты второго поколения, как и первого, обладают такими же механизмом действия и кумулятивными свойствами. Они эффективны как при однократном, так и при многократном потреблении приманки грызунами. Гибель грызунов наступает на 3–5-е сутки, что быстрее, чем от антикоагулянтов первого поколения.
Из антикоагулянтных родентицидов наибольшую опасность для окружающей среды представляет бродифакум.
Преимущества антикоагулянтов: действуют медленно, не вызывая острых болевых ощущений; не провоцируют образования реакции избегания; концентрация яда в приманке снижена до порога вкусовой чувствительности, при которой грызуны его практически не ощущают, что не вызывает у них настороженности, и они поедают повторно отравленную приманку в тех же количествах вплоть до самой гибели.
История создания антикоагулянтных препаратов связана с тем, что в 1920-х гг. в Северной Америке обнаружили новое заболевание крупного рогатого скота. Оно возникало при скармливании испорченного клеверного сена и заключалось в сильных внутренних кровоизлияниях, которые часто приводили к гибели животных. Оказалось, что при порче подобного сена образуется токсическое вещество дикумарол, обладающее свойством разжижать кровь и резко снижать ее свертываемость, так что даже легкое ранение вызывает постоянное кровотечение и, как следствие, большие потери крови. На основе этих наблюдений был создан ряд антикоагулянтов крови, структурную основу которых составляет ядро кумарина.
Антикоагулянты крови блокируют образование тромбоцитов и нарушают свертываемость крови. Эти вещества обладают способностью накапливаться в организме, что приводит к необратимым физиологическим и биологическим изменениям, а затем и к гибели грызуна. При поступлении в организм в несмертельных дозах, но многократно антикоагулянты тормозят синтез печенью протромбина, тромботронина и других факторов свертывания крови, в результате чего происходит кровоизлияние во внутренние органы и грызун погибает в течение 3–14 суток. Механизм действия этих родентицидов заключается в ингибировании К1-редуктазы, что препятствует образованию активной формы витамина К1, необходимого для синтеза факторов свертываемости крови.
Антикоагулянты первого поколения наиболее эффективны против крыс, антикоагулянты второго поколения одинаково эффективны против крыс, мышей и полевок.
В Великобритании антикоагулянты стали применять с 1950 г., а в 1953 г. (по другим данным в 1958 г.) на одной из ферм Западной Шотландии впервые была обнаружена устойчивость к варфарину серых крыс. Вскоре после обнаружения резистентных крыс в Шотландии стали поступать сообщения об их наличии в 1962 г. в Дании, в 1966 г. в Нидерландах и Гвиане, в 1970-х гг. в ФРГ, Бельгии, США, причем в основном в сельской местности. К 1972 г. они появились в 12 районах Великобритании. Одна из резистентных популяций, обитающих в од-ном из районов Уэльса, была очень хорошо изучена. Первый раз резистентные крысы были замечены там в 1959 г.
Территория их обитания постепенно расширялась со скоростью три мили в год. Это обычная скорость освоения крысами новой территории. Продолжение применения яда повлияло на распространение так же, как и давление отбора, продолжающее действовать на популяцию еще в течение нескольких лет. Применение яда неожиданно изменило среду обитания этих крыс, что привело к изменению селективной ценности генов. Их наличие в гомозиготном виде стало летальным. Мутанты, имеющие доминантные резистентные аллели гена, оказались в лучшем положении. Генетический набор популяции в новых условиях изменился.
Обнаружение в 1958 г. в Европе резистентности серой крысы, а затем и домовой мыши к варфарину стимулировало создание антикоагулянтных препаратов второго поколения, обладающих более острыми свойствами и действующими даже после однократного поступления в организм грызуна. Их активное использование для подавления резистентных популяций крыс и мышей полностью не решило проблему, так как выяснилось, что резистентность может возникнуть и к этим родентицидам. Резистентность к антикоагулянтным препаратам может развиться уже через 5–10 лет после их постоянного использования.
Для предотвращения появления резистентных рас к антикоагулянтам нужно: использовать синергисты, применять хемостерилянты, чередовать антикоагулянты с ядами острого действия. Для всех антикоагулянтов непрямого действия характерна кумулятивность.
Преимущество антикоагулянтов по безопасности для человека и домашних животных общепризнано и объясняется медленным действием таких препаратов и существованием противоядия (витамины группы К). Если отравления персонала фосфидом цинка из-за нарушения правил безопасности происходили почти повсеместно, то с внедрением антикоагулянтов такой проблемы не стало, потому что отравление этими препаратами возможно только в результате поедания родентицидных приманок, в то время как отравления фосфидом могут произойти даже в результате присутствия людей в одном помещении с этими препаратами, не говоря о прямых отравлениях.
20. Моллюскоциды
Моллюскоцид – общепринятое в мировой практике собирательное название средств для защиты растений, которое состоит из двух латинских слов: mollusca – моллюски и caedo – сокращать (средства, сокращающие численность моллюсков).
Ассортимент современных моллюскоцидов очень узок. Так, на сегодняшний день в Беларуси имеется всего один препарат для борьбы с моллюсками – Слизнеед, Г, на основе действующего вещества метальдегид.
Морфофизиологические особенности наземных моллюсков, резко отличающие их от прочих вредителей сельского хозяйства, определяют специфику ограничения численности слизней с помощью пестицидов. Одна из таких особенностей, сильно затрудняющая борьбу со слизнями, заключается в высокой устойчивости этих организмов практически ко всем известным соединениям, используемым для защиты культурных растений.
В конце прошлого века моллюскоцидные свойства были обнаружены у ряда неорганических соединений – медного и железного купороса, извести, суперфосфата, сульфата аммония, соединений мышьяка и др. Однако эти соединения не получили широкого распространения ввиду больших норм расхода, высокой трудоемкости применения и низкой эффективности.
Органические препараты контактного действия – дуст этилового эфира диметилдитиокарбаминовой кислоты и этиленхлоргидрин – также оказались малоэффективными, поскольку их применение предусматривает обязательный контакт с телом моллюска. Не нашел применения и метод наземной фумигации аммиаком, так как пары аммиака оставляют на растениях ожоги и вредны для человека.
В 30–40-х гг. прошлого столетия сначала в Англии, а затем и в дру-гих странах для борьбы со слизнями стали применять препараты полимера уксусного альдегида – метальдегида, которые удачно сочетают в себе значительную контактную и кишечную токсичность для моллюсков с высокой селективностью действия. Кроме того, эти препараты не относятся к числу высокотоксичных соединений для человека и теплокровных животных.
Метальдегид также используется в виде сухого горючего. До сих пор продается в форме таблеток для маленьких печек и для предварительного разогрева примусов.
21. Нематициды
Нематициды – это препараты, предназначенные для борьбы с нематодами. В настоящее время в Беларуси имеется один нематицид на основе биологически активных веществ, продуцируемых бактериями Pseudomonas putida U., штамм КМБУ 4308.
Род Pseudomonas относится к группе грамотрицательных аэробных бактерий и имеет большое значение в патологии человека. Род Pseudomonas объединяется в семейство Pseudomonadaceae отдела Gracilicutes. К роду Pseudomonas относятся многочисленные виды бактерий (P. aeruginosa, P. alcaligenes, P. chloraphis, P. fluorescens, P. mendocina, P. monteilii, P. oryzihabitans, P. petrocinogena, P. putida, P. pseudoalcaligenes, P. stutzeri), но патогенными для человека являются только три: P. mallei – возбудитель сапа, P. aeruginosa – вызывает разнообразные гнойно-воспалительные процессы, P. pseudomallei – возбудитель мелиоидоза.
Бактерии рода Pseudomonas широко распространены в природе. Их можно встретить в воздухе, почве, морских и пресных водоемах, сточных водах и иле, нефти и на газовых месторождениях. Псевдомонады были обнаружены на пищевых продуктах, растениях, телах животных, а также в гнойных ранах и экскрементах больных млекопитающих.
Данные микроорганизмы вызывают гнойно-воспалительные процессы в различных тканях и органах при инфицировании ран, инфекции мочевыводящих путей, кожи, раневые инфекции, заболевания глаз, вплоть до развития сепсиса. Часто контаминируются дети, люди пожилого возраста и лица со сниженным иммунным статусом.
Клетки псевдомонад представляют собой мелкие одиночные грам-
отрицательные палочки. Спор и выростов не образуют, подвижны, имеют полярно расположенные жгутики. Число жгутиков у разных видов колеблется.
Большинство бактерий рода Pseudomonas – хемогетеротрофы, т. е. источниками энергии и углерода для них являются органические соединения. Биосинтетические процессы при этом осуществляются за счет обмена окислительного типа, где кислород является конечным акцептором электронов, перенос которых связан с системой цитохромов. Некоторые представители этого рода могут существовать за счет анаэробного нитратного дыхания, другие используют энергию окисления водорода, некоторые синтезируют витамины, антибиотики, токсины.
Бактерии рода Pseudomonas давно привлекают внимание, как продуценты широкого спектра различных биологически активных соединений. Особый интерес вызывают представители так называемой флюоресцирующей группы, способные выделять в среду специфические водорастворимые пигменты – пиовердины (или псевдобактины), выполняющие функцию сидерофоров – связывание ионов железа из окружающей среды, и обеспечивающие их высокоспецифичный транс-порт внутрь бактериальной клетки. Большинство бактерий и грибов, в том числе фитопатогенных, продуцируют собственные сидерофоры, однако в отличие от пиовердинов они менее эффективно связываются с Fe3+-ионами, в результате чего бактерии Pseudomonas выигрывают в конкурентной борьбе за такой жизненно важный элемент, как железо. Таким образом, связывание ионов железа сидерофорами бактерий рода Pseudomonas приводит к ограничению роста фитопатогенов и улучшению роста растений.
Pseudomonas putida – вид аэробных сапротрофных остроконечных по форме бактерий, обитающих в основном в почве. Ризосферные бактерии Pseudomonas putida КМБУ 4308, известные как стимулирующие рост растений и проявляющие антибактериальную, антифунгальную и антинематодную активность, способны продуцировать пиовердин Pm.
Pseudomonas putida отличается крайне разнообразным метаболизмом. Некоторые штаммы Pseudomonas putida используются для преобразования, например, стирола в биоразлагаемые органические соединения. Существуют исследования, показывающие, что штаммы Pseudomonas putida, живущие в природе, могут быть использованы для очистки почв, загрязненных нефтью и продуктами ее переработки. Pseudomonas putida также может разлагать пенополистирол, который считался недоступным для биоразложения. Предпочтительность применения для этих целей Pseudomonas putida перед другими псевдомонадами обусловлена их гораздо меньшей опасностью для человека (в отличие, например, от Pseudomonas aeruginosa (синегнойной палочки) и для окружающей среды (например, фитопатоген Pseudomonas syringae способен заражать разные виды растений, в частности, свеклу, пшеницу, ячмень, фасоль, горох, просо, клен, ясень, олеандр, оливковое дерево, яблони, сирень и др.).
На плантациях, где произрастает табак, в почве обитают штаммы Pseudomonas putida, у которых единственным источником углерода и азота, необходимым для жизнедеятельности этих псевдомонад, является никотин. У этих бактерий был выделен бактериальный фермент NicA2, который может стать основой для разработки препарата, помогающего отказаться от курения. Принцип действия перспективного препарата основан на том, что фермент NicA2 уничтожает никотин до его попадания в мозг. В результате выкуренная сигарета перестанет доставлять удовольствие, поэтому отказаться от вредной привычки будет проще. Фермент NicA2 стабилен при температуре 36,7 °С в течение нескольких недель и уменьшает время полураспада никотина в крови с 2–3 ч до 9–15 мин. При разложении никотина с помощью этого фермента токсичные метаболиты не обнаружены.