Содержание страницы
1. Общая характеристика нетрадиционных невозобновляемых источников энергии
Согласно прогнозам, ожидается, что население Земли к середине XXI века возрастет с нынешних 7 миллиардов человек до 9–10 миллиардов (рис. 1). Оценки показывают, что к этому времени мировое потребление энергии увеличится в несколько раз. Такой рост энергопотребления на планете нужно обеспечить источниками энергетического сырья, и решение этой проблемы следует начинать уже сегодня, так как широкое внедрение новой технологии в производство энергии займет не один десяток лет.
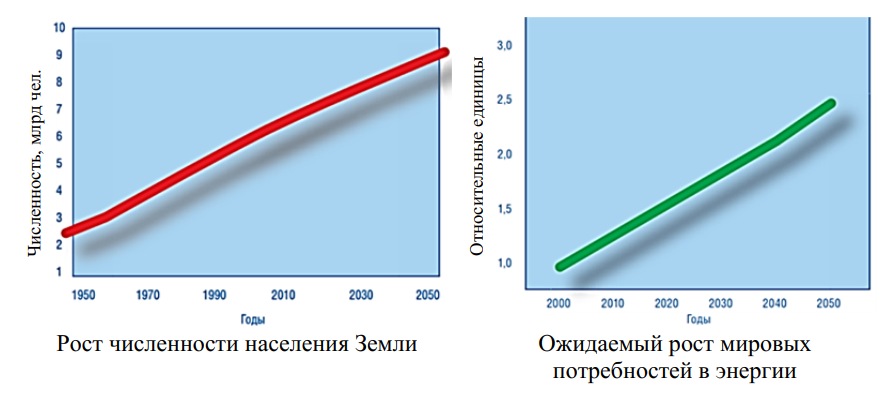
Рис. 1. Прогнозы роста численности населения и мировых потребностей в энергии
Решение проблемы возможно за счет использования новых нетрадиционных источников энергии. Рассматриваются в настоящее время два направления: (нетрадиционные) возобновляемые источники энергии (предыдущие темы) и нетрадиционные невозобновляемые источники энергии.
Возобновляемые источники энергии и их роль в решении энергетических проблем была представлена в предыдущем разделе. К нетрадиционным невозобновляемым источникам энергии можно отнести следующие направления:
- термоядерная энергетика;
- водородная энергетика, использование электрохимических генераторов и энергоустановок на их основе;
- использование магнитогидродинамических (МГД) генераторов.
Эти источники, как следует из названия, относятся к невозобновляемым, так как ресурсы, используемые для их работы, являются исчерпаемыми и требуют восстановления.
2. Термоядерная энергетика
Наиболее перспективное направление в этой области связано с использованием термоядерной энергии. Энергетика на основе ядерных реакций деления тяжелых элементов (урана), как было рассмотрено выше, уже обеспечивает около 20 % выработки электроэнергии в мире, и роль ее будет возрастать.
Одной из основных проблем для ядерной энергетики на основе деления является переработка и захоронение радиоактивных отходов, что сказывается на экономических и экологических показателях этого направления.
Природа подарила человечеству и другую потенциальную возможность – ядерные реакции синтеза (слияния) легких элементов с выделением колоссальной энергии. Реакции синтеза являются источником энергии Солнца, дающего жизнь всему живому на Земле. В недрах Солнца реакции синтеза протекают при температуре около 20 миллионов градусов.
В неуправляемом виде этот процесс был реализован в середине ХХ столетия при взрыве водородной бомбы (рис. 2).
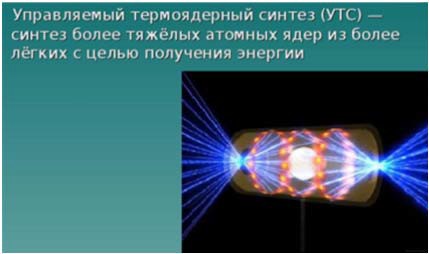

Рис. 2. Термоядерный синтез и общий вид самой крупной водородной (термоядерной) бомбы советского производства (50 мегатонн)
Проблема овладения энергией ядерного синтеза в мирных целях получила название управляемый термоядерный синтез (УТС). Наиболее доступной (осуществимой) является реакция слияния ядер изотопов водорода – дейтерия (D) и трития (Т) (рис. 3). Для энергетически выгодной термоядерной реакции DТ-смесь в лабораторных условиях должна быть нагрета до 100 млн градусов (в 5 раз больше, чем в недрах Солнца).
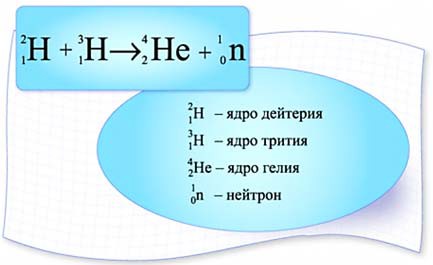

Рис. 3. Реакция слияния ядер изотопов водорода – дейтерия (D) и трития (Т) и общий вид солнечной магмы
При термоядерной реакции DT-газ превращается в полностью ионизированную плазму, состоящую из положительно заряженных ядер и электронов. При такой температуре скорость ядер дейтерия и трития такова, что ее достаточно для преодоления сил кулоновского отталкивания и слияния с образованием нейтрона и ядра гелия (α-частицы) с выделением энергии в 17,6 МэВ на один акт реакции (рис. 4).
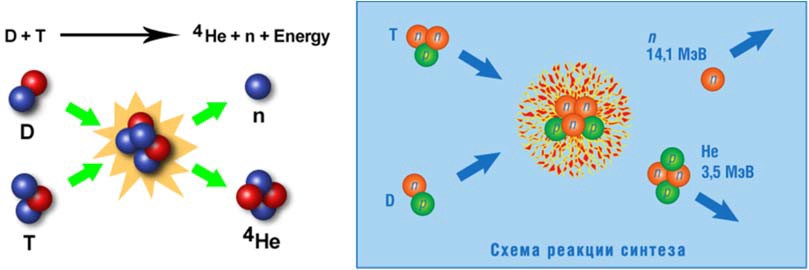
Рис. 4. Энергетические соотношения термоядерного синтеза
Энергия в 17,6 МэВ реализуется в виде кинетической энергии нейтрона (80 %) и α-частицы (20 %). Нейтрон, покидая плазму, попадает в теплоноситель, окружающий плазму, и его кинетическая энергия переходит в тепловую, а энергия ядер атома гелия (α-частицы) может быть использована для поддержания температуры плазмы в требуемом диапазоне.
Дейтерий содержится в обычной воде и технология его получения из воды хорошо отработана. Тритий практически отсутствует на Земле, но его можно получить, если нейтрон взаимодействует с литием (Li), введенным в состав теплоносителя бланкета (специальной оболочки, окружающей плазму). Таким образом, топливом для термоядерного реактора являются дейтерий и литий.
Основная проблема термоядерного синтеза заключается в создании устройства, которое будет способно поддерживать невероятно высокую температуру, требующуюся для протекания процесса (около сотни миллионов градусов Цельсия).
Подсказку к созданию установки термоядерного синтеза (УТС) дало Солнце. Существует такое явление, как протуберанцы – струи раскаленной плазмы, которые вырываются из солнечной короны наружу и удерживаются некоторое время магнитным полем. Возникла идея организовать аналогичный процесс на Земле, т. е. создать аппараты, в которых плазма оказалась бы заключенной в магнитную ловушку, в которой используется эффект движения заряженных частиц плазмы вдоль линий магнитного поля – по спирали, что позволяет избежать контакта высокотемпературной плазмы со стенками реактора (рис. 5).
После того, как термоядерная реакция запустится, плазма сможет подогревать себя сама: образующиеся при термоядерном синтезе ядра гелия обладают очень высокой скоростью, и, сталкиваясь с ядрами дейтерия и трития, они передают им свою энергию – этого оказывается достаточно для поддержания необходимой температуры (рис. 6).
Заслуга создания аппарата, в котором впервые удалось получить плазму с нужными параметрами, принадлежит советским ученым А. Д. Сахарову и И. Е. Тамму (ранее занимавшимся разработкой отечественной термоядерной бомбы). Этот аппарат получил название ТОКАМАК – ТОроидальная КАмера с МАгнитными Катушками.
Плазма в нем удерживается в кольцевой вакуумной камере в форме тора (рис. 7).
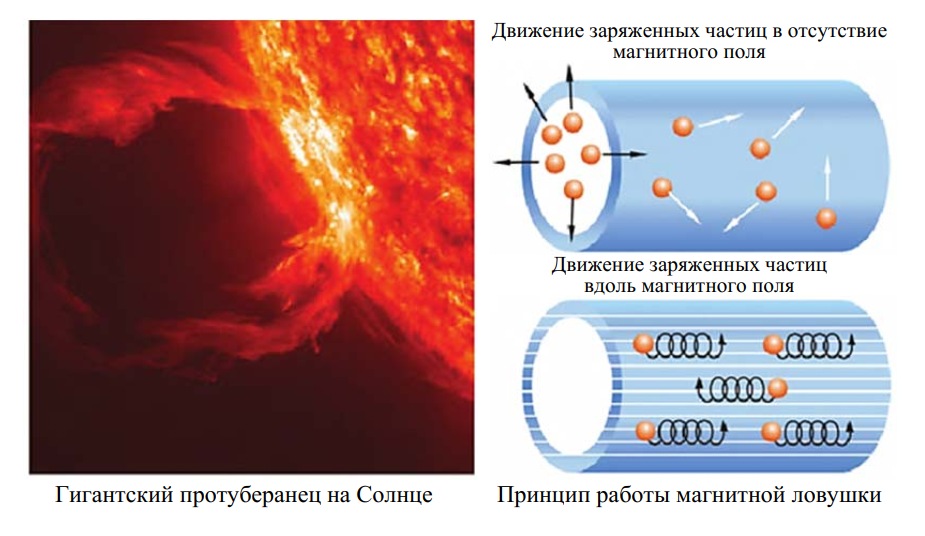
Рис. 5. Принцип работы магнитной ловушки
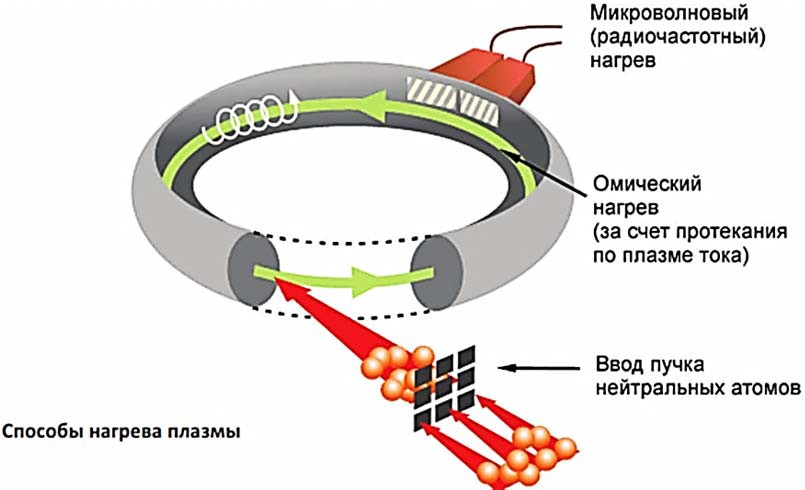
Рис. 6. Схема практической реализации магнитной ловушки
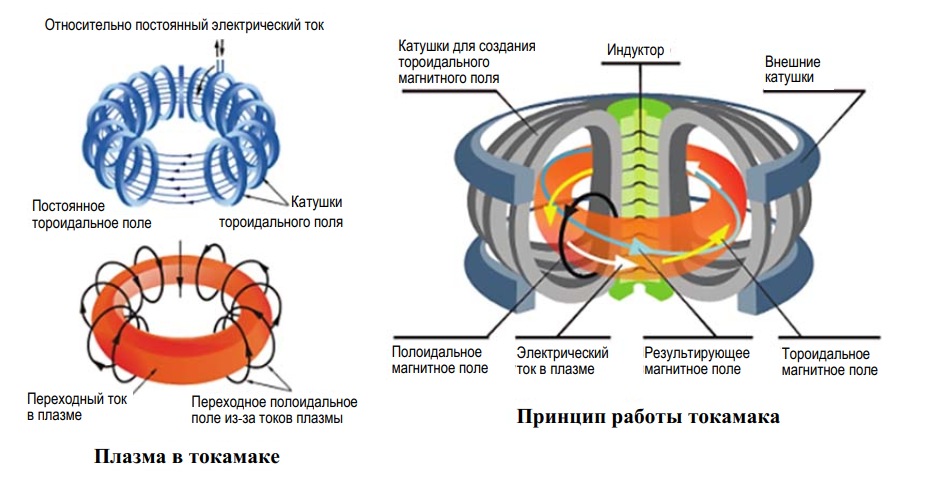
Рис. 7. Принцип работы установки термоядерного синтеза ТОКОМАК
Первый ТОКАМАК был запущен в Советском Союзе в 1955 году, а в 1968 году на аппарате Т-3 под руководством академика Л. А. Арцимовича плазму удалось разогреть до десяти миллионов градусов – температуры термоядерного синтеза (рис. 8).



а б в
Рис. 8. Общий вид установок, реализующих термоядерный синтез: а – современный токамак Т-15 в «Курчатовском институте», Москва; б – установка Токамак-3; в – камера крупнейшего в мире действующего токамака JET, Англия
Представленные выше разработки являются экспериментальными. Стоит вопрос, когда даст ток первая термоядерная электростанция (рис. 9). На него имеется ответ. Как видно из рис. 10 завершение строительства экспериментального термоядерного реактора на основе ТОКАМАК в рамках международного проекта ITER
(Франция, Япония, Россия, США) намечено на 2019 год. Лишь в 2026 году планируется впервые запустить термоядерный синтез. При условии успешного окончания исследовательской работы реактор даст первый ток в 2037 году.
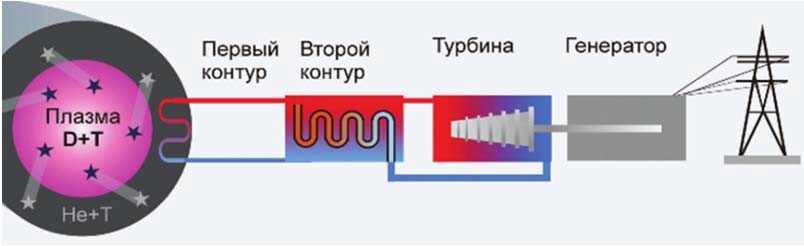
Рис. 9. Схема электростанции на основе термоядерного синтеза
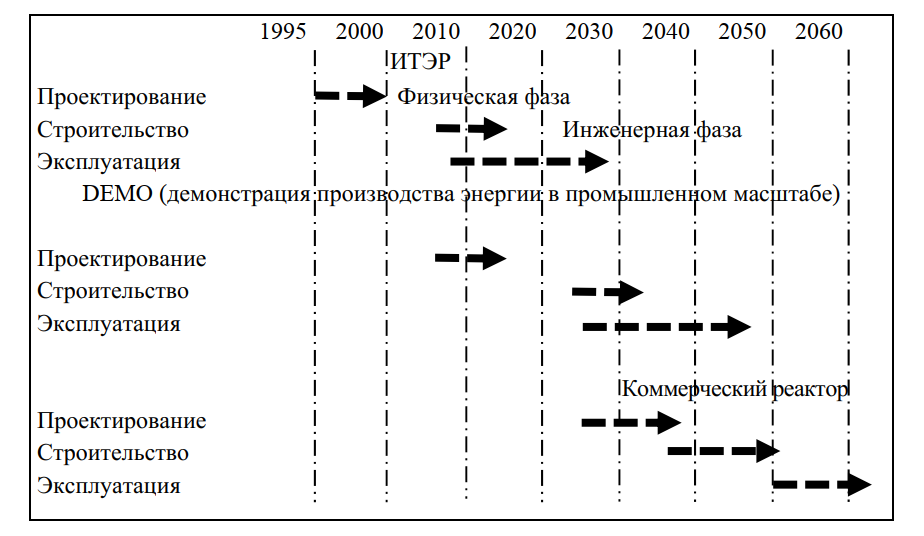
Рис. 10. План ввода в эксплуатацию электростанции на основе термоядерного синтеза в рамках международного проекта ITER
В перспективе термоядерные реакторы не будут работать на дейтерий-тритиевой смеси. Чтобы избавиться от нейтронов, активирующих и снижающих прочность стенки реактора, тритий заменят на гелий-3. Но существуют две проблемы:
- реакция с гелием-3 потребует достичь миллиардных температур в плазме;
- трудность получения гелия-3, который слишком рассеян.
Поэтому на сегодняшний день гелий-3 добывают из земной атмосферы в очень небольших количествах, всего по нескольку десятков граммов в год. Существует альтернатива, на Луне можно добыть до 500 тысяч тонн изотопа (в атмосфере Земли – всего лишь около 35 тысяч тонн).
3. Водородная энергетика. Электрохимические генераторы (ЭХГ) и энергоустановки (ЭЭУ)
Крупномасштабная концепция водородной энергетики как одного из направлений научно-технического прогресса сформировалась в середине 70-х годов прошлого столетия в разгар охватившего мир энергетического кризиса. Главная идея этого направления – замена ископаемых органических видов топлива во всех сферах их применения на новый энергоноситель – водород, при сжигании которого образуется только вода и практически отсутствуют какие-либо вредные выбросы (рис. 11).
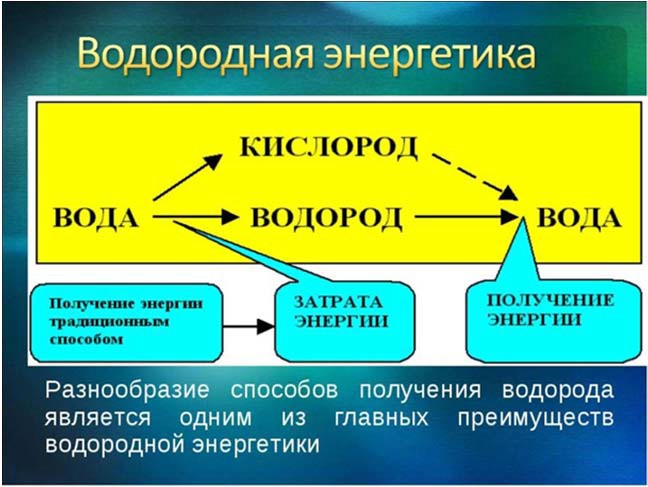
Рис. 11. Особенности водородной энергетики
В качестве других преимуществ водорода как топлива можно назвать:
- неисчерпаемость;
- массовая теплотворная способность водорода в 2,8 раза выше по сравнению с бензином;
- температура воспламенения в 15 раз меньше, чем для углеводородного топлива;
- максимальная скорость распространения фронта пламени в 8 раз больше по сравнению с углеводородами;
- излучение пламени в 10 раз меньше по сравнению с пламенем углеводородов;
- экологичность.
Водородная энергетика включает следующие технологические циклы:
- производство водорода;
- его хранение;
- транспортирование и распределение;
- использование.
В настоящее время применяются следующие способы производства водорода:
- электролиз (разложение воды);
- риформинг (паровая конверсия метана);
- газификация – разложение тяжелых углеводородов и биомассы на водород и газы для последующего риформинга;
- термохимические циклы, использующие дешевое высокотемпературное тепло ядерных реакторов или концентрированной солнечной энергии;
- биологическое производство: при некоторых условиях водоросли и бактерии вырабатывают водород.
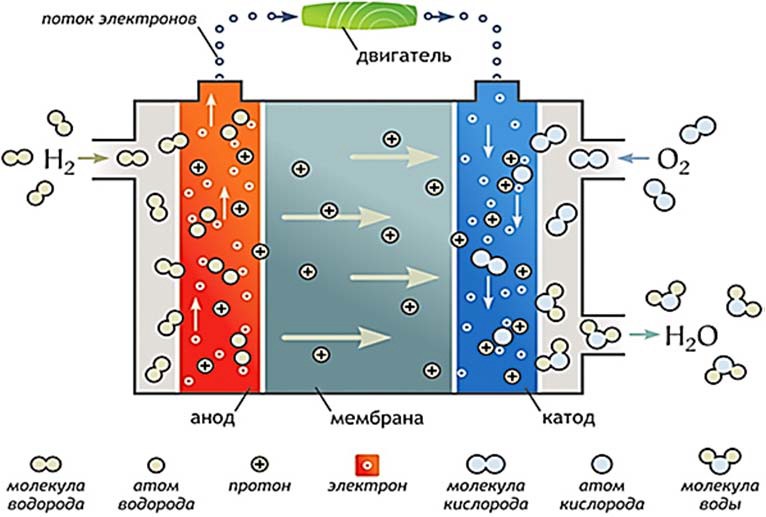
Электролиз – это разложение воды на молекулярный водород и кислород при прохождении через нее электрического тока (рис. 12). Обеспечивает получение водорода высокой степени чистоты. Однако процесс связан с большими затратами электроэнергии.
Перспективным является использование для электролиза избытков возобновляемой электрической энергии (солнечной, ветро-, гидроэнергии) (см. рис. 204).
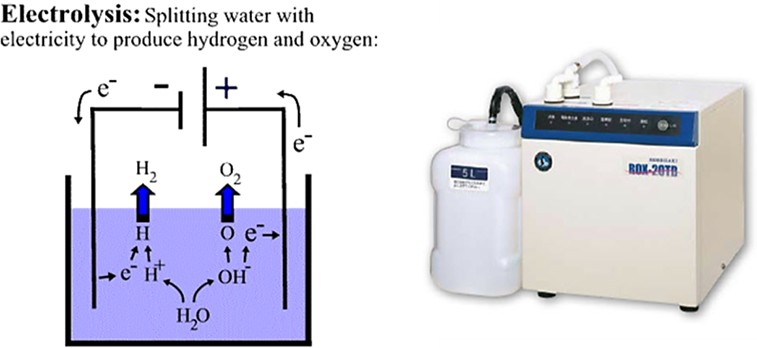
Рис. 12. Схема электролиза и общий вид электролизера
Паровая конверсия – это процесс получения чистого водорода из легких углеводородов (например, метана, пропан-бутановой фракции) путем парового риформинга (каталитической конверсии углеводородов в присутствии водяного пара) (рис. 13).
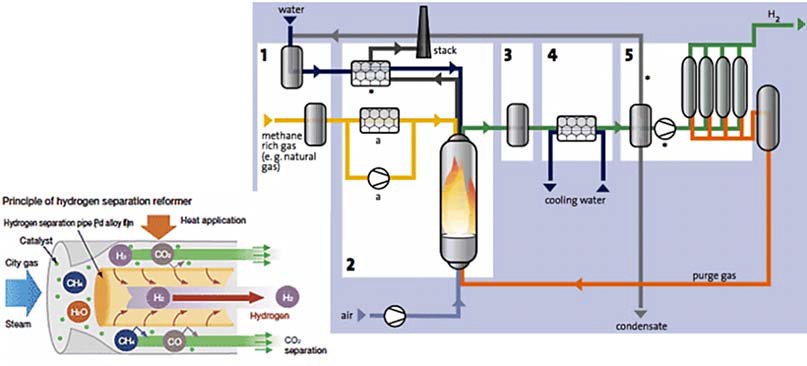
Рис. 13. Схема получения водорода методом паровой конверсии: stack – дымовая труба; purge gas – продувочный газ
На сегодняшний день является самым дешевым способом получения водорода. Недостатки: конечный продукт содержит примеси; требуется газоочистка для некоторых приложений; выбросы двуокиси углерода; дополнительные затраты на секвестрацию двуокиси углерода.
Этот процесс хорошо отработан и широко применяется в настоящее время в промышленности (рис. 14).


Рис. 14. Общий вид промышленных установок для реформинга водорода
Термохимическая газификация. Как было рассмотрено в разделе «Биоэнергетика» термохимическая газификация представляет собой процесс частичного окисления углеродсодержащего сырья, такого, как биомасса, торф или уголь с получением газообразного энергоносителя – генераторного газа (рис. 15). Полученный газ состоит из монооксида углерода, метана, диоксида углерода, водорода и других газов. Получаемый таким способом водород требует интенсивной очистки перед использованием.
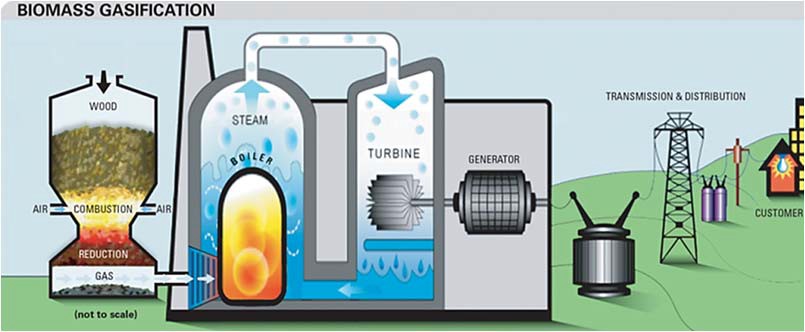
Рис. 15. Получение водорода методом термохимической газификации
Термохимические и термоэлектрохимические циклы. Для прямого термического разложения воды на водород и кислород требуется высокая температура на уровне 2500 °С (рис. 16). Такую высокую температуру можно получить, например, с помощью концентраторов солнечной энергии, ядерных реакторов. Однако воду можно термически разложить и при более низкой температуре, используя последовательность химических реакций, которые выполняют следующие функции: связывание воды, отщепление водорода и кислорода, регенерация реагентов.
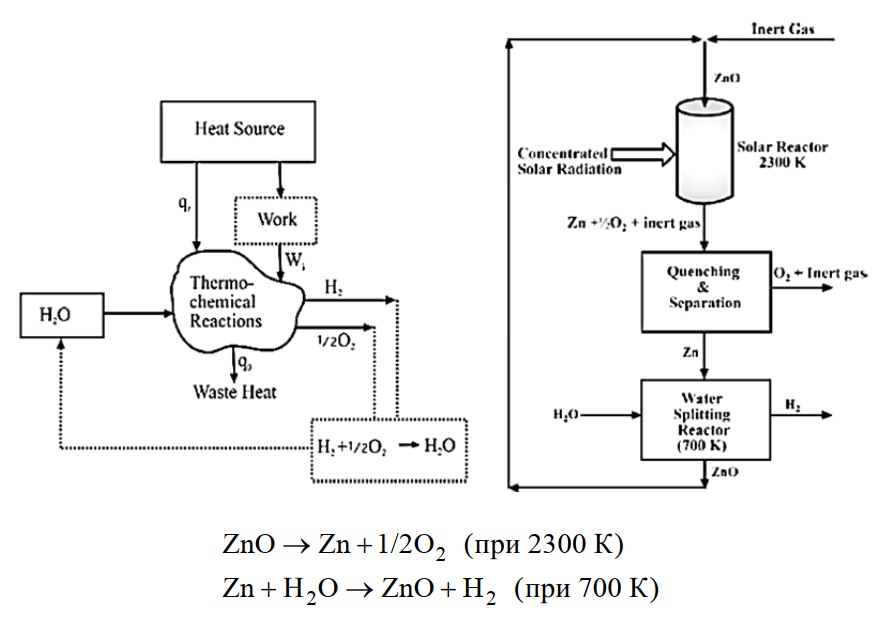
Рис. 16. Получение водорода термохимическими циклами
Для получения водорода можно применить метод и многостадийных термохимических циклов, например, Сера – Йодных (рис. 17). Эффективность процесса – 42–56 %. Однако он сложен в реализации, еще не имеет коммерческого значения, требуются долговременные исследования материалов, усовершенствование химической технологии; необходим высокотемпературный ядерный реактор (ВТЯР) или солнечные концентраторы.
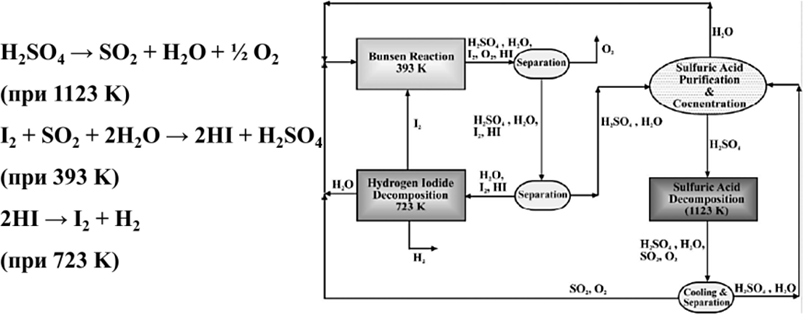
Рис. 17. Схема получения водорода с применением многостадийных термохимических циклов (Сера – Йодных циклов)
Биологическое способы производства водорода из водорослей. Некоторые образцы теплолюбивых сине-зеленых водорослей в присутствии платинового катализатора начинают бурную реакцию выделения водорода при температурах выше 55 °C, то есть при температуре типичной для безводных пустынь с высокой насыщенностью солнечной энергией, при этом производительность процесса может возрасти на порядок по мере увеличения температуры. В результате можно добиться выхода водорода, эквивалентного производству порядка 75 литров бензина с квадратного метра ежедневно (рис. 18). Технология потенциально имеет большой ресурс. Однако характеризуется малой скоростью накопления водорода; нужны большие площади; наиболее подходящие объекты (виды водорослей) еще не найдены.
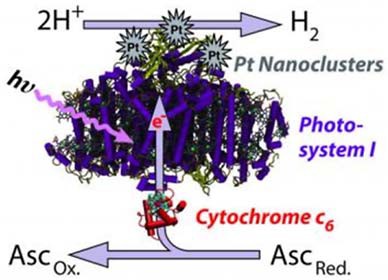
Рис. 18. Схема и общий вид установки для производства водорода из водорослей
Хранение и транспортирование водорода. Низкая плотность газообразного водорода, высокая взрывоопасность в сочетании с негативным воздействием на свойства конструкционных материалов, ставят на первый план проблемы разработки эффективных и безопасных систем хранения водорода – именно эти проблемы сдерживают развитие водородной энергетики и технологии в настоящее время.
Методы хранения водородного топлива можно разделить на три группы (рис. 19):
- использование естественных подземных хранилищ;
- физические методы, которые используют физические процессы (главным образом, компрессирование или сжижение) для переведения газообразного водорода в компактное состояние;
- химические методы (хранение водорода обеспечивается физическими или химическими процессами его взаимодействия с некоторыми материалами).

Рис. 19. Способы хранения водорода
Наиболее простой способ – это закачка водорода в глубокие подземные выработки (угольные и другие виды шахт, естественные подземные пустые полости и т. п.) (рис. 20). Технология требует постоянного контроля утечек газа.
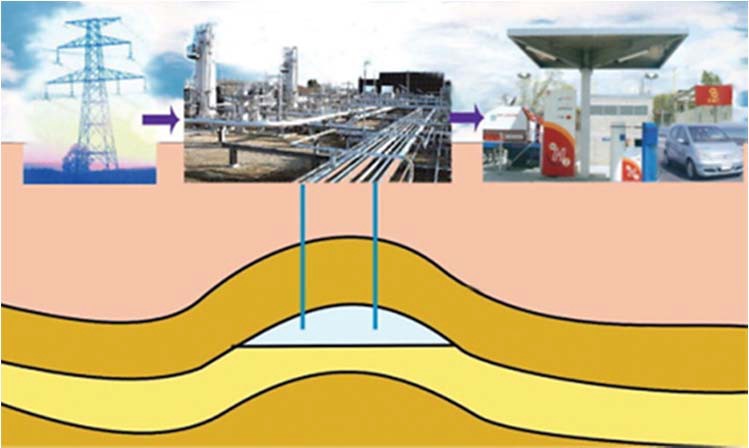
Рис. 20. Закачка водорода в подземные хранилища
Физические методы: водород, хранимый с помощью физических методов, состоит из молекул Н2, слабо взаимодействующих со средой хранения.
На сегодня реализованы следующие физические методы хранения водорода (рис. 21):
- сжатый газообразный водород;
- газовые баллоны;
- стационарные массивные системы хранения, включая подземные резервуары;
- хранение в трубопроводах;
- стеклянные микросферы.
Для хранения жидкого водорода применяются стационарные и транспортные криогенные контейнеры и емкости (рис. 22).


Рис. 21. Физические способы хранения водорода

Рис. 22. Стационарные и транспортные криогенные контейнеры и емкости для хранения жидкого водорода
Хранение и транспортирование водорода в химически связанном состоянии. Применяемые методы:
Адсорбционные.
- цеолиты и родственные соединения;
- активированный уголь;
- углеводородные наноматериалы;
- абсорбция в объеме материала (металлогидриды).
Химическое взаимодействие.
- фуллерены и органические гидриды;
- аммиак;
- губчатое железо;
- водореагирующие сплавы на основе алюминия и кремния.
Преимущества хранения и транспортирование водорода в форме аммиака, метанола, этанола на дальние расстояния состоят в высокой плотности объемного содержания водорода. Однако в этих формах хранения водорода среда хранения используется однократно (температура сжижения аммиака 239,76 К, критическая температура 405 К). Так при нормальной температуре аммиак сжижается при давлении 1,0 МПа и его можно транспортировать по трубам и хранить в жидком виде.
Использование водорода. В настоящее время известны следующие применения водорода в энергетических целях:
- прямое сжигание водорода в энергетических установках;
- использование топливных элементов;
- использование водорода в двигателях внутреннего сгорания.
Прямое сжигание водорода в энергетических установках осуществляется редко ввиду его взрывоопасности. Более перспективным является применение топливных элементов. Во всем мире установлено более 900 стационарных энергетических установок на топливных элементах мощностью более 10 кВт. Их суммарная мощность около 150 МВт. Для повышения эффективности, снижения себестоимости энергии и для утилизации тепловой энергии применяются установки, совмещающие топливные элементы и газовые турбины (рис. 23).


Рис. 23. Общий вид газовой турбины для утилизации водорода и подводная лодка класса U212 (Германия) с силовой установкой на водородных топливных элементах
Водородный транспорт – это различные транспортные средства, использующие в качестве топлива водород. Это могут быть транспортные средства как с двигателями внутреннего сгорания, с газотурбинными двигателями, так и с водородными топливными элементами. Наиболее широкое применение находят автомобили на топливных элементах (рис. 24).
Примером таких разработок является биотопливный автомобиль корпорации BMW Hydrogen 7. Двигатель внутреннего сгорания автомобиля может работать на бензине или водороде. На Hydrogen 7 установлен бензобак 74 литра и баллон для хранения 8 кг водорода. Автомобиль может проехать 200−300 км на водороде и 480 км на бензине. Переключение с одного вида топлива на другой происходит автоматически, но предпочтение отдается водороду. Водород хранится в жидкой форме при температуре не выше –253 °C. Бак для хранения водорода двухслойный. Между слоями в вакууме расположены 70 слоев специальной пены.

Рис. 24. Схематичное изображение и общий вид автомобиля на топливных элементах
В настоящее время автомобили с силовыми установками на водородных топливных элементах выпускаются следующими фирмами:
- Ford Motor Company – Focus FCV;
- Honda – Honda FCX;
- Hyundai – Tucson FCEV (топливные элементы компании UTC Power);
- Nissan – X-TRAIL FCV (топливные элементы компании UTC Power);
- Toyota – Toyota Highlander FCHV;
- Volkswagen – space up!;
- General Motors;
- Daimler AG – Mercedes-Benz A-Class;
- Daimler AG – Mercedes-Benz Citaro (топливные элементы компании Ballard Power Systems);
- Toyota – FCHV-BUS;
- Thor Industries – (топливные элементы компании UTC Power);
- Irisbus – (топливные элементы компании UTC Power) и другие единичные экземпляры в Бразилии, Китае, Чехии и т. д.
Проблема расширения использования водородного транспорта – создание инфраструктуры заправочных станций. В настоящее время они располагаются в основном возле мест производства и транспортирования водорода. Вторая проблема – высокие требования к прочности материалов емкостей и трубопроводов (водородная хрупкость) (рис. 25).

Рис. 25. Использования водорода
Электрохимические генераторы. Напряжение, возникающее на отдельном топливном элементе (ТЭ), не превышает 1,1 вольта. Для получения необходимой величины напряжения ТЭ соединяются последовательно в батареи, а для получения необходимой мощности батареи ТЭ соединяются параллельно. Такие батареи ТЭ вместе с элементами газораспределения и терморегулирования монтируются в единый конструктивный блок, называемый электрохимическим генератором (ЭХГ) (рис. 26).


Рис. 26. Общий вид электрохимических генераторов для использования водорода
Электрохимические энергоустановки (ЭЭУ) объединяют электрохимические генераторы с системами подготовки, подачи топлива и использования энергии. Они имеют более высокий КПД (в 15–20 раз выше по сравнению с тепловыми машинами, мощность до 11 МВт) (рис. 27).

Рис. 27. Общий вид электрохимических энергоустановок
Как видно из рис. 28 топливные элементы, электрохимические генераторы и энергетические установки на их основе находят широкое применение во многих отраслях экономики. Это объясняется эффективностью преобразования энергии в этих уникальных энергетических устройствах (рис. 29).
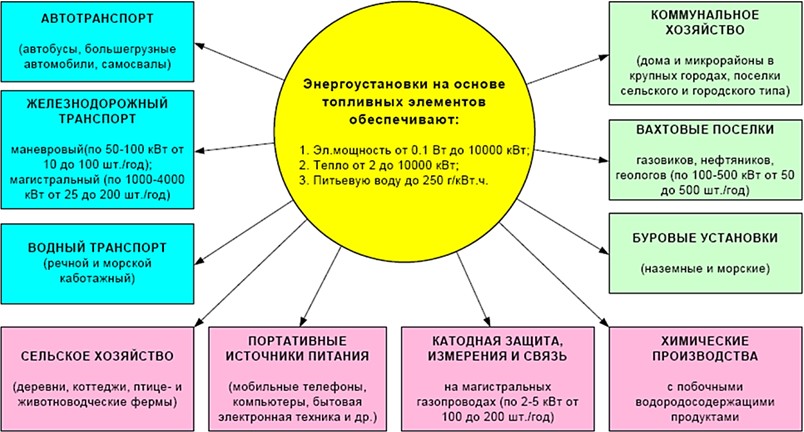
Рис. 28. Области применения энергоустановок на основе топливных элементов
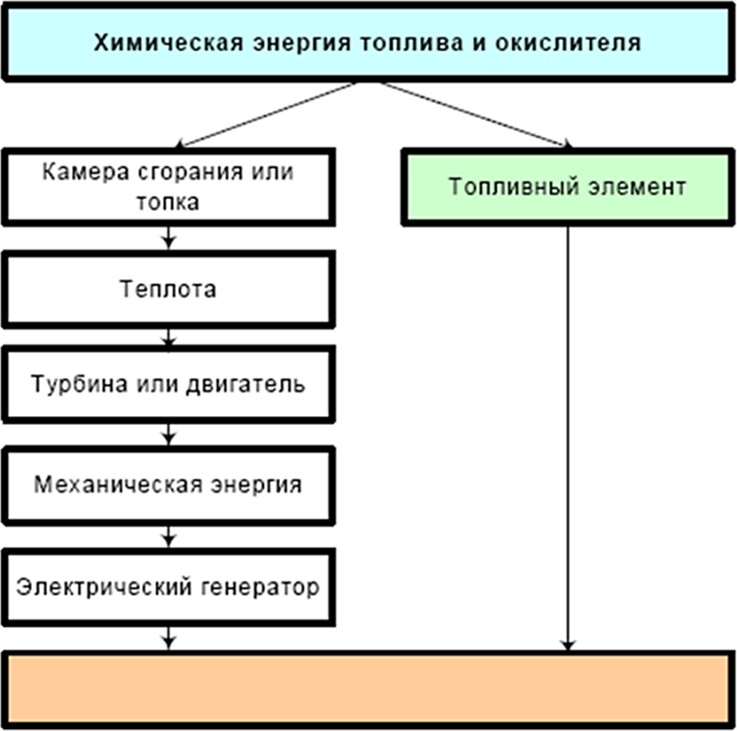
Рис. 39. Преобразование химической энергии в электрическую традиционным и электрохимическим способами