Содержание страницы
- 1. Классификация чужеродных веществ и пути их поступления в продукты
- 2. Окружающая среда — основной источник загрязнения сырья и пищевых продуктов
- 3. Природные токсиканты
- 4. Антиалиментарные факторы питания
- 5. Метаболизм чужеродных соединений
- 6. Генетически модифицированные организмы. Критерии безопасности
С продуктами питания в организм человека могут поступать значительные количества веществ, опасных для его здоровья. Поэтому остро стоят проблемы, связанные с повышением ответственности за эффективность и объективность контроля качества пищевых продуктов, гарантирующих их безопасность для здоровья потребителя.
Проблема безопасности продуктов питания — сложная комплексная проблема, требующая многочисленных усилий для ее решения как со стороны ученых — биохимиков, микробиологов, токсикологов и других, так и со стороны производителей, санитарно-эпидемиологических служб, государственных органов и, наконец, потребителей.
Актуальность проблемы безопасности продуктов питания с каждым годом возрастает, поскольку именно обеспечение безопасности продовольственного сырья и продуктов питания является одним из основных факторов, определяющих здоровье людей и сохранение генофонда.
Под безопасностью продуктов питания следует понимать отсутствие опасности для здоровья человека при их употреблении как с точки зрения острого негативного воздействия (пищевые отравления и пищевые инфекции), так и с точки зрения опасности отдаленных последствий (канцерогенное, мутагенное и тератогенное действие). Иными словами, безопасными можно считать продукты питания, не оказывающие вредного, неблагоприятного воздействия на здоровье настоящего и будущих поколений.
В начале 1970-х гг. была разработана Концепция критической контрольной точки при анализе опасного фактора (ККТАОФ), которая призвана обеспечить безопасность пищевых продуктов. Главные принципы, лежащие в сути этой Концепции, свидетельствуют о том, что основной акцент должен быть сделан на предупредительный контроль «критических моментов» в производстве продовольствия, а не на проверку готовой продукции. Согласно Концепции ответственность за определение критических точек в технологии производства безопасных пищевых продуктов возлагается на производителей. С другой стороны, она дает производителям пищевых продуктов возможность повысить эффективность контроля и тем самым обеспечить должную безопасность продуктов питания.
Выявление ККТАОФ складывается из двух основных операций.
Операция 1. Выявление опасных факторов и определение контрольных мер. При этом необходимо изучить следующие важные обстоятельства:
- состав используемого сырья и компонентов, а также параметры, которые могут оказывать влияние на безопасность и стойкость продукта;
- параметры и условия процесса производства, влияющие на опасные факторы или их создающие;
- защита от повторного загрязнения химическими веществами и микроорганизмами (целостность, проницаемость и безопасность упаковки);
- использование в потребительской практике (размораживание, подогревание, варка и т. п.);
- группы риска (система общественного питания, дети, пожилые люди, лица с нарушением иммунной системы, другие категории больных).
Операция 2. Установление критических контрольных точек.
При этом необходимо для каждого опасного фактора на каждой стадии ответить на следующие вопросы:
- Может ли изучаемый опасный фактор появиться в продукте из сырья или при его переработке и на каком уровне (допустимом или недопустимом)?
- Имеет ли состав сырья или рецептура продукта решающее значение для безопасности продукта?
- Обеспечивает ли технологический процесс безопасность готового продукта за счет снижения уровня опасного фактора или за счет предотвращения его возрастания до опасного уровня?
Кроме названных двух основных операций, ККТАОФ включает также спецификацию, систему мониторинга, системы устранения недостатков и проверки.
Концепция ККТАОФ за последние 15–20 лет постоянно уточнялась и недавно Комиссия Codex Alimentarius опубликовала документ «Система анализа опасного фактора и контрольной критической точки и руководство для ее применения». Очевидно, что этот новейший документ будет рассматриваться как стандарт, и остается надеяться, что внедрение данного подхода позволит получать более точную, полную и объективную картину, что, в свою очередь, обеспечит должный контроль качества пищевых продуктов.
1. Классификация чужеродных веществ и пути их поступления в продукты
Чужеродные химические вещества (ЧХВ) могут попадать в пищу случайно в виде контаминантов-загрязнителей, например из окружающей среды или в процессе технологической обработки при контакте с оборудованием; иногда их вводят специально в виде пищевых добавок, когда это связано с технологической необходимостью. Кроме того, в пищевом сырье и готовых продуктах питания могут содержаться природные компоненты, оказывающие вредное влияние на здоровье человека.
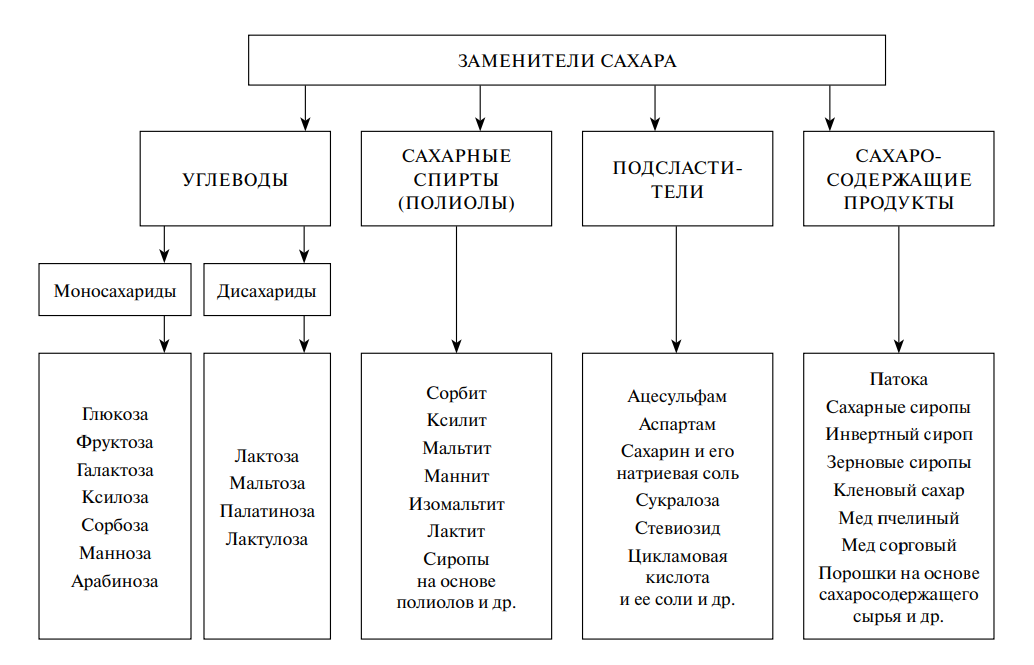
В целом, классификация вредных и посторонних веществ в сырье, питьевой воде и продуктах питания может быть представлена в виде схемы (рис. 1).
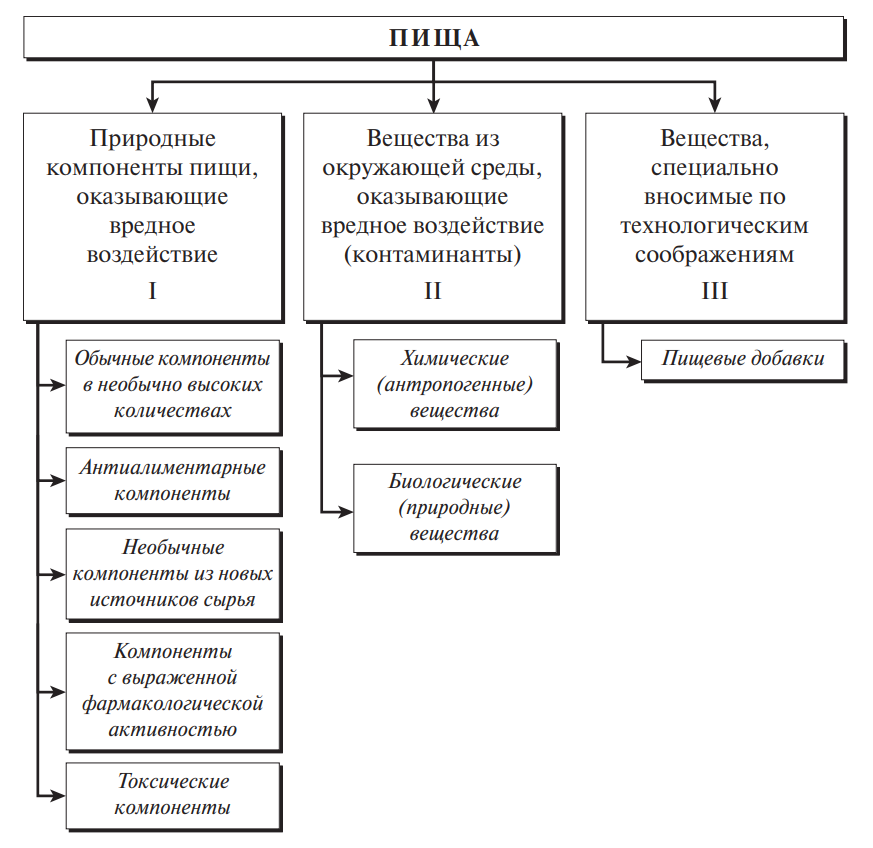
Рис. 1. Классификация посторонних и вредных веществ пищи
Несмотря на то что окружающая среда остается главным источником загрязнения сырья и пищевых продуктов, в настоящее время появляются новые и модифицируются традиционные технологии получения продуктов питания, которые часто связаны с применением жестких видов воздействия на сырье и полупродукты, что, в свою очередь, является не всегда оправданным и приводит к возникновению токсичных веществ. Кроме того, получили широкое распространение разнообразные виды непроверенных пищевых добавок и новых упаковочных материалов; появилось большое число малых предприятий, технологический процесс и качество выпускаемых продуктов питания на которых плохо контролируются или вообще не контролируются. Нельзя забывать и об антиалиментарных факторах питания, содержащихся в сырье и готовых пищевых продуктах и способных оказывать неблагоприятное воздействие на организм человека.
2. Окружающая среда — основной источник загрязнения сырья и пищевых продуктов
Загрязнение продовольственного сырья и пищевых продуктов чужеродными веществами, или ксенобиотиками, напрямую зависит от степени загрязнения окружающей среды.
В результате хозяйственной деятельности человека в биосфере циркулирует огромное количество различных ксенобиотиков как неорганической, так и органической природы, обладающих исключительной токсичностью. Антропогенная токсикация приобрела настолько значительные масштабы, что наносит ощутимый, реальный вред здоровью человека и грозит перерасти в экологическую катастрофу.
Ксенобиотики, попадая в окружающую среду в результате антропогенной деятельности человека, способны накапливаться в почвах, водоемах, с атмосферными и водными потоками распространяться на тысячи километров. Передвигаясь по пищевым цепям, ксенобиотики попадают в организм человека и вызывают серьезные нарушения здоровья — от острых отравлений с летальным исходом до заболеваний, проявляющихся порой только через многие годы (рис. 2).
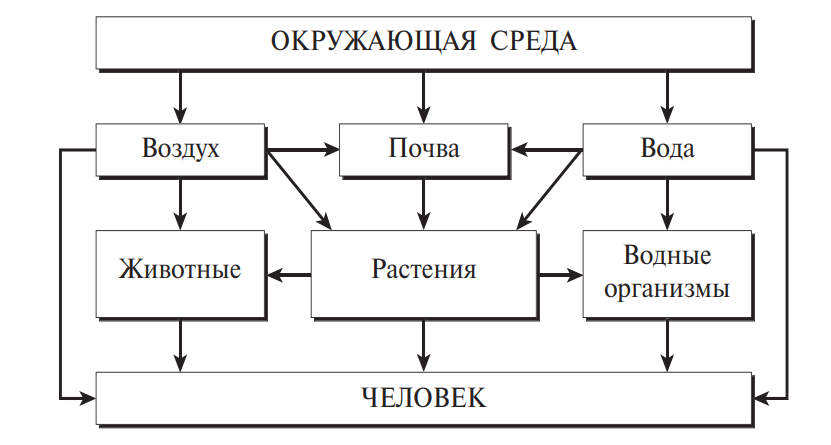
Рис. 2. Схема поступления ксенобиотиков из окружающей среды в организм человека по пищевым цепям
2.1. Меры токсичности веществ
Количественная характеристика токсичности веществ достаточно сложна и требует многостороннего подхода. Судить о ней приходится по результатам воздействия вещества на живой организм, для которого характерна индивидуальная реакция, индивидуальная вариабельность, поскольку в группе испытуемых животных всегда присутствуют более или менее восприимчивые к действию изучаемого токсина индивидуумы.
Существуют две основные характеристики токсичности — ЛД50 и ЛД100. ЛД — аббревиатура летальной дозы, то есть дозы, вызывающей при однократном введении гибель 50 или 100 % экспериментальных животных.
Дозу обычно определяют в размерности концентрации. Токсичными считают все те вещества, для которых ЛД мала. Принята следующая классификация веществ по признаку острой токсичности (ЛД50 для крысы при пероральном введении, в мг/кг):
- Чрезвычайно токсичные — 5
- Высокотоксичные 5–50
- Умеренно токсичные 50–500
- Малотоксичные 500–5000
- Практически нетоксичные 5000–15000
- Практически безвредные > 15 000
Величина t0,5 характеризует время полувыведения токсина и продуктов его превращения из организма. Для разных токсинов оно может составлять от нескольких часов до нескольких десятков лет.
Кроме ЛД50, ЛД100 и t0,5 в токсикологических экспериментах на животных принято указывать еще и время 100 или 50 % гибели объектов. Но для этого такие эксперименты должны проводиться в течение многих месяцев и лет, а при существующем непродолжительном контроле можно отнести к малотоксичным веществам высокотоксичные, но проявляющие свое негативное, губительное действие лишь через длительное время.
Кроме этого, необходимо учитывать еще ряд факторов. Это и индивидуальность различных экспериментальных животных, и различное распределение токсинов в органах и тканях, и биотрансформация токсинов, которая затрудняет их определение в организме.
При хронической интоксикации решающее значение приобретает способность вещества проявлять кумулятивные свойства, то есть накапливаться в организме и передаваться по пищевым цепям. Необходимо также учитывать комбинированное действие нескольких чужеродных веществ при одновременном и последовательном поступлении в организм и их взаимодействие с макро- и микронутриентами пищевых продуктов (так как человек может получать в течение всей жизни вместе с пищей целый комплекс чужеродных веществ либо в виде контаминантов-загрязнителей, либо в виде добавок к пищевым продуктам).
Комбинированный эффект является результатом физических или химических взаимодействий, индукции или ингибирования ферментных систем, других биологических процессов. Действие одного вещества может быть усилено или ослаблено под влиянием других веществ. Различают два основных эффекта: антагонизм — эффект воздействия двух или нескольких веществ, при котором одно вещество ослабляет действие другого вещества (например, действие ртути и селена в организме животных и человека); синергизм — эффект воздействия, превышающий сумму эффектов воздействия каждого фактора (например, комбинированное воздействие хлорсодержащих соединений, фосфорорганических пестицидов, комбинированное воздействие ксенобиотиков и некоторых медикаментов).
В связи с хроническим воздействием посторонних веществ на организм человека и возникающей опасностью отдаленных последствий важнейшее значение приобретают канцерогенные (возникновение раковых опухолей), мутагенные (качественные и количественные изменения в генетическом аппарате клетки) и тератогенные (аномалии в развитии плода, вызванные структурными, функциональными и биохимическими изменениями в организме матери и плода) действия ксенобиотиков.
На основе токсикологических критериев (с точки зрения гигиены питания) международными организациями ООН — ВОЗ, ФАО и другими, а также органами здравоохранения отдельных государств приняты базисные (основные) показатели: ПДК, ДСД и ДСП.
ПДК (предельно допустимая концентрация) — предельно допустимые количества чужеродных веществ в атмосфере, воде, продуктах питания с точки зрения безопасности их для здоровья человека. ПДК в продуктах питания — установленное законом предельно допустимое с точки зрения здоровья человека количество вредного (чужеродного) вещества. ПДК — это такие концентрации, которые при ежедневном воздействии в течение сколь угодно длительного времени не могут вызывать заболеваний или отклонений в состоянии здоровья, обнаруживаемых современными методами исследований, в жизни настоящего и последующих поколений.
ДСД (допустимая суточная доза) — ежедневное поступление вещества, которое не оказывает негативного влияния на здоровье человека в течение всей его жизни.
ДСП (допустимое суточное потребление) — величина, рассчитываемая как произведение ДСД на среднюю величину массы тела (60 кг).
2.2. Токсичные элементы
Токсичные элементы (в частности, некоторые тяжелые металлы) составляют обширную и весьма опасную в токсикологическом отношении группу веществ. Обычно рассматривают 14 элементов: Hg, Pb, Cd, As, Sb, Sn, Zn, Al, Be, Fe, Cu, Ba, Cr, Tl. Разумеется, не все перечисленные элементы являются ядовитыми, некоторые из них необходимы для нормальной жизнедеятельности человека и животных. Поэтому часто трудно провести четкую границу между биологически необходимыми и вредными для здоровья человека веществами.
В большинстве случаев реализация того или иного эффекта зависит от концентрации. При повышении оптимальной физиологической концентрации элемента в организме может наступить интоксикация, а дефицит многих элементов в пище и воде может привести к достаточно тяжелым и трудно распознаваемым явлениям недостаточности.
Зависимость вредного или полезного действия некоторых элементов от их концентрации показана на рис. 3.
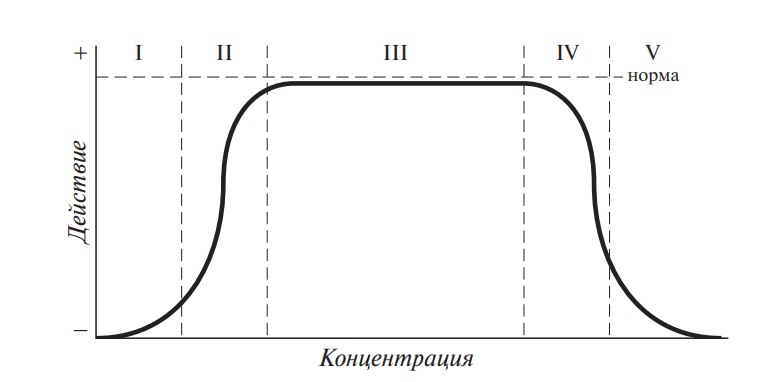
Рис. 3. Зависимость влияния концентрации некоторых элементов на организм человека: I — угрожающее действие; II — дефицитное действие; III — физиологическое действие; IV — токсичное действие; V — летальное действие
Для веществ, относящихся к так называемым супертоксикантам, плато, характеризующее норму, отсутствует (или очень короткое), а крутизна нисходящей ветви характеризует токсичность вещества (рис. 4).
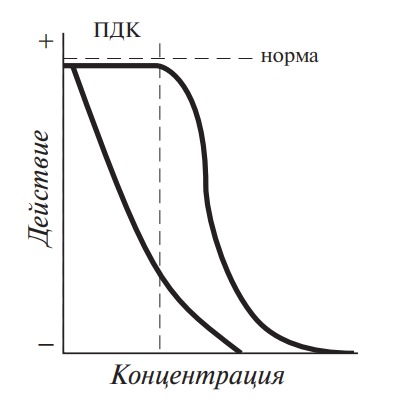
Рис. 4. Действие токсичных элементов
Загрязнение водоемов, атмосферы, почвы, сельскохозяйственных растений и пищевых продуктов токсичными металлами происходит за счет:
- выбросов промышленных предприятий (особенно угольной, металлургической и химической промышленности);
- выбросов городского транспорта (имеется в виду загрязнение свинцом от сгорания этилированного бензина);
- применения в консервном производстве некачественных внутренних покрытий и при нарушении технологии припоев;
- контакта с оборудованием (для пищевых целей допускается весьма ограниченное число сталей и других сплавов).
Для большинства продуктов установлены предельно допустимые концентрации (ПДК) токсичных элементов, к детским и диетическим продуктам предъявляются более жесткие требования.
Наибольшую опасность из вышеназванных элементов представляют ртуть (Hg), свинец (Pb), кадмий (Cd).
Ртуть. Ртуть — один из самых опасных и высокотоксичных элементов, обладающий способностью накапливаться в растениях и в организме животных и человека, то есть являющийся ядом кумулятивного действия.
Токсичность ртути зависит от вида ее соединений, которые по-разному всасываются, метаболизируются и выводятся из организма. Наиболее токсичны алкилртутные соединения с короткой углеродной цепью — метилртуть, этилртуть, диметилртуть. Механизм токсического действия ртути связан с ее взаимодействием с сульфгидрильными группами белков. Блокируя их, ртуть изменяет свойства или инактивирует ряд жизненно важных ферментов. Неорганические соединения ртути нарушают обмен аскорбиновой кислоты, пиридоксина, кальция, меди, цинка, селена, а органические — обмен белков, цистеина, аскорбиновой кислоты, токоферолов, железа, меди, марганца, селена.
Защитным эффектом при воздействии ртути на организм человека обладают цинк и особенно селен. Предполагают, что защитное действие селена обусловлено деметилированием ртути и образованием нетоксичного соединения — селено-ртутного комплекса.
О высокой токсичности ртути свидетельствуют и очень низкие значения ПДК: 0,0003 мг/м3 в воздухе и 0,0005 мг/л в воде. Безопасным уровнем содержания ртути в крови считают 50–100 мкг/л. Человек получает с суточным рационом около 0,05 мг ртути, что соответствует рекомендациям ФАО/ВОЗ.
В организм человека ртуть поступает в наибольшей степени с рыбопродуктами, в которых ее содержание может многократно превышать ПДК. Мясо рыбы отличается наибольшей концентрацией ртути и ее соединений, поскольку активно аккумулирует их из воды и корма, в который входят различные гидробионты, богатые ртутью.
Например, хищные пресноводные рыбы могут содержать от 107 до 509 мкг/кг, нехищные пресноводные рыбы — от 78 до 200 мкг/кг, а океанские нехищные рыбы — от 300 до 600 мкг/кг Hg. Организм рыб способен синтезировать метилртуть, которая накапливается в печени. У некоторых видов рыб в мышцах содержится белок — металлотионеин, который с различными металлами, в том числе и с ртутью, образует комплексные соединения, способствуя тем самым накапливанию ртути в организме и передаче ее по пищевым цепям. У таких рыб содержание ртути достигает очень высоких концентраций: рыба-сабля содержит ее от 500 до 20000 мкг/кг, а тихоокеанский марлин — от 5000 до 14 000 мкг/кг.
Для других продуктов характерно следующее содержание ртути (в мкг/кг) — в продуктах животноводства: мясо — 6–20, печень — 20–35, почки — 20–70, молоко — 2–12, сливочное масло — 2–5, яйца — 2–15; в съедобных частях сельскохозяйственных растений: овощи — 3–59, фрукты — 10–124, бобовые — 8–16, зерновые — 10–103; в шляпочных грибах — 6–447, в перезрелых — до 2000 мкг/кг, причем, в отличие от растений, в грибах может синтезироваться метилртуть.
При варке рыбы и мяса концентрация ртути в них снижается, при аналогичной обработке грибов — остается неизменной. Это различие объясняется тем, что в грибах ртуть связана с аминогруппами азотсодержащих соединений, в рыбе и мясе — с серосодержащими аминокислотами.
Свинец. Свинец — один из самых распространенных и опасных токсикантов. История его применения очень древняя, что связано с относительной простотой его получения и большой распространенностью в земной коре (1,6 · 10–3 %).
Соединения свинца — Pb3O4 и PbSO4 — основа широко применяемых пигментов: сурика и свинцовых белил. Глазури, которые используются для покрытия керамической посуды, также содержат соединения Pb. Металлический свинец со времен Древнего Рима применяют при прокладке водопроводов.
В настоящее время перечень областей его применения очень широк: производство аккумуляторов, электрических кабелей, химическое машиностроение, атомная промышленность, производство эмалей, замазок, лаков, хрусталя, пиротехнических изделий, спичек, пластмасс и т. п. Мировое производство свинца составляет более 3,5 · 106 т в год.
В результате производственной деятельности человека в природные воды ежегодно попадает 500–600 тыс. т, а в атмосферу в переработанном и мелкодисперсном состоянии выбрасывается около 450 тыс. т, подавляющее большинство которого оседает на поверхности Земли. Основным источником загрязнения атмосферы свинцом являются выхлопные газы автотранспорта (260 тыс. т) и сжигание каменного угля (около 30 тыс. т). В тех странах, где использование бензина с добавлением тетраэтилсвинца сведено к минимуму, содержание свинца в воздухе удалось многократно снизить.
Следует подчеркнуть, что многие растения накапливают свинец, который передается по пищевым цепям и обнаруживается в мясе и молоке сельскохозяйственных животных; особенно активное накопление свинца происходит вблизи промышленных центров и крупных автомагистралей.
Ежедневное поступление свинца в организм человека с пищей — 0,1– 0,5 мг, с водой — 0,02 мг. Содержание свинца (в мг/кг) в различных продуктах таково: фрукты — 0,01–0,6; овощи — 0,02–1,6; крупы — 0,03–3,0; хлебобулочные изделия — 0,03–0,82; мясо и рыба — 0,01–0,78; молоко — 0,01–0,1. В организме человека усваивается в среднем 10 % поступившего свинца, у детей — 30–40 %. Из крови свинец поступает в мягкие ткани и кости, где депонируется в виде трифосфата.
Механизм токсического действия свинца имеет двойную направленность. Во-первых, блокада функциональных SH-групп белков и, как следствие, инактивация ферментов, во-вторых, проникновение свинца в нервные и мышечные клетки, образование лактата свинца, затем фосфата свинца, которые создают клеточный барьер для проникновения ионов Са2+. Основными мишенями при воздействии свинца являются кроветворная, нервная и пищеварительная системы, а также почки.
Свинцовая интоксикация может приводить к серьезным нарушениям здоровья, проявляющимся в частых головных болях, головокружениях, повышенной утомляемости, раздражительности, ухудшении сна, мышечной гипотонии, а в наиболее тяжелых случаях к параличам и парезам, умственной отсталости. Неполноценное питание, дефицит в рационе кальция, фосфора, железа, пектинов, белков (или повышенное поступление кальциферола) увеличивают усвоение свинца, а следовательно, его токсичность. Допустимая суточная доза (ДСД) свинца составляет 0,007 мг/кг массы тела; величина ПДК в питьевой воде — 0,05 мг/л.
Мероприятия по профилактике загрязнения свинцом сырья и пищевых продуктов должны включать государственный и ведомственный контроль за промышленными выбросами свинца в атмосферу, водоемы и почву. Необходимо существенно снизить или полностью исключить применение тетраэтилсвинца в бензине, свинцовых стабилизаторах, изделиях из поливинилхлорида, красителях, упаковочных материалах и т. п.
Кадмий. Кадмий широко применяется в различных отраслях промышленности. В воздух кадмий поступает вместе со свинцом при сжигании топлива на ТЭЦ, с газовыми выбросами предприятий, производящих или использующих кадмий. Загрязнение почвы кадмием происходит при оседании кадмий-аэрозолей из воздуха и дополняется внесением минеральных удобрений: суперфосфата (7,2 мг/кг), фосфата калия (4,7 мг/кг), селитры (0,7 мг/кг). Заметно содержание кадмия и в навозе, где он обнаруживается в результате следующей цепи переходов: воздух–почва–растения–травоядные животные–навоз. В некоторых странах соли кадмия применяют в качестве антисептических и антгельминтных препаратов в ветеринарии. Все это определяет основные пути загрязнения кадмием окружающей среды, а следовательно, продовольственного сырья и пищевых продуктов.
Содержание кадмия (в мкг/кг) в различных продуктах выглядит следующим образом — растительные продукты: зерновые — 28–95, горох — 15–19, фасоль — 5–12, картофель — 12–50, капуста — 2–26, помидоры — 10–30, салат — 17–23, фрукты — 9–42, растительное масло — 10–50, сахар — 5–31, грибы — 100–500; продукты животноводства: молоко — 2,4, творог — 6,0, яйца — 23–250. Установлено, что примерно 80 % кадмия поступает в организм человека с пищей, 20 % — через легкие из атмосферы и при курении. С рационом взрослый человек получает кадмия до 150 мкг/кг и выше в сутки. В одной сигарете содержится 1,5–2,0 мкг Cd.
Подобно ртути и свинцу, кадмий не является жизненно необходимым металлом. Попадая в организм, кадмий проявляет сильное токсическое действие, главной мишенью которого являются почки. Механизм токсического действия кадмия связан с блокадой сульфгидрильных групп белков; кроме того, он является антагонистом цинка, кобальта, селена, ингибирует активность ферментов, содержащих указанные металлы. Известна способность кадмия нарушать обмен железа и кальция. Все это может привести к широкому спектру заболеваний: гипертоническая болезнь, анемия, ишемическая болезнь сердца, почечная недостаточность и др. Отмечены канцерогенные, мутагенные и тератогенные эффекты кадмия. По рекомендациям ВОЗ допустимая суточная доза (ДСД) кадмия — 1 мкг/кг массы тела.
Большое значение в профилактике интоксикации кадмием имеет правильное питание (включение в рацион белков, богатых серосодержащими аминокислотами, аскорбиновой кислоты, железа, цинка, селена, кальция), контроль за содержанием кадмия (полярографический, атомно-абсорбционный анализы) и исключение из рациона продуктов, богатых кадмием.
Алюминий. Первые данные о токсичности алюминия были получены в 1970-х гг., и это явилось неожиданностью для человечества. Будучи третьим по распространенности элементом земной коры (8,8 % массы земной коры составляет Аl) и обладая ценными качествами, металлический алюминий нашел широкое применение в технике и быту. Поставщиками алюминия в организм человека является алюминиевая посуда, если она контактирует с кислой или щелочной средой, вода, которая обогащается ионами Аl3+ при обработке ее сульфатом алюминия на водоочистительных станциях. Существенную роль в загрязнении окружающей среды ионами Аl3+ играют и кислотные дожди. Не следует злоупотреблять содержащими гидроксид алюминия лекарствами: противогеморроидальными, противоартритными, понижающими кислотность желудочного сока. Как буферную добавку вводят гидроксид алюминия и в некоторые препараты аспирина, и в губную помаду. Среди пищевых продуктов наивысшей концентрацией алюминия (до 20 мг/г) обладает чай.
Поступающие в организм человека ионы Аl3+ в форме нерастворимого фосфата выводятся с фекалиями, частично всасываются в кровь и выводятся почками. При нарушении деятельности почек происходит накапливание алюминия, которое приводит к нарушению метаболизма Са, Мg, P, F, сопровождающееся ростом хрупкости костей, развитием различных форм анемии. Кроме того, были обнаружены и более грозные проявления токсичности алюминия: нарушение речи, провалы в памяти, нарушение ориентации и т. п. Все это позволяет приблизить «безобидный», считавшийся нетоксичным до недавнего времени алюминий к «мрачной тройке» супертоксикантов: Hg, Pb, Cd.
Мышьяк. Мышьяк как элемент в чистом виде ядовит только в высоких концентрациях. Он принадлежит к тем микроэлементам, необходимость которых для жизнедеятельности организма человека не доказана, а его соединения, такие как мышьяковистый ангидрид, арсениты и арсенаты, сильно токсичны. Мышьяк содержится во всех объектах биосферы (в земной коре — 2 мг/кг, морской воде — 5 мкг/кг). Известными источниками загрязнения окружающей среды мышьяком являются электростанции, использующие бурый уголь, медеплавильные заводы; он используется при производстве полупроводников, стекла, красителей, инсектицидов, фунгицидов и др.
Нормальный уровень содержания мышьяка в продуктах питания не должен превышать 1 мг/кг. Так, например, фоновое содержание мышьяка (в мг/кг): в овощах и фруктах — 0,01–0,2; в зерновых — 0,006–1,2; в говядине — 0,005–0,05; в печени — 2,0; яйцах — 0,003–0,03; в коровьем молоке — 0,005–0,01. Повышенное содержание мышьяка отмечается в рыбе и других гидробионтах, в частности в ракообразных и моллюсках. По данным ФАО/ВОЗ, в организм человека с суточным рационом поступает в среднем 0,05–0,45 мг мышьяка. ДСД — 0,05 мг/кг массы тела.
В зависимости от дозы мышьяк может вызывать острое и хроническое отравление; разовая доза мышьяка 30 мг — смертельна для человека. Механизм токсического действия мышьяка связан с блокированием SH-групп белков и ферментов, выполняющих в организме разнообразные функции.
2.3. Радиоактивное загрязнение
Источники радиоактивности, как и другие загрязнители, являются компонентами пищевых цепей: атмосфера–ветер–дождь–почва–растения–животные–человек. Анализируя данные о взаимодействии радионуклидов с компонентами природной среды и организмом человека, необходимо отметить следующее. Радионуклиды естественного происхождения постоянно присутствуют во всех объектах неживой и живой природы, начиная с момента образования нашей планеты.
При этом радиационный фон в различных регионах Земли может отличаться в 10 и более раз. К радионуклидам естественного происхождения относят: во-первых, космогенные радионуклиды, главным образом 3H, 7Be, 14C, 22Na, 24Na; во-вторых, радионуклиды, присутствующие в объектах окружающей среды (среди них основными источниками загрязнения пищевых продуктов и облучения человека являются 40K, 238U, 232Th).
Радон — один из первых открытых человеком радионуклидов. Этот благородный газ образуется при распаде изотопа 226Ra и поступает в организм ингаляционным путем. Человек контактирует с радоном везде, но главным образом в каменных и кирпичных жилых зданиях (особенно в подвальных помещениях и на первых этажах), поскольку главным источником является почва под зданием и строительные материалы.
Радиоактивность (в мкЗв/год) строительных материалов такова: дерево — 0; известняк, песчаник — 0–100; кирпич, бетон — 100–200; естественный камень, производственный гипс — 200–400; шлаковый камень, гранит — 400–2000. Высокое содержание радона может быть в подземных водах. Доступным и эффективным способом удаления радона из воды является ее аэрация.
В результате производственной деятельности человека, связанной с добычей полезных ископаемых, сжиганием органического топлива, созданием минеральных удобрений и т. п., произошло обогащение атмосферы естественными радионуклидами, причем естественный радиационный фон постоянно меняется. В связи с этим было введено такое понятие, как «техногенно измененный радиационный фон». На территории нашей страны его величина колеблется от 4,5 до 30 мкР/ч.
С момента овладения человеком ядерной энергией в биосферу начали поступать радионуклиды, образующиеся на АЭС, при производстве ядерного топлива и испытаниях ядерного оружия. Таким образом, встал вопрос об искусственных радионуклидах и особенностях их влияния на организм человека. Среди радионуклидов искусственного происхождения наиболее распространены 21, восемь из которых составляют основную дозу внутреннего облучения населения: 14С, 137Cs, 90Sr, 89Sr, 106Ru, 144Ce, 131I, 95Zr.
Существуют три пути попадания радиоактивных веществ в организм человека:
- а) при вдыхании воздуха, загрязненного радиоактивными веществами;
- б) через желудочно-кишечный тракт — с пищей и водой;
- в) через кожу.
Для наиболее опасных искусственных радионуклидов, к которым следует отнести долгоживущие 90Sr, 137Cs и короткоживущий 131I, в настоящее время выявлены закономерности всасывания, распределения, накопления и выделения, а также механизмы их связи с различными биологическими структурами. Одной из главных задач по профилактике и снижению степени внутреннего облучения следует считать уменьшение всасывания радиоактивных элементов при их длительном поступлении в организм человека с пищевыми продуктами.
Эффект действия ионизирующих излучений на клетку и организм в целом можно понять, проследив изменения, происходящие на всех этапах следующей цепи: биомолекулы–клеточный компартмент–клетка–ткани–организм, и установив взаимосвязь между ними.
Клетка — это слаженная динамическая система биологически важных макромолекул, которые скомпонованы в компартменты (субклеточные образования), выполняющие определенные физиологические функции.
Наиболее чувствительными к облучению органеллами клеток организма млекопитающих являются ядро и митохондрии. Здесь повреждения проявляются в малые сроки и при малых дозах. Наиболее всего угнетаются процессы окислительного фосфорилирования, изменяются физико-химические свойства нуклеопротеидов, в результате чего происходят количественные и качественные изменения в ДНК, нарушаются процессы транскрипции и трансляции. Кроме этого, угнетаются энергетические процессы, выброс в цитоплазму ионов K+ и Na+, нарушаются функции мембран.
Одновременно возможны все виды мутаций: геномные мутации (кратные изменения гаплоидного числа хромосом), хромосомные мутации или хромосомные аберрации (структурные или численные изменения хромосом), генные или точковые мутации (изменения молекулярной структуры генов, в результате чего синтезируются белки, утратившие свою биологическую активность).
Принято рассматривать три этапа радиационного поражения клетки. I этап можно назвать физическим. На этом этапе происходит ионизация и возбуждение макромолекул; при этом поглощенная энергия реализуется в слабых местах (в белках — SH-группы, в ДНК — хромофорные группы тимина, в липидах — ненасыщенные связи).
- этап — химические преобразования. На этом этапе происходит взаимодействие радикалов белков, нуклеиновых кислот, липидов с водой, кислородом, с радикалами воды и т. п. Это, в свою очередь, приводит к образованию гидроперекисей, ускоряет процессы окисления, вызывает множественные изменения молекул. В результате этого начальный эффект многократно усиливается. Разрушается структура биологических мембран, усиливаются другие процессы деструкции, высвобождаются ферменты, наблюдается изменение их активности.
- этап — биохимический. На этом этапе происходят нарушения, которые связаны с высвобождением ферментов и изменением их активности. Различные ферментные системы реагируют на облучение неоднозначно. Активность одних ферментов после облучения возрастает, других — снижается, третьих — остается неизменной. К числу наиболее радиочувствительных процессов в клетке относится окислительное фосфорилирование. Нарушение этого процесса отмечается через 20–30 минут при дозе облучения 100 рад. Оно проявляется в повреждении системы генерирования АТФ, без которой не обходится ни один процесс жизнедеятельности.
Высокой чувствительностью обладают ДНК-комплексы (ДНК клеточного ядра в комплексе со щелочными белками, РНК, ферментами). Предполагается, что в этом случае в первую очередь поражаются связи белок–белок и белок–ДНК.
Облучение целостного организма приводит к снижению гликогена в скелетных мышцах, печени и ряде других тканей в результате нейрогуморальной реакции на облучение. Кроме этого обнаруживается нарушение процессов распада глюкозы (гликолиз) и высокополимерных полисахаридов.
При действии ионизирующих излучений на липиды происходит образование перекисей. Схема реакций в этом случае может быть представлена следующим образом:
ROOH → R’ и ROOH → ROO’ — начальное образование радикалов; R’ + O2 → RO2′ и ROO’ + RH → ROOH + R’ — цепные реакции.
Этим процессам придают особое значение в развитии лучевого поражения, так как это приводит к разрушению клеточных мембран и гибели клетки.
В организме при его облучении наблюдается снижение общего содержания липидов, их перераспределение между различными тканями с увеличением уровня в крови и печени (что, вероятно, связано с изменениями углеводного обмена). Кроме того, наблюдается угнетение ряда антиоксидантов, что, в свою очередь, также способствует образованию токсичных гидроперекисей.
По характеру распределения в организме человека радиоактивные вещества можно условно разделить на следующие три группы.
- Отлагающиеся преимущественно в скелете (так называемые остеотропные изотопы — стронций, барий, радий и др.).
- Концентрирующиеся в печени (церий, лантан, плутоний и др.).
- Равномерно распределяющиеся по системам (водород, углерод, инертные газы, железо и др.). Причем одни имеют тенденцию к накоплению в мышцах (калий, рубидий, цезий), а другие — в селезенке, лимфатических узлах, надпочечниках (ниобий, рутений).
Особое место занимает радиоактивный йод — он селективно аккумулируется щитовидной железой.
Если принять в качестве критерия чувствительности к ионизирующему излучению морфологические изменения, то клетки и ткани организма человека по степени возрастания чувствительности можно расположить в следующем порядке: нервная ткань, хрящевая и костная ткани, мышечная ткань, соединительная ткань, щитовидная железа, пищеварительные органы, легкие, кожа, слизистые оболочки, половые железы, лимфоидная ткань, костный мозг.
Из вышесказанного вытекают следующие направления по профилактике радиоактивного загрязнения окружающей среды: о храна атмосферы Земли как природного экрана, предохраняющего от губительного космического воздействия радиоактивных частиц; соблюдение глобальной техники безопасности при добыче, использовании и хранении радиоактивных элементов, применяемых человеком в процессе его жизнедеятельности.
Важнейшим фактором предотвращения накопления радионуклидов в организме людей является питание. Это и употребление в пищу определенных продуктов и их отдельных компонентов. Особенно это касается защиты организма от долгоживущих радионуклидов, которые способны мигрировать по пищевым цепям, накапливаться в органах и тканях, подвергать хроническому облучению костный мозг, костную ткань и т. п. Установлено, что обогащение рациона рыбой, кальцием, фтором, витаминами А, Е, С, которые являются антиоксидантами, а также неусвояемыми углеводами (пектин), способствует снижению риска онкологических заболеваний, играет большую роль в профилактике радиоактивного воздействия наряду с радиопротекторами, к которым относятся вещества различной химической природы, в том числе и серосодержащие соединения, такие как цистеин и глутатион.
В настоящее время разработана современная концепция радиозащитного питания (рис. 5), которая базируется на трех основных положениях:
- а) максимально возможное уменьшение поступления радионуклидов с пищей;
- б) торможение процессов сорбции и накопления радионуклидов в организме;
- в) соблюдение принципов рационального питания.
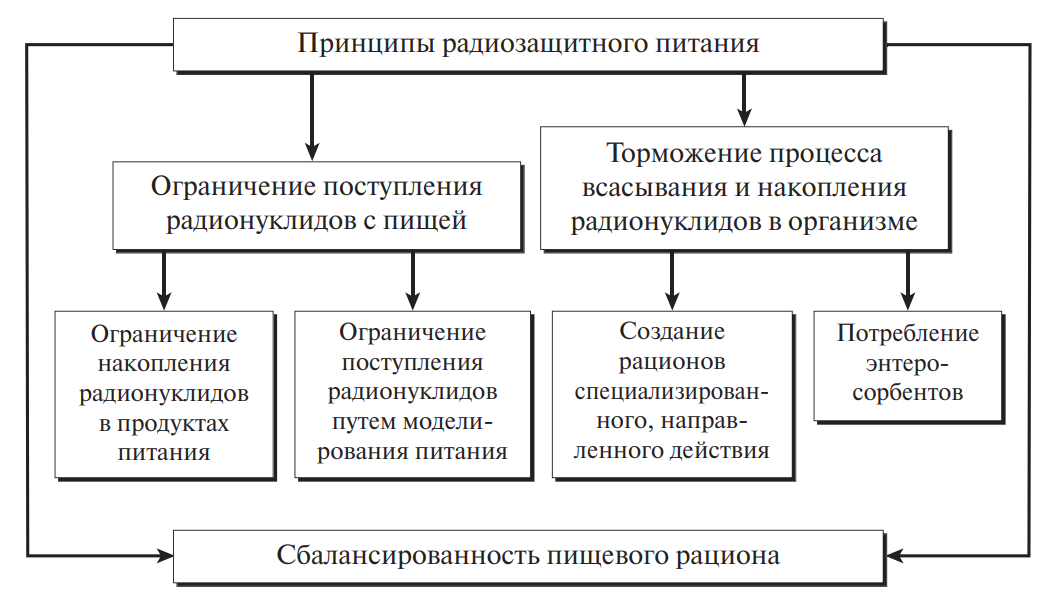
Рис. 5. Современная концепция радиозащитного питания
2.4. Диоксины и диоксинподобные соединения
Диоксины — высокотоксичные соединения, обладающие мутагенными, канцерогенными и тератогенными свойствами. Они представляют реальную угрозу загрязнения пищевых продуктов, включая воду.
Диоксины являются побочными продуктами производства пластмасс, пестицидов, бумаги, дефолиантов*. В ходе вьетнамской войны (1962– 1971 гг.) самолетами американских ВВС было распылено на территории Южного Вьетнама 57 тыс. т дефолианта — «оранжевого реагента», в котором в виде примеси содержалось 170 кг диоксина (то есть 0,0003 %); в результате у участников этих событий были отмечены многочисленные заболевания, в том числе и онкологические. Именно последствия этой войны привели к пониманию той грозной опасности, какой являются диоксины для всего человечества.
Диоксины обнаружены в составе отходов металлургии, деревообрабатывающей и целлюлозно-бумажной промышленности. Они образуются при уничтожении отходов в мусоросжигательных печах, на тепловых электростанциях, присутствуют в выхлопных газах автомобилей, при горении синтетических покрытий и масла, на городских свалках, то есть практически везде, где ионы хлора (брома) или их сочетания взаимодействуют с активным углеродом в кислой среде. Таким образом, проблема диоксинов приобрела глобальный характер.
Дефолианты — химические вещества и препараты, вызывающие опадение листьев у растений; применяются для предуборочного удаления листьев, с целью облегчения механизированной уборки урожая.
Группа диоксинов объединяет сотни веществ, каждое из которых содержит специфическую гетероциклическую структуру с атомами хлора (брома) в качестве заместителей. Структура 2,3,7,8-тетрахлордибензо- пара-диоксина (ТХДД) включает два ароматических кольца, связанных между собой двумя кислородными мостиками:
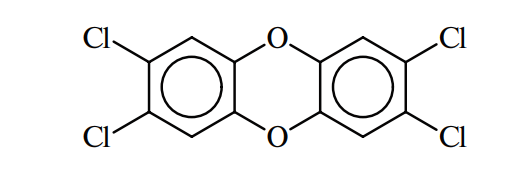
ТХДД — так называемый классический диоксин; действие его сильнее цианидов, стрихнина, зомана, зарина, VX-газа. ТХДД выбран за эталон онкотоксичности, отличается высокой стабильностью, не поддается гидролизу и окислению, устойчив к высокой температуре (разлагается лишь при 750 °С), устойчив к действию кислот и щелочей, не воспламеняем, хорошо растворим в органических растворителях.
Структура 2,3,7,8-тетрахлордибензофурана (ТХДФ) также содержит два ароматических кольца, но связаны они одним кислородным мостиком:
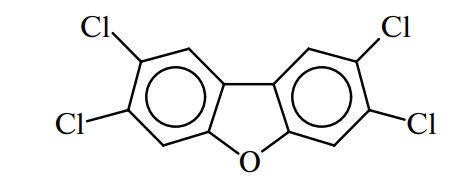
Кроме этих двух основных соединений, возможны различные сочетания. Например:
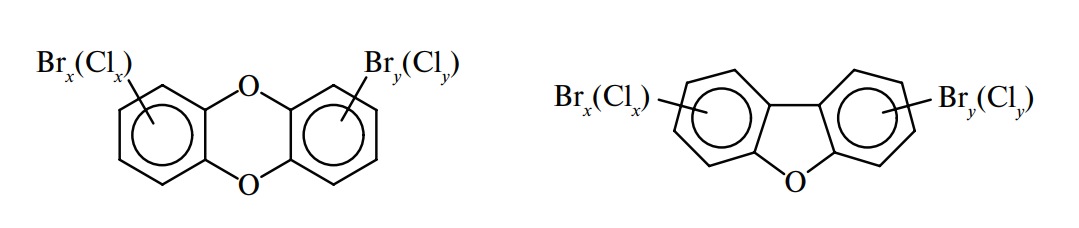
В родственных полихлорированных бифенилах два ароматических кольца связаны обычной химической связью:
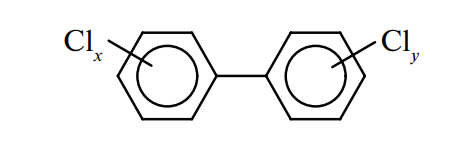
Таким образом, под диоксинами следует понимать не какое-либо конкретное вещество, а несколько десятков семейств, включающих трициклические кислородсодержащие ксенобиотики, а также семейство бифенилов, не содержащих атомы кислорода. Это 75 полихлорированных дибензодиоксинов, 135 полихлорированных дибензофуранов, 210 веществ из броморганических семейств, несколько тысяч смешанных бром- и хлорсодержащих соединений. Нельзя забывать и об изомерии: наряду с ТХДД существуют 22 его изомера, для ТХДФ — 38 изомеров.
При попадании в окружающую среду диоксины интенсивно накапливаются в почве, водоемах, активно мигрируют по пищевым цепям (рис. 6). В организм человека диоксины попадают в основном с пищей. Среди основных продуктов опасные концентрации диоксинов обнаруживают в животных жирах, в мясе, молочных продуктах, рыбе (содержание диоксина будет определяться жирностью этих продуктов, так как диоксины — жирорастворимые соединения). В коровьем молоке содержание диоксинов в 40–200 раз превышает их наличие в тканях животного. Источниками диоксинов могут быть и корнеплоды (картофель, морковь и др.).
Для диоксинов не существует таких норм, как ПДК — эти вещества токсичны при любых концентрациях, меняются лишь формы ее проявления. Диоксины обладают широким спектром биологического действия на человека и животного. В малых дозах они вызывают мутагенный эффект, отличаются кумулятивными свойствами, ингибирующим или индуцирующим действием на различные ферментные системы организма. Их опасность очень велика и не случайно диоксины и диоксинподобные соединения относят к группе суперэкотоксикантов.
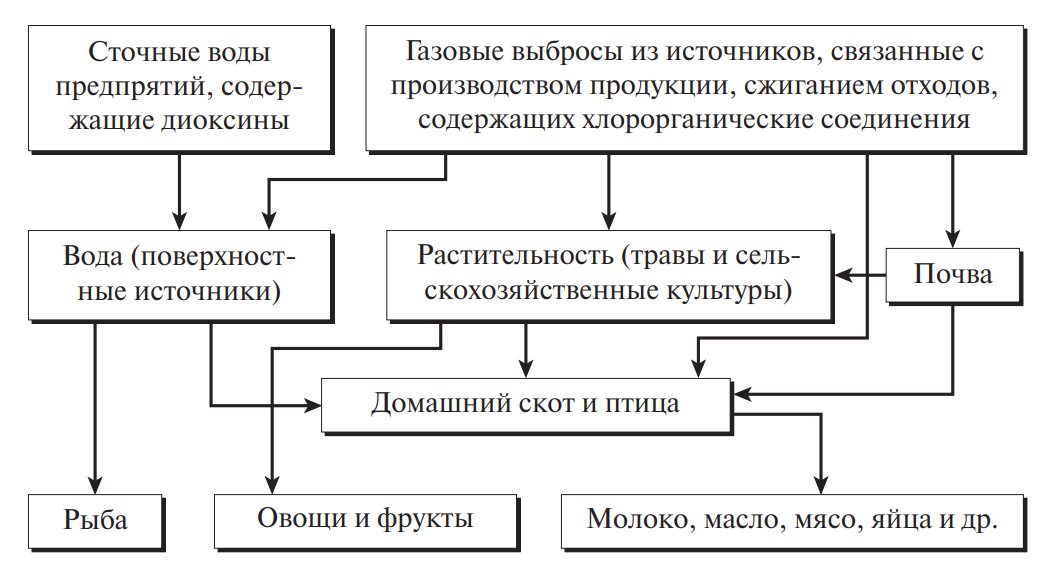
Рис. 6. Поступление диоксинов и передача их по пищевым цепям
Выведение неизмененных диоксинов из организма происходит в основном в результате почечной фильтрации. Медленность такого самоочищения связана с тем, что подавляющая часть диоксинов сконцентрирована в жировых тканях организма. И несмотря на то что это более лабильная форма удержания, чем, например, свинца в костном скелете с t0,5 = 20 лет, тем не менее t0,5 для различных диоксинов составляет от 3 до 10 лет. Полупревращение диоксинов в окружающей среде характеризуется цифрами того же порядка: для водных диоксинов в составе взвесей и донных отложений t0,5 = 2 года и t0,5 >= 20 лет для диоксинов в почвах. При этом ни в почвах, ни в водной среде не происходит микробиологического окисления диоксинов, так как диоксины являются ядом для всех аэробных организмов, включая и микроорганизмы.
В целом, установление санитарных норм по диоксину в различных странах базируется на разных критериях. В Европе как основной принят показатель онкогенности (то есть за основу берут возможность возникновения раковых опухолей), в США — показатель иммунотоксичности (то есть угнетение иммунной системы). Расчет ДСД (допустимой суточной дозы) ведется таким образом, чтобы за 70 лет жизни в организм человека поступило диоксина не больше 10–11 г/кг в день.
В борьбе с диоксинами уже достигнуты определенные успехи. Это произошло благодаря тому, что не только ученые, но и правительства многих стран осознали опасность общепланетарного отравления среды диоксинами. Во многих странах мира (и в России в том числе) проводится экологический мониторинг по диоксинам в различных отраслях промышленности. В соответствии с полученными данными решаются вопросы совершенствования тех или иных технологических процессов. В США и в странах Западной Европы ведется кампания за сортировку бытовых отходов, отделение пластмассовых изделий (в Швеции, например, это практикуется уже многие годы). Кроме того, шведам удалось найти способ получения бездиоксиновой бумаги. В ФРГ, США, Нидерландах, Японии после реконструкции мусоросжигательных заводов удалось свести образование диоксинов до минимума, во Франции разработаны антидиоксиновые фильтры.
В заключение нельзя не отметить явление синергизма — эффекта воздействия, превышающего сумму эффектов воздействия каждого из факторов. Такими синергистами по отношению к диоксину могут являться: радиация, свинец, кадмий, ртуть, нитраты, хлорфенолы, соединения серы.
Для обнаружения диоксинов используется метод хромато-масс-спектроскопии высокого разрешения. Показательно, что за последние 30 лет чувствительность аналитических методов определения возросла в 10 7 раз, но это остается весьма дорогостоящей процедурой.
2.5. Полициклические ароматические углеводороды
Полициклические ароматические углеводороды (ПАУ) насчитывают более 200 представителей, которые являются сильными канцерогенами. К наиболее активным канцерогенам относят 3,4-бенз(а)пирен, который был идентифицирован в 1933 г. как канцерогенный компонент сажи и смолы, а также холантрен, перилен и дибенз(а)пирен.
Ниже приведены структурные формулы наиболее канцерогенных ПАУ:
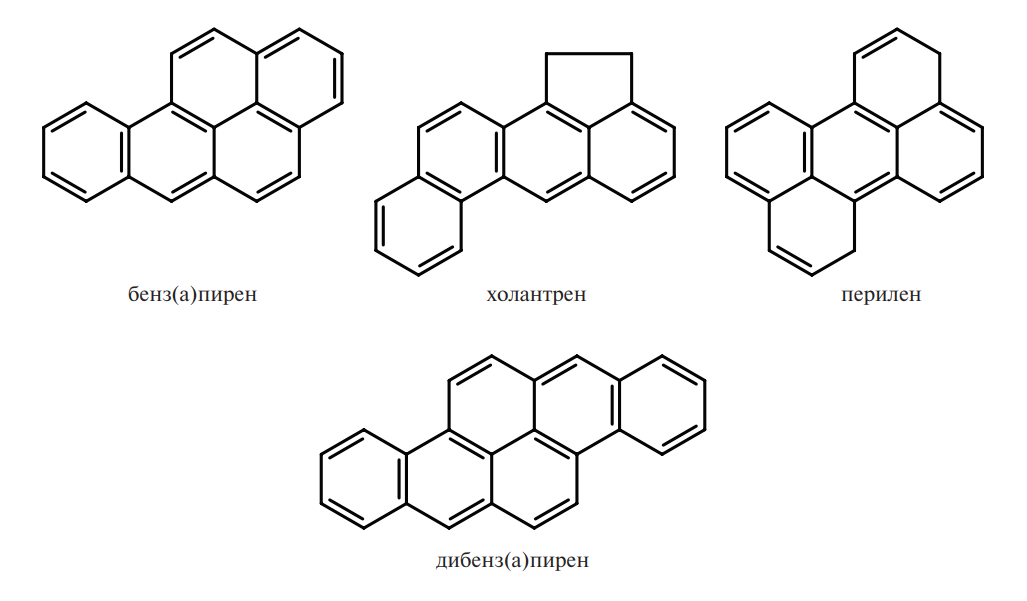
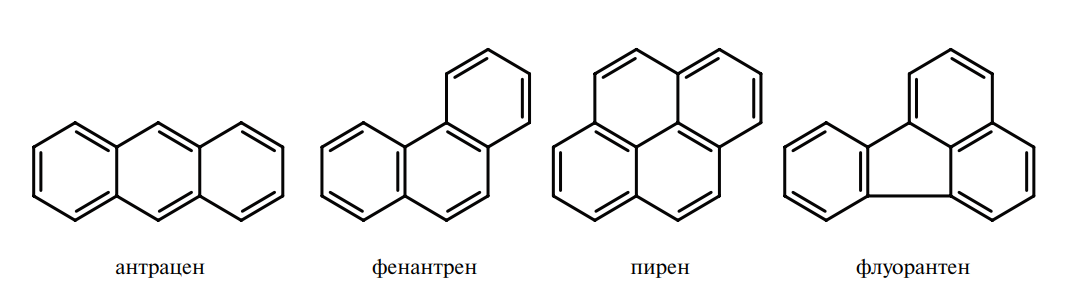
К малотоксичным ПАУ относят антрацен, фенантрен, пирен, флуорантен, структурные формулы которых представлены ниже:
Канцерогенная активность реальных сочетаний полициклических ароматических углеводородов на 70–80 % обусловлена бенз(а)пиреном. Поэтому по присутствию бенз(а)пирена в пищевых продуктах и других объектах можно судить об уровне их загрязнения ПАУ и степени онкогенной опасности для человека.
Канцерогенные ПАУ образуются в природе путем абиогенных процессов; ежегодно в биосферу поступают тысячи тонн бенз(а)пирена природного происхождения. Еще больше — за счет техногенных источников. Образуются ПАУ в процессах сгорания нефтепродуктов, угля, дерева, мусора, пищи, табака, причем, чем ниже температура, тем больше образуется ПАУ.
В пищевом сырье, полученном из экологически чистых растений, концентрация бенз(а)пирена 0,03–1,0 мкг/кг. Условия термической обработки значительно увеличивают его содержание до 50 мкг/кг и более. Полимерные упаковочные материалы могут играть немаловажную роль в загрязнении пищевых продуктов ПАУ, например жир молока экстрагирует до 95 % бенз(а)пирена из парафинобумажных пакетов или стаканчиков. Высока концентрация бенз(а)пирена и в табачном дыме.
С пищей взрослый человек получает бенз(а)пирена 0,006 мг/год. В интенсивно загрязненных районах эта доза возрастает в пять и более раз. ПДК бенз(а)пирена в атмосферном воздухе — 0,1 мкг/100 м3, в воде водоемов — 0,005 мг/л, в почве — 0,2 мг/кг. Содержание бенз(а)пирена (в мкг/кг) в различных пищевых продуктах (Р. Д. Габович, Л. С. Припутина, 1988) представлено ниже:
- Свинина свежая Не обнаружено
- Говядина свежая Не обнаружено
- Kолбаса вареная 0,26–0,50
- Kолбаса копченая 0–2,1
- Kолбаса полукопченая 0–7,2
- Телятина Не обнаружено
- Жареная телятина 0,18–0,63
- Kрабы свежие
- (сухая масса) 6–18
- Kамбала свежая
- (сухая масса) 15
- Kрасная рыба 0,7–1,7
- Сельдь холодного
- копчения: 11,2
- внешняя часть 6,8
- внутренняя часть 0,2–1,0
- Молоко 0,01–0,02
- Сливочное масло 0–0,13
- Подсолнечное масло 0,93–30,0
- Оливковое масло,
- рафинированное Не обнаружено
- Рапсовое масло 0,9
- Kокосовое масло 18,6–43,7
- Сахар 0,23
- Соль 0,03–0,50
- Зерно 0,17–4,38
- Ячмень и солод 0,35–0,70
- Мука 0,2–1,6
- Мука высшего сорта 0,09
- Хлебобулочные изделия 0,13–0,47
- Ржаной хлеб 0,08–1,63
- Белый хлеб, батон 0,08–0,09
- Салат из кочанной капусты 12
- Цветная капуста 24
- Kартофель 1–16,6
- Kофе умеренно
- поджаренный 0,3–0,5
- Kофе пережаренный 5,6–6,1
- Сушенные фрукты:
- сливы 23,9
- вишня 14,2
- груша 5,7
- яблоки 0,3
Приведенные выше данные свидетельствуют о том, что бенз(а)пирен попадает в организм человека с такими пищевыми продуктами, в которых до настоящего времени существование канцерогенных веществ не предполагалось. Он обнаружен в хлебе, овощах, фруктах, маргарине, растительных маслах, в обжаренных зернах кофе, копченостях, жаренных мясных продуктах. Причем его содержание значительно колеблется в зависимости от способа технологической и кулинарной обработки или от степени загрязнения окружающей среды.
В атмосфере ПАУ достаточно устойчивы. Их постепенная трансформация в иные продукты происходит при взаимодействии с озоном — при этом образуются полиядерные хиноны и при взаимодействии с диоксидом углерода — с образованием нитробензопиренов, обладающих мутагенной активностью. Из организма бенз(а)пирен частично выводится в неизмененном виде, а частично окисляется, давая производные фенольного и хинонного типа. Некоторым из этих продуктов также присуща мутагенная активность.
2.6. Загрязнения веществами, применяемыми в растениеводстве
Остатки сельскохозяйственных ядохимикатов представляют наиболее значительную группу загрязнителей, так как присутствуют почти во всех пищевых продуктах. В эту группу загрязнителей входят пестициды (бактериоциды, фунгициды, инсектициды, гербициды и др.), удобрения, регуляторы роста растений, средства против прорастания, средства, ускоряющие созревание плодов. Рассмотрим основные из них.
Пестициды. Пестициды — вещества различной химической природы, применяемые в сельском хозяйстве для защиты культурных растений от сорняков, вредителей и болезней, то есть химические средства защиты растений. Мировое производство пестицидов (в пересчете на активные вещества) составляет более 2 млн т в год, причем эта цифра непрерывно растет. В настоящее время в мировой практике используют около 10 тыс. наименований пестицидных препаратов на основе 1500 действующих веществ, которые относятся к различным химическим группам. Наиболее распространены следующие: хлорорганические, фосфорорганические, карбаматы (производные карбаминовой кислоты), ртутьорганические, синтетические пиретроиды и медьсодержащие фунгициды.
С гигиенических позиций принята следующая классификация пестицидов:
- по токсичности при однократном поступлении через желудочно-кишечный тракт пестициды делятся на сильнодействующие ядовитые вещества (ЛД50 до 50 мг/кг), высокотоксичные (ЛД50 от 50 до 200 мг/кг), среднетоксичные (ЛД50 от 200 до 1000 мг/кг), малотоксичные (ЛД50 более 1000 мг/кг);
- по кумулятивным свойствам пестициды делятся на вещества, обладающие сверхкумуляцией (коэффициент кумуляции* меньше 1), выраженной кумуляцией (коэффициент кумуляции от 1 до 3), умеренной кумуляцией (коэффициент кумуляции от 3 до 5), слабовыраженной кумуляцией (коэффициент кумуляции больше 5);
- по стойкости пестициды делятся на очень стойкие (время разложения на нетоксичные компоненты свыше 2 лет), стойкие (от 0,5 до 1 года), умеренно стойкие (от 1 до 6 месяцев), малостойкие (1 месяц).
Нарушения гигиенических норм хранения, транспортировки и применения пестицидов, низкая культура работы с ними приводят к их накоплению в кормах, продовольственном сырье и пищевых продуктах, а способность аккумулироваться и передаваться по пищевым цепям — к их широкому распространению и негативному влиянию на здоровье человека.
Применение пестицидов и их роль в борьбе с различными вредителями в повышении урожайности сельскохозяйственных культур, их влиянии на окружающую среду и здоровье человека вызывают неоднозначные оценки различных специалистов.
Интересна судьба открытого в 1939 г. швейцарцем Паулем Мюллером инсектицида [2,2,2-трихлор-1,1-бис(пара-хлорфенил)этана] — (ClC6H4)2CHCCl3, известного как ДДТ. Препарат токсичен, ЛД50 — 200 мг/кг, ПДК в воздухе — 0,1 мг/м3, ПДК в воде — 0,1 мг/л; допустимые остатки в почве — 1,0 мг/кг, в овощах и фруктах — 0,5 мг/кг, в других продуктах не допускается.
ДДТ сыграл огромную роль в борьбе с малярией, и в 1948 г. Пауль Мюллер был удостоин Нобелевской премии в области медицины за свое открытие. Однако уже начиная с 1950 г. начали поступать сообщения о токсических свойствах ДДТ и реальной угрозе с его стороны для здоровья человека. Благодаря своей стойкости и летучести (период обращения вокруг Земли составлял всего 3–4 недели), ДДТ оказался одним из первых глобальных загрязнителей. Он был обнаружен на всех континентах, в том числе и в Антарктиде. Его способность аккумулироваться и передаваться по пищевым цепям привела к тому, что он был обнаружен в жировом слое пингвинов и в грудном молоке женщин. Все это способствовало тому, что уже в 1960-х гг. в большинстве стран препарат был запрещен (в СССР — с 1970 г.).
В настоящее время споры о применении или же полном запрете пестицидов продолжаются. Ученые разных областей науки (химики, аграрии, медики) — каждый со своих позиций — приводят убедительные доводы как за, так и против его применения. Очевидно, что лишь общие усилия помогут найти правильное решение этой сложнейшей проблемы.
* Kоэффициент кумуляции — отношение суммарной дозы препарата при многократном введении к дозе, вызывающей гибель животного при однократном введении.
С 1986 г. в нашей стране действует автоматизированный мониторинг, обеспечивающий информацию об уровнях пестицидов и других хлорорганических соединений в продуктах питания. В частности, при мониторинге определяются остаточные количества 154 пестицидов, относящиеся к 45 группам в 262 видах пищевых продуктах, принадлежащих к 23 классам. Результаты мониторинга последних лет показывают возрастание общего содержания пестицидов в продуктах растительного и животного происхождения. Особенно это касается таких продуктов, как картофель, репчатый лук, капуста, помидоры, огурцы, морковь, свекла, яблоки, виноград, пшеница, ячмень, рыба прудов и водохранилищ, молоко. В них обнаруживается наиболее широкий спектр пестицидов. Причем повышение допустимого уровня содержания пестицидов в пять и более раз следует понимать как экстремальное загрязнение, а оно наблюдается, к сожалению, в широком ассортименте продуктов питания.
Данные мониторинга свидетельствуют о реальной опасности комбинированного воздействия на организм человека множества высокотоксичных пестицидов, позволяют оценить степень такой нагрузки и определить необходимость первоочередных мер по испытанию и профилактике.
Очевидно, что полностью отказаться от применения пестицидов невозможно, поэтому очень важен контроль за производством и применением пестицидов со стороны различных ведомств и организаций, а также информация населения о неблагоприятном воздействии этих соединений на организм человека. Однако в решении проблемы, связанной с негативным влиянием пестицидов на организм человека, существуют свои объективные трудности. Пестициды, поступающие в организм с пищевыми продуктами, подвергаются биотрансформации, и это затрудняет их обнаружение и осложняет раскрытие механизмов воздействия на человека. Кроме того, промежуточные продукты биотрансформации ксенобиотиков бывают более токсичны, чем первоначальный ксенобиотик, и в связи с этим огромное значение приобретает опасность отдаленных последствий применения пестицидов.
Нитраты, нитриты, нитрозамины. Нитраты широко распространены в природе, они являются нормальными метаболитами любого живого организма, как растительного, так и животного, даже в организме человека в сутки образуется и используется в обменных процессах более 100 мг нитратов.
Почему же говорят об опасности нитратов? При потреблении в повышенном количестве нитраты (NO3—) в пищеварительном тракте частично
восстанавливаются до нитритов (NO2—). Механизм токсического действия нитритов в организме заключается в их взаимодействии с гемоглобином крови и в образовании метгемоглобина, неспособного связывать и переносить кислород. 1 мг нитрита натрия (NaNO2) может перевести в метгемоглобин около 2000 мг гемоглобина.
Согласно данным ФАО/ВОЗ, ДСД нитрита составляет 0,2 мг/кг массы тела, исключая грудных детей. Острая интоксикация отмечается при одноразовой дозе с 200–300 мг, летальный исход при 300–2500 мг. Токсичность нитритов будет зависеть от пищевого рациона, индивидуальных особенностей организма, в частности от активности фермента метгемоглобинредуктазы, способного восстанавливать метгемоглобин в гемоглобин. Хроническое воздействие нитритов приводит к снижению в организме витаминов А, Е, С, В1, В6, что, в свою очередь, сказывается на снижении устойчивости организма к воздействию различных негативных факторов, в том числе и онкогенных. Нитраты, как отмечалось выше, сами по себе не обладают выраженной токсичностью, однако одноразовый прием 1–4 г нитратов вызывает у людей острое отравление, а доза 8–14 г может оказаться смертельной. ДСД, в пересчете на нитрат-ион, составляет 5 мг/кг массы тела, ПДК нитратов в питьевой воде — 45 мг/л.
Кроме того, из нитритов в присутствии различных аминов могут образовываться N-нитрозамины.
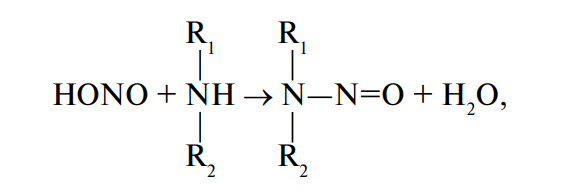
где R1 и R2 — алкильные, арильные, гетероциклические радикалы.
В зависимости от природы радикала могут образовываться разнообразные нитрозамины, 80 % из которых обладают канцерогенным, мутагенным, тератогенным действием, причем канцерогенное действие этих соединений определяющее.
Нитрозамины могут образовываться в окружающей среде; так, с суточным рационом человек получает примерно 1 мкг нитрозосоединений, с питьевой водой — 0,01 мкг, с вдыхаемым воздухом — 0,3 мкг, но эти значения могут значительно колебаться в зависимости от степени загрязнения окружающей среды. В результате технологической обработки сырья, полуфабрикатов (интенсивная термическая обработка, копчение, соление, длительное хранение и т. п.) образуется широкий спектр нитрозосоединений. Кроме этого, нитрозамины образуются в организме человека в результате эндогенного синтеза из предшественников (нитраты, нитриты).
Наибольшее распространение получили такие нитрозосоединения, как N-нитрозодиметиламин (НДМА), N-нитрозодиэтиламин (НДЭА), N-нитрозодипропиламин (НДПА), N-нитрозодибутиламин (НДБА), N-нитрозопиперидин (НПиП), N-нитрозопирролидин (НПиР).
Основными источниками поступления нитратов и нитритов в организм человека являются в первую очередь растительные продукты. И поскольку нитраты, как отмечалось выше, являются нормальным продуктом обмена азота в растениях, нетрудно предположить, что их содержание зависит от следующих факторов:
- индивидуальные особенности растений (существуют так называемые «растения накопители нитратов», это, в первую очередь, листовые овощи, а также корнеплоды, например свекла и др.);
- степень зрелости плодов (недозрелые овощи, картофель, а также овощи ранних сроков созревания могут содержать нитратов больше, чем достигшие нормальной уборочной зрелости);
- возрастающее и часто бесконтрольное применение азотистых удобрений (имеется в виду неправильная дозировка и сроки внесения удобрений);
- использование некоторых гербицидов, например 2,4-D (дихлорфеноксиуксусная кислота), и дефицит молибдена в почве нарушают обмен веществ в растениях, что приводит к накоплению нитратов.
Помимо растений, источниками нитратов и нитритов для человека являются мясные продукты, а также колбасы, рыба, сыры, в которые добавляют нитрит натрия или калия в качестве пищевой добавки — как консервант или для сохранения привычной окраски мясопродуктов, так как образующийся при этом NO-миоглобин сохраняет красную окраску даже после тепловой денатурации, что существенно улучшает внешний вид и товарные качества мясопродуктов.
Ниже представлены данные Института питания РАМН (М. Г. Рыбальский, А. И. Савицкий и др., 1994) по содержанию нитратов (в мг/кг) в продовольственном сырье и пищевых продуктах:
Овощи:
- Свекла 39–7771
- Репа 82–5429
- Редис 41–4527
- Редька 98–2731
- Kапуста свежая: ранняя 509–1010 поздняя 14–3467
- Kартофель 4–1218
- Морковь 15–900
- Огурцы: закрытый грунт 67–765 открытый грунт 48–258
- Kабачки 291–672
- Перец сладкий 10–517
- Томаты 3–365
- Баклажаны 42–284
- Kапуста квашеная 46–320
- Огурцы соленые 83–120
- Лук репчатый 0–150
- Укроп 30–4074
- Петрушка 388–2022
- Лук перо 71–1486
- Сельдерей 701–968
- Шпинат 621–2417
- Kинза 520–1240
- Щавель 53–875
- Дыня 3–120
- Арбуз 6–94
- Тыква 14–410
- Зерно: мягкой пшеницы 1,2–15
- твердой пшеницы 1,1–8,4
- Мука пшеничная 2,5–19,0
- Kонсервы овощемясные 47–320
- Соки консервированные:
- плодово-ягодные 0–56
- плодово-овощные 29–64
- овощные 10–108
- Фрукты и ягоды:
- Яблоки 2,7–55,0
- Груши 1,5–6,5
- Слива 2,5–3,1
- Хурма 2,9–4,3
- Облепиха 1,9–2,5
- Kлюква 2,5–3,3
- Черника 2,6–4,0
- Брусника 3,1–4,5
- Рябина черноплодная 2,6–3,0
- Молочные продукты:
- Молоко
- пастеризованное 1,1–14,0
- Kисломолочные
- продукты 0,5–6,0
- Творожные изделия 1,5–6,5
- Молоко сухое, цельное 1,0–35
- Сыры 1,5–2,0
- Мясные продукты:
- Говядина свежая 0–4,0
- Сосиски 2,5–3,9
- Kолбаса «Докторская» 2,4–5,8
- Свинина 1,4–5,4
- Мясо куриное 2,1–4,0
- Рыба свежая:
- речная 3–43
- морская 14–21
- Макароны 1,5–7,7
- Хлеб:
- свежий 1,9–6,7
- высушенный 0,9–8,1
Для предотвращения образования N-нитрозосоединений в организме человека реально лишь снизить содержание нитратов и нитритов, так как спектр нитрозируемых аминов и амидов слишком обширен. Существенное снижение синтеза нитрозосоединений может быть достигнуто путем добавления к пищевым продуктам аскорбиновой или изоаскорбиновой кислоты или их натриевых солей.
Регуляторы роста растений. Регуляторы роста растений (РРР) — это соединения различной химической природы, оказывающие влияние на процессы роста и развития растений и применяемые в сельском хозяйстве с целью увеличения урожайности, улучшения качества растениеводческой продукции, облегчения уборки урожая, а в некоторых случаях для увеличения сроков хранения растительных продуктов.
К этой группе можно отнести и некоторые гербициды (например, 2,4-D), которые в зависимости от концентрации могут проявлять и стимулирующее действие.
Регуляторы роста растений можно разделить на две группы: природные и синтетические.
Природные РРР — это естественные компоненты растительных организмов, которые выполняют функцию фитогормонов: ауксины, гиберрелины, цитокинины, абсцизовая кислота, эндогенный этилен и др. В процессе эволюции в организме человека выработались соответствующие механизмы биотрансформации, и поэтому природные РРР не представляют какой-либо опасности для организма человека.
Синтетические РРР — это соединения, являющиеся с физиологической точки зрения аналогами эндогенных фитогормонов, либо соединения, способные влиять на гормональный статус растений. Их получают химическим или микробиологическим путем. Наиболее важные РРР, выпускаемые промышленно под различными коммерческими названиями, в своей основе являются производными арилили арилоксиалифатических карбоновых кислот, индола, пиримидина, пиридазина, пирадола. Например, широко используются препараты — производные сульфанилмочевины.
Синтетические РРР, в отличие от природных, оказывают негативное влияние на организм человека как ксенобиотики. Однако степень опасности большинства РРР до конца не изучена, предполагается возможность их отрицательного влияния на внутриклеточный обмен за счет образования токсичных промежуточных соединений. Кроме того, некоторые синтетические РРР сами могут проявлять токсические свойства. Они обладают повышенной стойкостью в окружающей среде и в сельскохозяйственной продукции, где обнаруживаются в остаточных количествах. Это, в свою очередь, увеличивает их потенциальную опасность для здоровья человека.
2.7. Загрязнение веществами, применяемыми в животноводстве
С целью повышения продуктивности сельскохозяйственных животных, профилактики заболеваний, сохранения качества кормов в животноводстве широко применяются различные лекарственные и химические препараты. Это антибактериальные вещества (антибиотики, сульфаниламиды, нитрофураны), гормональные препараты, транквилизаторы, антиоксиданты и др.
Антибиотики. Встречающиеся в пищевых продуктах антибиотики могут иметь следующее происхождение:
- естественные антибиотики;
- образующиеся в результате производства пищевых продуктов;
- попадающие в пищевые продукты в результате лечебно-ветеринарных мероприятий;
- попадающие в пищевые продукты при использовании их в качестве биостимуляторов;
- применяемые в качестве консервирующих веществ.
К первой группе относятся природные компоненты некоторых пищевых продуктов с выраженным антибиотическим действием. Например, яичный белок, молоко, мед, лук, чеснок, фрукты, пряности содержат естественные антибиотики. Эти вещества могут быть выделены, очищены и использованы для консервирования пищевых продуктов и для лечебных целей.
Ко второй группе относятся вещества с антибиотическим действием, возникающие при микробно-ферментативных процессах. Например, при ферментации некоторых видов сыров.
Третья группа — антибиотики, попадающие в пищевые продукты в результате лечебно-ветеринарных мероприятий. В настоящее время около половины производимых в мире антибиотиков применяются в животноводстве. Антибиотики способны переходить в мясо животных, яйца птиц, другие продукты и оказывать токсическое действие на организм человека. Особое значение имеет загрязнение молока пенициллином, который очень широко используется для терапевтических целей в борьбе со стафилококковой инфекцией.
Четвертая группа — антибиотики-биостимуляторы, которые добавляют в корм для улучшения усвояемости кормов и стимуляции роста. При этом улучшается баланс азота и выравнивается дефицит витаминов группы В. В качестве биостимуляторов чаще всего используют хлортетрациклин и окситетрациклин:
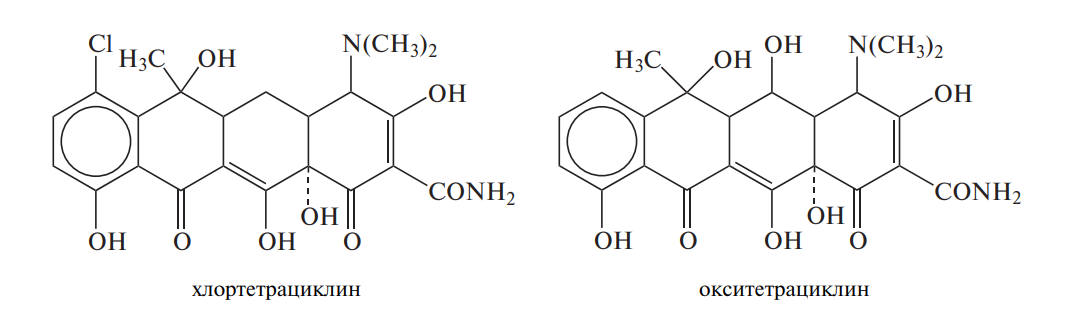
Действие антибиотиков заключается не в прямой стимуляции роста, а в снижении различных факторов, препятствующих росту, например в подавлении бактерий, мешающих усвоению кормов.
К пятой группе относятся антибиотики-консерванты, которые добавляют в пищевые продукты с целью предупреждения порчи последних. Для этой цели, как показали многочисленные исследования, наиболее приемлемы антибиотики из группы тетрациклинов (хлортетрациклин, террамицин). Кроме того, предлагается использовать пенициллин, стрептомицин, левомицетин, грамицидин при следующих видах обработки:
- орошение или погружение мяса в раствор антибиотика (так называемая акронизация);
- инъекции (внутривенно и внутримышечно);
- использование льда, содержащего антибиотик, — при транспортировке и хранении (используется в основном для рыбной продукции);
- добавка растворов антибиотиков к различным пищевым продуктам (молоку, сыру, овощным консервам, сокам, пиву);
- опрыскивание свежих овощей.
В некоторых странах применение антибиотиков в качестве консервантов запрещено.
Основная проблема применения антибиотиков как в ветеринарии, так и для кормовых целей заключается в развитии резистентности к широко применяемым антибиотикам, в результате чего кишечный тракт животных превращается в «резервуар» тетрациклин-резистентных и эритромицин-резистентных бактерий. В качестве путей борьбы с распространением такого рода резистентности можно назвать следующие:
- сокращение применения в сельском хозяйстве антибиотиков, применяемых в медицинской практике;
- поиск и внедрение в ветеринарию антибиотиков, имеющих иной механизм или иную структуру, отличную от медицинских антибиотиков.
Сульфаниламиды. Антимикробное действие сульфаниламидов менее эффективно, чем действие антибиотиков, но они дешевы и более доступны для борьбы с инфекционными заболеваниями животных. Сульфаниламиды способны накапливаться в организме животных и птицы и загрязнять животноводческую продукцию: мясо, молоко, яйца.
Наиболее часто обнаруживаются следующие сульфаниламиды: сульфаметазин, сульфадиметоксин, сульфахиноксазалин. Допустимый уровень загрязнения мясных продуктов препаратами этого класса — менее 0,1 мг/кг, молока и молочных продуктов — 0,01 мг/кг.
Нитрофураны. Наибольшую антибактериальную активность проявляют 5-нитро-2-замещенные фураны. Считается, что остатки этих лекарственных препаратов не должны содержаться в пище человека. В связи с этим отсутствуют ПДК этих препаратов. Однако имеются данные о загрязнении продуктов животноводства такими препаратами, как фуразолидон, нитрофуран, нитрофазол.
Гормональные препараты. Гормональные препараты используют в ветеринарии и животноводстве для улучшения усвояемости кормов, стимуляции роста животных, ускорения полового созревания. Ряд гормональных препаратов обладают ярко выраженной анаболитической активностью. Это и белковые, и полипептидные гормоны, а также стероидные гормоны, их производные и аналоги. Естественным следствием применения гормонов в животноводстве является проблема загрязнения ими продовольственного сырья и пищевых продуктов.
В настоящее время созданы синтетические гормональные препараты, которые по анаболитическому действию значительно эффективнее природных гормонов. Этот факт, а также дешевизна их синтеза определили интенсивное внедрение этих препаратов в практику животноводства. Однако, в отличие от природных аналогов, многие синтетические гормоны оказались более устойчивыми, они плохо метаболизируются, накапливаются в организме животных в больших количествах и передаются по пищевым цепям. Следует особо отметить, что синтетические гормональные препараты стабильны при приготовлении пищи и способны вызывать дисбаланс в обмене веществ и физиологических функциях организма человека. Медико-биологическими требованиями определены следующие допустимые уровни содержания гормональных препаратов в продуктах питания (в мг/кг, не более): мясо сельскохозяйственных животных, птицы (продукты их переработки) — эстрадиол 17β — 0,0005; тестостерон — 0,015; молоко, молочные продукты, казеин — эстрадиол 17β — 0,0002; масло коровье — эстрадиол 17β — 0,0005.
Транквилизаторы. Успокаивающие средства, бензгидрильные и бензгидроловые транквилизаторы, седативные и гипнотические препараты применяются с целью предупреждения стрессовых состояний у животных, например при транспортировке или перед забоем. Их применение должно проводиться под строгим контролем, так как они способны оказывать негативное воздействие на организм человека. Для того чтобы мясо не содержало остатков этих препаратов, они должны быть отменены не менее чем за 6 дней до забоя животного.
Антиоксиданты в пище животных. Различные синтетические вещества добавляют в корм животных для защиты окисляемых компонентов, причем в каждом конкретном случае их выбирают специально в зависимости от особенностей корма и степени окислительных процессов. Например: бутилгидроксианизол является наиболее применяемым антиоксидантом в неевропейских странах. Так, 50 % производимого в США свиного жира содержит это вещество; его используют в качестве пропитывающего вещества упаковочных материалов для хлопьев из зерновых, шоколадных изделий, кексов и др. (0,5 г на 1 кг упаковочного материала). Нередко бутилгидроксианизол применяют в смеси с другими антиокислителями: бутилгидрокситолуолом, пропилгаллатом, лимонной кислотой. Экспертный комитет ФАО/ВОЗ по пищевым добавкам установил ДСП (для группы из 4 антиоксидантов) — 3 г/кг массы тела.
Систематическое употребление продуктов питания, загрязненных антибиотиками, сульфаниламидами, гормональными препаратами, транквилизаторами и другими препаратами, ухудшает их качество, затрудняет проведение санитарно-ветеринарной экспертизы этих продуктов, приводит к возникновению резистентных форм микроорганизмов, является причиной дисбактериозов. Поэтому очень важно обеспечить необходимый контроль остаточных количеств этих загрязнителей в продуктах питания, используя для этого быстрые и надежные методы.
3. Природные токсиканты
Природные токсины, не уступающие по канцерогенной активности антропогенным ксенобиотикам, из-за широкой распространенности и очень высокой степени нагрузки на организм человека представляют огромный риск для здоровья населения планеты. Это касается не только развивающихся стран, но и стран с развитой рыночной экономикой.
При остром воздействии наибольшую опасность представляют бактериальные токсины. С точки зрения хронического воздействия и опасности отдаленных последствий на первое место по степени риска выходят микотоксины.
3.1. Бактериальные токсины
Бактериальные токсины загрязняют пищевые продукты и являются причиной острых пищевых интоксикаций. Рассмотрим наиболее часто регистрируемые интоксикации, связанные с поражением пищевых продуктов некоторыми бактериальными токсинами.
Staphylococcus aureus — грамположительные бактерии, которые являются причиной стафилококкового пищевого отравления. Продуцируют следующие энтеротоксины: А, В, С1, С2, D, E, которые представляют собой полипептиды с молекулярной массой 26 360–28 500 Да. Энтеротоксины S. aureus термостабильны и инактивируются лишь после 2–3-часового кипячения. Бактерицидным действием по отношению к стафилококкам обладают уксусная, лимонная, фосфорная, молочная кислоты при рН до 4,5. Кроме того, жизнедеятельность бактерий прекращается при концентрации соли (NaCl) — 12 %, сахара — 60–70 %, вакуумная упаковка также ингибирует рост бактерий. Все это необходимо учитывать в различных технологиях консервирования, как в промышленном масштабе, так и в домашних условиях.
Наиболее благоприятной средой для роста и развития стафилококков являются молоко, мясо и продукты их переработки, а также кондитерские кремовые изделия, в которых концентрация сахара составляет менее 50 %. Стафилококковые энтеротоксины являются причиной 27–45 % всех пищевых токсикоинфекций.
Clostridium botulinum продуцирует токсины, представляющие особую опасность для человека. Эти микроорганизмы являются облигатными анаэробами с термостабильными спорами. Различают А, В, С, D, E, F и G виды ботулотоксинов, причем наибольшей токсичностью обладают токсины А и Е. Ботулотоксины имеют белковую природу, молекулярная масса порядка 150 кДа.
Они поражают рыбные, мясные продукты, фруктовые, овощные и грибные консервы при недостаточной тепловой обработке и в условиях резкого снижения содержания кислорода (герметично закупоренные консервы). Кроме того, ботулотоксины характеризуются высокой устойчивостью к действию протеолитических ферментов, кислот, низких температур, но инактивируются под влиянием щелочей и высоких температур (80 °С — 30 мин; 100 °С — 15 мин).
Ботулизм встречается довольно часто (500–600 случаев в год), летальность достигает порядка 7–9 %.
К токсинообразующим микроорганизмам, вызывающим пищевые отравления у человека, относятся также Clostridium perfringens — спорообразующие анаэробные грамположительные бактерии, которые продуцируют большое число энтеротоксинов.
Патогенные штаммы Escherichia coli являются продуцентами термостабильных токсинов полипептидной природы с молекулярной массой от 4 до 10 кДа и способны вызывать как острые токсиноинфекции, так и являться причиной хронической интоксикации, в частности являться причиной хронической почечной недостаточности.
Сырое молоко, мясо и мясные продукты, а также вода могут быть причиной возникновения заболеваний, связанных с присутствием патогенных штаммов E. сoli.
3.2. Микотоксины
Микотоксины (от греч. mukes — гриб и toxicon — яд) — это вторичные метаболиты микроскопических плесневых грибов, обладающие выраженными токсическими свойствами. Они не являются эссенциальными для роста и развития продуцирующих их микроорганизмов.
В настоящее время из кормов и продуктов питания выделено около 250 видов плесневых грибов, большинство из которых продуцирует высокотоксичные метаболиты, в том числе около 120 микотоксинов. Предполагают, что с биологической точки зрения микотоксины выполняют в обмене веществ микроскопических грибов функции, направленные на выживание и конкурентоспособность в различных экологических нишах. С гигиенических позиций — это особо опасные токсические вещества, загрязняющие корма и пищевые продукты. Высокая опасность микотоксинов выражается в том, что они обладают токсическим эффектом в чрезвычайно малых количествах и способны весьма интенсивно диффундировать вглубь продукта.
В настоящее время еще не сформирована единая классификация и номенклатура микотоксинов. В одних случаях в основу группового деления микотоксинов положена их химическая структура, в других — характер действия, в третьих — видовая принадлежность грибов-продуцентов.
Афлатоксины. Афлатоксины представляют собой одну из наиболее опасных групп микотоксинов, обладающих сильными канцерогенными свойствами.
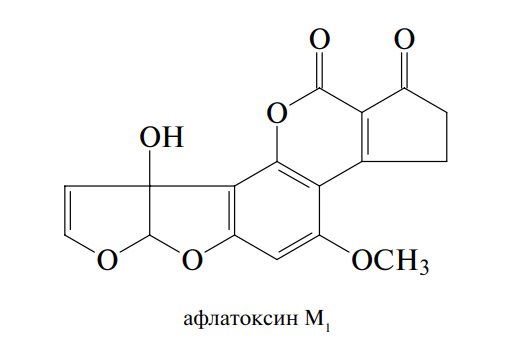
Структура и продуценты афлатоксино в. В настоящее время семейство афлатоксинов включает четыре основных представителя (афлатоксины B1, B2, G1, G2) и еще более 10 соединений, являющихся производными или метаболитами основной группы (M1, M2, B2a, G2a, GM1, P1, Q1 и др.).
По химической структуре афлатоксины являются фурокумаринами. Это видно из приведенных ниже структурных формул:
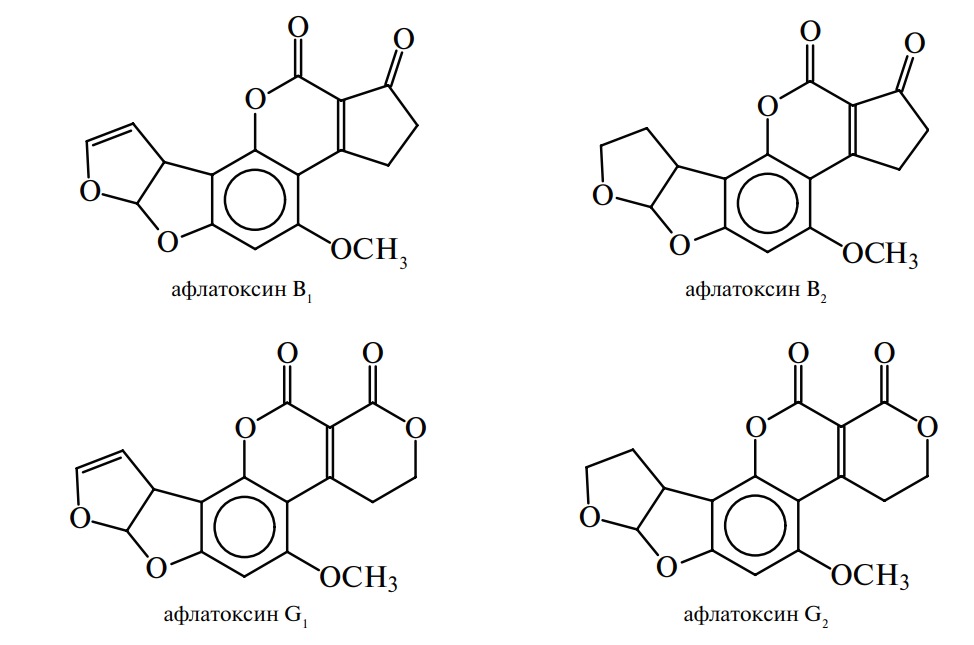
Продуцентами афлатоксинов являются некоторые штаммы двух видов микроскопических грибов: Aspergillus flavus (Link.) и Aspergillus parasiticus (Speare).
Физико-химические свойства афлатоксино в. Афлатоксины обладают способностью сильно флуоресцировать при воздействии длинноволнового ультрафиолетового излучения. Афлатоксины В1 и В2 обладают сине-голубой флуоресценцией, G1 и G2 — зеленой флуоресценцией, М1 и М2 — сине-фиолетовой. Это свойство лежит в основе практически всех физико-химических методов их обнаружения и количественного определения.
Афлатоксины слаборастворимы в воде (10–20 мкг/мл), нерастворимы в неполярных растворителях, но легко растворяются в растворителях средней полярности, таких как хлороформ, метанол и др. В химически чистом виде они относительно нестабильны и чувствительны к действию воздуха и света, особенно к ультрафиолетовому облучению. Растворы афлатоксинов стабильны в хлороформе и бензоле в течение нескольких лет при хранении в темноте и на холоде.
Следует обратить особое внимание на то, что афлатоксины практически не разрушаются в процессе обычной кулинарной и технологической обработки загрязненных пищевых продуктов.
Факторы, влияющие на токсинообразовани е. Продуценты афлатоксинов — микроскопические грибы рода Aspergillus могут достаточно хорошо развиваться и образовывать токсины на различных естественных субстратах (продовольственное сырье, пищевые продукты, корма), причем не только в странах с тропическим и субтропическим климатом, как полагали ранее, но практически повсеместно, за исключением, быть может, наиболее холодных районов Северной Европы и Канады.
Оптимальной температурой для образования токсинов является температура 27–30 °С, хотя синтез афлатоксинов возможен и при более низкой (12–13 °С), и при более высокой (40–42 °С) температуре. Например, в условиях производственного хранения зерна максимальное образование афлатоксинов происходит при температуре 35–45 °С, что значительно превышает температурный оптимум, установленный в лабораторных условиях.
Другим критическим фактором, определяющим рост микроскопических грибов и синтез афлатоксинов, является влажность субстрата и атмосферного воздуха. Максимальный синтез токсинов наблюдается обычно при влажности выше 18 % для субстратов, богатых крахмалом (пшеница, ячмень, рожь, овес, рис, кукуруза, сорго), и выше 9–10 % — для субстратов с высоким содержанием липидов (арахис, подсолнечник, семена хлопчатника, различные виды орехов). При относительной влажности атмосферного воздуха ниже 85 % синтез афлатоксинов прекращается.
Биологическое действие афлатоксино в. Действие афлатоксинов на организм животных и человека может быть охарактеризовано с двух позиций. Во-первых, с точки зрения острого токсического действия и, во-вторых, с точки зрения оценки опасности отдаленных последствий. Острое токсическое действие афлатоксинов связано с тем, что они являются одними из наиболее сильных гепатропных ядов, органом-мишенью которых является печень. Отдаленные последствия действия афлатоксинов проявляются в виде канцерогенного, мутагенного и тератогенного эффектов.
Механизм действия афлатоксино в. Афлатоксины или их активные метаболиты действуют практически на все компоненты клетки. Афлатоксины нарушают проницаемость плазматических мембран. В ядрах они связываются с ДНК, ингибируют репликацию ДНК, ингибируют активность ДНК-зависимой-РНК-полимеразы — фермента, осуществляющего синтез матричной РНК, и тем самым подавляют процесс транскрипции. В митохондриях афлатоксины вызывают повышение проницаемости мембран, блокируют синтез митохондриальных ДНК и белка, нарушают функционирование системы транспорта электронов, вызывая тем самым энергетический голод клетки. В эндоплазматическом ретикулуме под воздействием афлатоксинов наблюдаются патологические изменения: ингибируется белковый синтез, нарушается регуляция синтеза триглицеридов, фосфолипидов и холестерина. Афлатоксины оказывают прямое действие на лизосомы, что приводит к повреждению их мембран и высвобождению активных гидролитических ферментов, которые, в свою очередь, расщепляют клеточные компоненты.
Все вышеперечисленные нарушения приводят к так называемому метаболистическому хаосу и гибели клетки.
Одним из важных доказательств реальной опасности афлатоксинов для здоровья человека явилось установление корреляции между частотой и уровнем загрязнения пищевых продуктов афлатоксинами и частотой первичного рака печени среди населения.
Загрязнение пищевых продуктов афлатоксинам и. Как уже отмечалось, продуценты афлатоксинов встречаются повсеместно и этим объясняются значительные масштабы загрязнения кормов и пищевых продуктов и их существенная роль в создании реальной опасности для здоровья человека.
Частота обнаружения и уровень загрязнения афлатоксинами в значительной степени зависят от географических и сезонных факторов, а также от условий выращивания, уборки и хранения сельскохозяйственной продукции.
В природных условиях чаще и в наибольших количествах афлатоксины обнаруживаются в арахисе, кукурузе, семенах хлопчатника. Кроме того, в значительных количествах они могут накапливаться в различных орехах, семенах масличных культур, пшенице, ячмене, зернах какао и кофе.
В кормах, предназначенных для сельскохозяйственных животных, афлатоксины также обнаруживаются достаточно часто и в значительных количествах. Во многих странах с этим связано и обнаружение афлатоксинов в продуктах животного происхождения. Например, в молоке и тканях сельскохозяйственных животных, получавших корма, загрязненные микотоксинами, обнаружен афлатоксин М1. Причем афлатоксин М1 обнаружен как в цельном, так и в сухом молоке и даже в молочных продуктах, подвергшихся технологической обработке (пастеризация, стерилизация, приготовление творога, йогурта, сыров и т. п.).
Детоксикация загрязненных пищевых продуктов и кормо в. Установление высокой токсичности и канцерогенности афлатоксинов и обнаружение их в значительных количествах в основных пищевых продуктах во всем мире привело к необходимости разработки эффективных методов детоксикации сырья, пищевых продуктов и кормов.
В настоящее время с этой целью применяют комплекс мероприятий, которые можно разделить на механические, физические и химические методы детоксикации афлатоксинов. Механические методы детоксикации связаны с отделением загрязненного сырья (материала) вручную или с помощью электронно-колориметрических сортировщиков. Физические методы основаны на достаточно жесткой термической обработке материала (например, автоклавирование), а также связаны с ультрафиолетовым облучением и озонированием. Химический метод предполагает обработку материала сильными окислителями. К сожалению, каждый из названных методов имеет свои существенные недостатки: применение механических и физических методов не дает высокого эффекта, а химические методы приводят к разрушению не только афлатоксинов, но и полезных нутриентов и, кроме этого, нарушают их всасывание.
Согласно данным ВОЗ, человек при благоприятной гигиенической ситуации потребляет с суточным рационом до 0,19 мкг афлатоксинов. В России приняты следующие санитарно-гигиенические нормативы по афлатоксинам: ПДК афлатоксина В1 для всех пищевых продуктов, кроме молока, составляет 5 мкг/кг, для молока и молочных продуктов — 1 мкг/кг (для афлатоксина М1 — 0,5 мкг/кг). Допустимая суточная доза (ДСД) — 0,005–0,01 мкг/кг массы тела.
Охратоксины. Охратоксины — соединения высокой токсичности, с ярко выраженным тератогенным эффектом.
Структура и продуценты охратоксино в. Охратоксины А, В, С представляют собой группу близких по структуре соединений, являющихся изокумаринами, связанными с L-фенилаланином пептидной связью.
В зависимости от природы радикалов R и R образуются охратоксины различных типов:
R’ R»
Охратоксин А . . . . . . . . Cl . . . . . . . . . . . .H
Охратоксин В . . . . . . .. .H . . . . . . . . . . . .H
Охратоксин С . . . . . . .. . Cl . . . . . . . . . . . .C2H5
Продуцентами охратоксинов являются микроскопические грибы рода Aspergillus и Penicillium. Основными продуцентами являются A. оchraceus и P. viridicatum. Многочисленными исследованиями показано, что природным загрязнителем чаще всего является охратоксин А, в редких случаях охратоксин В.
Физико-химические свойств а. Охратоксин А — бесцветное кристаллическое вещество, слабо растворимое в воде, умеренно растворимое в полярных органических растворителях (метанол), а также в водном растворе гидрокарбоната натрия. В химически чистом виде он нестабилен и очень чувствителен к воздействию света и воздуха, однако в растворе этанола может сохраняться без изменений в течение длительного времени. В ультрафиолетовом свете обладает зеленой флуоресценцией. Охратоксин В — кристаллическое вещество, аналог охратоксина А, не содержащий атом хлора. Он примерно в 50 раз менее токсичен, чем охратоксин А. В ультрафиолетом свете обладает голубой флуоресценцией. Охратоксин С — аморфное вещество, этиловый эфир охратоксина А
близок к нему по токсичности, но в качестве природного загрязнителя пищевых продуктов и кормов не обнаружен. В ультрафиолетовом свете обладает бледно-зеленой флуоресценцией.
Биологическое действи е. Охратоксины входят в группу микотоксинов, преимущественно поражающих почки. При остром токсикозе, вызванном охратоксинами, патологические изменения выявляются и в печени, и в лимфоидной ткани, и в желудочно-кишечном тракте. В настоящее время уже доказано, что охратоксин А обладает сильным тератогенным действием. Вопрос о канцерогенности охратоксинов для человека остается нерешенным.
Механизм действия охратоксино в. Биохимические, молекулярные, клеточные механизмы действия охратоксинов изучены недостаточно. В исследованиях in vitro показано, что они активно связываются с различными белками: альбуминами сыворотки крови, тромбином, альдолазой, каталазой, аргиназой, карбоксипептидазой А. Некоторые моменты подтверждены и в исследованиях in vivo. Результаты изучения влияния охратоксинов на синтез макромолекул свидетельствуют о том, что охратоксин А ингибирует синтез белка и матричной РНК (токсин действует как конкурентный ингибитор), но не действует на синтез ДНК.
Загрязнение пищевых продукто в. Основными растительными субстратами, в которых обнаруживаются охратоксины, являются зерновые культуры и среди них, в первую очередь, кукуруза, пшеница, ячмень. С сожалением приходится констатировать тот факт, что уровень загрязнения кормового зерна и комбикормов выше среднего во многих странах (Канада, Польша, Югославия, Австрия), в связи с чем охратоксин А был обнаружен в животноводческой продукции (ветчина, бекон, колбасы). С практической точки зрения весьма важно, что охратоксины являются стабильными соединениями. Так, например, при длительном прогревании пшеницы, загрязненной охратоксином А, его содержание снижалось лишь на 32 % (при температуре 250–300 °С).
Все вышеперечисленное не оставляет сомнений в том, что охратоксины создают реальную опасность для здоровья человека.
Трихотеценовые микотоксины. В настоящее время известно более 40 трихотеценовых микотоксинов (ТТМТ), вторичных метаболитов различных представителей микроскопических грибов рода Fusarium.
Структура и продуценты ТТМ Т. По своей структуре ТТМТ относятся к сесквитерпенам. Они содержат основное ядро из трех колец, названное трихотеканом. В зависимости от структуры трихотеценового ядра эти микотоксины подразделяются на 4 группы: А, В, С, D. Структура различных типов трихотеценовых микотоксинонов очень сложна и имеет характерные особенности, что наглядно демонстрируют приведенные ниже структурные формулы ТТМТ:
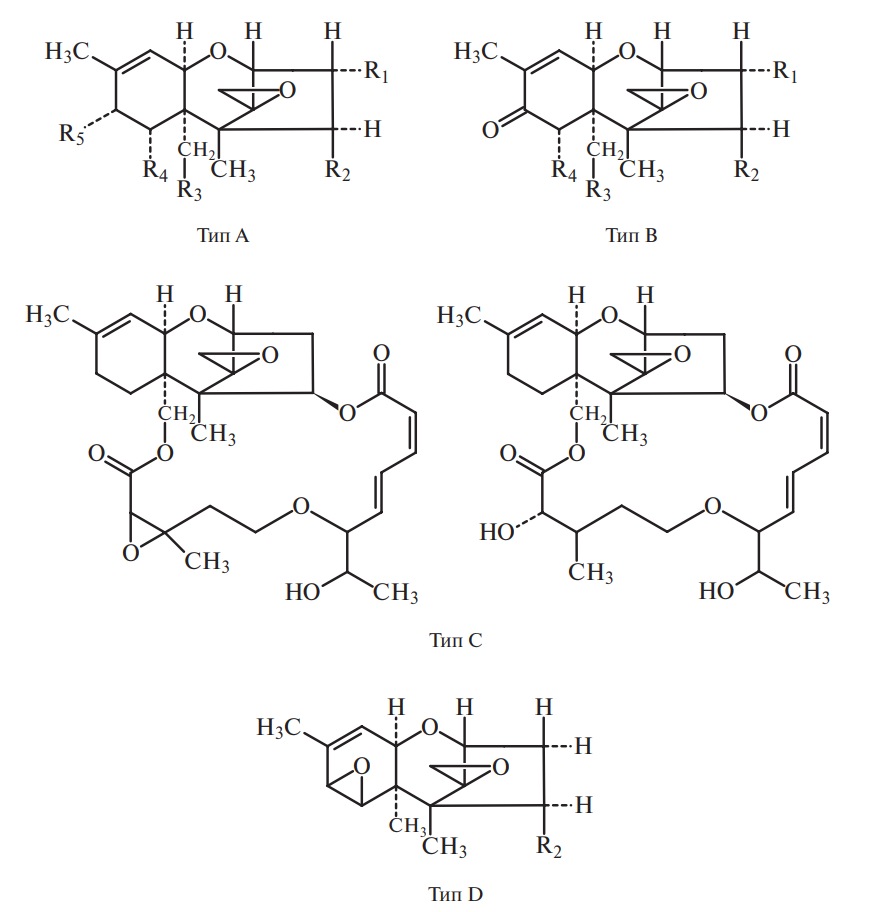
В качестве природных загрязнителей пищевых продуктов и кормов к настоящему времени выявлены только четыре: Т-2 токсин и диацетоксискирпенол, относящиеся к типу А, а также ниваленол и дезоксиниваленол, относящиеся к типу В. Природа радикалов у этих четырех природных загрязнителей такова:
Продуцентами ТТМТ типа А и В, обладающих высокой токсичностью, являются многие грибы рода Fusarium. Микроскопические грибы этого рода являются возбудителями так называемых гнилей корней, стеблей, листьев, семян, плодов, клубней и сеянцев сельскохозяйственных растений. Таким образом поражаются корма и пищевые продукты и, как следствие, наблюдается возникновение алиментарных токсикозов у животных и человека.
Физико-химические свойств а. ТТМТ — это бесцветные кристаллические, химически стабильные соединения, плохо растворимые в воде. ТТМТ типа А растворимы в умеренно полярных растворителях (ацетон), типа В — в более полярных растворителях (этанол, метанол и др.). Эти токсины, за исключением некоторых, не обладают флюоресценцией. В связи с этим для их обнаружения, после разделения методом тонкослойной хроматографии, используют различные способы (например, нагревание до 100–150 °С после обработки спиртовым раствором серной кислоты) с целью получения окрашенных или флуоресцирующих производных.
Биологическое действие ТТМ Т. Алиментарные токсикозы, вызванные потреблением в пищу продуктов и кормов, пораженных микроскопическими грибами, продуцирующими ТТМТ, можно отнести к наиболее распространенным микотоксикозам человека и сельскохозяйственных животных. Первые сведения о такого рода заболеваниях появились более ста лет тому назад.
Хорошо известен токсикоз «пьяного хлеба» — заболевание человека и животных, причиной которого послужило употребление зерновых продуктов (главным образом хлеба), приготовленных из зерна, пораженного грибами Fusarium graminearum (F. roseum). Кроме того, описан целый ряд тяжелых токсикозов, таких как акабаби-токсикоз (вызывается красной плесенью и связан с поражением зерна грибами F. nivale и F. graminearum), алиментарная токсическая алейкия — АТА (токсикоз, связанный с употреблением в пищу продуктов из зерновых культур, перезимовавших в поле под снегом и пораженных микроскопическими грибами F. sporotrichiella) и многие другие, приводящие к серьезному нарушению здоровья людей и протекающие по типу эпидемий, то есть характеризующиеся определенной очаговостью, сезонностью, неравномерностью вспышек в разные годы и употреблением продуктов из зерна, пораженного микроскопическими грибами.
Механизм действия ТТМ Т. Многочисленными исследованиями in vitro и in vivo было показано, что ТТМТ являются ингибиторами синтеза белков и нуклеиновых кислот, кроме этого, вызывают нарушения стабильности лизосомных мембран и активацию ферментов лизосом, что в конечном счете приводит к гибели клетки.
Загрязнение пищевых продукто в. Как отмечалось выше, в качестве природных загрязнителей пищевых продуктов и кормов обнаружены лишь четыре из более чем четырех десятков трихотеценовых микотоксинов. Чаще всего они обнаруживаются в зерне кукурузы, пшеницы и ячменя. Микотоксины этой группы отличаются повсеместным распространением, причем в большей степени это касается многих стран Европы, Северной Америки, в меньшей — Индии, Японии, Южной Америки. Необходимо отметить, что часто в одном и том же продукте обнаруживают два или более микотоксинов.
Зеараленон и его производные. Зеараленон и его производные также продуцируются микроскопическими грибами рода Fusarium. Он впервые был выделен из заплесневелой кукурузы.
Структура и продуценты зеараленон а. По своей структуре зеараленон является лактоном резорциловой кислоты. Природный зеараленон имеет трансконфигурацию, его структурная формула имеет следующий вид:
Основными продуцентами зеараленона являются Fusarium graminearum (F. roseum).
Физико-химические свойств а. Зеараленон — белое кристаллическое вещество, плохо растворимое в воде, но хорошо растворимое в этаноле, ацетоне, метаноле, бензоле. Имеет три максимума поглощения в ультрафиолете (236, 274, 316 нм) и обладает сине-зеленой флуоресценцией. Биологическое действи е. Зеараленон обладает выраженными гормоноподобными (экстрогенными) свойствами, что отличает его от других микотоксинов. Кроме этого, в опытах на различных лабораторных животных было доказано тератогенное действие зеараленона, хотя он и не обладает острым (летальным) токсическим эффектом даже при введении его животным в очень больших дозах. Сведения о влиянии зеараленона на организм человека отсутствуют, но, учитывая его высокую экстрогенную активность, нельзя полностью исключить негативное воздействие зеараленона на организм человека.
Загрязнение пищевых продукто в. Основным природным субстратом, в котором наиболее часто обнаруживается зеараленон, является кукуруза. Поражение кукурузы микроскопическими грибами рода Fusarium — продуцентами зеараленона — происходит как в поле, на корню, так и при ее хранении. Высока частота обнаружения зеараленона в комбикормах, а также в пшенице и ячмене, овсе. Среди пищевых продуктов этот токсин был обнаружен в кукурузной муке, хлопьях и кукурузном пиве.
С практической точки зрения интересными представляются данные по влиянию переработки зерна кукурузы на степень загрязнения зеараленоном. В крупке и муке грубого помола, без удаления отрубей, в муке, полученной при сухом помоле кукурузы, содержание зеараленона составляло примерно 20 % от его количества в цельном зерне. При влажном помоле загрязненной кукурузы токсин концентрировался во фракции клейковины, где его концентрация была выше, чем в отрубях и зародыше; во фракции крахмала токсин не выявлялся.
Тепловая обработка в нейтральной или кислой среде не разрушает зеараленон, но в щелочной среде при 100 °С за 60 мин разрушается около 50 % токсина. К разрушению зеараленона приводит и обработка загрязненной кукурузы 0,03 %-ным раствором персульфата аммония или 0,01 %-ным раствором пероксида водорода.
Патулин и некоторые другие микотоксины. Микотоксины, продуцируемые микроскопическими грибами рода Penicillium, распространены повсеместно и представляют реальную опасность для здоровья человека. Патулин — особо опасный микотоксин, обладающий канцерогенными и мутагенными свойствами.
Структура и продуценты патулина. По своей химической структуре патулин представляет 4-гидроксифуропиран. Он имеет один максимум поглощения в ультрафиолетовой области при 276 нм.
Основными продуцентами патулина являются микроскопические грибы Penicillium patulum и Penicillium expansu. Но и другие виды этого рода микроскопических грибов, а также Byssochlamys fulva и B. nivea способны синтезировать патулин. Максимальное токсинообразование отмечается при температуре 21–30 °С.
Биологическое действи е. Биологическое действие патулина проявляется как в виде острых токсикозов, так и в виде ярко выраженных канцерогенных и мутагенных эффектов. Биохимические механизмы действия патулина изучены недостаточно. Предполагают, что патулин блокирует синтез ДНК, РНК и белков, причем блокирование инициации транскрипции осуществляется за счет ингибирования ДНК-зависимойРНК-полимеразы. Кроме этого, микотоксин активно взаимодействует с SH-группами белков и подавляет активность тиоловых ферментов.
Загрязнение пищевых продукто в. Продуценты патулина поражают в основном фрукты и некоторые овощи, вызывая их гниение. Патулин обнаружен в яблоках, грушах, абрикосах, персиках, вишне, винограде, бананах, клубнике, голубике, бруснике, облепихе, айве, томатах. Наиболее часто патулином поражаются яблоки, где содержание токсина может доходить до 17,5 мг/кг. Интересно, что патулин концентрируется в основном в подгнившей части яблока, в отличие от томатов, где он распределяется равномерно по всей ткани.
Патулин в высоких концентрациях обнаруживается и в продуктах переработки фруктов и овощей: соках, компотах, пюре и джемах. Особенно часто его находят в яблочном соке (0,02–0,4 мг/л). Содержание патулина в других видах соков: грушевом, айвовом, виноградном, сливовом, манго — колеблется от 0,005 до 4,5 мг/л. Интересным представляется тот факт, что цитрусовые и некоторые овощные культуры, такие как картофель, лук, редис, редька, баклажаны, цветная капуста, тыква и хрен обладают естественной устойчивостью к заражению грибами-продуцентами патулина.
Среди микотоксинов, продуцируемых микроскопическими грибами рода Penicillium и представляющих серьезную опасность для здоровья человека, необходимо выделить лютеоскирин, циклохлоротин, цитреовиридин и цитринин.
Лютеоскирин (продуцент Penicillium islandicum) — желтое кристаллическое вещество, выделен из долго хранившегося риса, а также пшеницы, сои, арахиса, бобовых и некоторых видов перца. Механизм токсического действия связан с ингибированием ферментов дыхательной цепи (печени, почках, миокарде), а также с подавлением процессов окислительного фосфорилирования.
Циклохлоротин (продуцент Penicillium islandicum) — белое кристаллическое вещество, циклический пептид, содержащий хлор. Биохимические механизмы токсического действия направлены на нарушение углеводного и белкового обмена и связаны с ингибированием целого ряда ферментов. Кроме этого, токсическое действие циклохлоротина проявляется в нарушении регуляции проницаемости биологических мембран и процессов окислительного фосфорилирования.
Цитреовиридин (продуцент Penicillium citreoviride) — желтое кристаллическое вещество, выделен из пожелтевшего риса. Обладает нейротоксическими свойствами.
Цитринин (продуцент Penicillium citrinum) — кристаллическое вещество желтого цвета, выделен из пожелтевшего риса. Цитринин часто обнаруживается в различных зерновых культурах: пшенице, ячмене, овсе, ржи, а также в кукурузе и арахисе. Кроме этого, незначительные количества цитринина были найдены в хлебобулочных изделиях, мясных продуктах и фруктах. Обладает выраженными нефротоксическими свойствами.
3.3. Методы определения микотоксинов и контроль за загрязнением пищевых продуктов
Методы определения микотоксинов. Современные методы обнаружения и определения содержания микотоксинов в пищевых продуктах и кормах включают скрининг-методы, количественные аналитические и биологические методы.
Скрининг-методы отличаются быстротой и удобны для проведения серийных анализов, позволяют быстро и надежно разделять загрязненные и незагрязненные образцы. К ним относятся такие широко распространенные методы, как миниколоночный метод определения афлатоксинов, охратоксина А и зеараленона; методы тонкослойной хроматографии (ТСХ-методы) для одновременного определения до 30 различных микотоксинов, флуоресцентный метод определения зерна, загрязненного афлатоксинами, и некоторые другие.
Количественные аналитические методы определения микотоксинов представлены химическими, радиоиммунологическими и иммуноферментными методами. Химические методы являются в настоящее время наиболее распространенными и состоят из двух стадий: стадии выделения и стадии количественного определения микотоксинов. Стадия выделения включает экстракцию (отделение микотоксина от субстрата) и очистку (отделение микотоксина от соединений с близкими физико-химическими характеристиками). Окончательное разделение микотоксинов проводится с помощью различных хроматографических методов, таких как газовая (ГХ) и газожидкостная хроматография (ГЖХ), тонкослойная хроматография (ТСХ), высокоэффективная жидкостная хроматография (ВЭЖХ) и масс-спектрометрия. Количественную оценку содержания микотоксинов проводят путем сравнения интенсивности флуоресценции при ТСХ в ультрафиолетовой области спектра со стандартами. Для подтверждения достоверности полученных результатов применяют различные тесты, основанные на получении производных микотоксинов с иными хроматографическими, колориметрическими или флюорометрическими характеристиками.
Высокочувствительные и высокоспецифичные радиоиммуно-химические и иммуноферментные методы обнаружения, идентификации и количественного определения микотоксинов находят все более широкое применение и пользуются повышенным вниманием со стороны исследователей. Эти методы основаны на получении антисывороток к конъюгатам микотоксинов с бычьим сывороточным альбумином. Основным преимуществом этих методов является их исключительная чувствительность.
Биологические методы обычно не отличаются высокой специфичностью и чувствительностью и применяются главным образом в тех случаях, когда отсутствуют химические методы выявления микотоксинов или в дополнение к ним в качестве подтверждающих тестов. В качестве тест-объектов используют различные микроорганизмы, куриные эмбрионы, различные лабораторные животные, культуры клеток и тканей.
Контроль за загрязнением микотоксинами. В настоящее время вопросы контроля за загрязнением продовольственного сырья, пищевых продуктов и кормов микотоксинами решаются не только в рамках отдельных государств, но и на международном уровне под эгидой ВОЗ и ФАО.
В системе организации контроля за загрязнением продовольственного сырья и пищевых продуктов можно выделить два уровня: инспектирование и мониторинг, которые включают регулярные количественные анализы продовольственного сырья и пищевых продуктов.
Мониторинг позволяет установить уровень загрязнения, оценить степень реальной нагрузки и опасности, выявить пищевые продукты, являющиеся наиболее благоприятным субстратом для микроскопических грибов — продуцентов микотоксинов, а также подтвердить эффективность проводимых мероприятий по снижению загрязнения микотоксинами. Особое значение имеет контроль за загрязнением микотоксинами при характеристике качества сырья и продуктов, импортируемых из других стран.
С целью профилактики алиментарных токсикозов основное внимание следует уделять зерновым культурам. В связи с этим необходимо соблюдать следующие меры по предупреждению загрязнения зерновых культур и зернопродуктов:
- Своевременная уборка урожая с полей, его правильная агротехническая обработка и хранение.
- Санитарно-гигиеническая обработка помещений и емкостей для хранения.
- Закладка на хранение только кондиционного сырья.
- Определение степени загрязнения сырья и готовых продуктов.
- Выбор способа технологической обработки в зависимости от вида и степени загрязнения сырья.
Основные пути загрязнения продовольственного сырья и пищевых продуктов токсичными штаммами микромицетов приведены на рис. 7.
Рис. 7. Пути загрязнения пищевых продуктов токсичными штаммами микромицетов и микотоксинами (Р. Д. Габович и др., 1988)
4. Антиалиментарные факторы питания
Помимо чужеродных соединений, загрязняющих пищевые продукты, так называемых контаминантов-загрязнителей, и природных токсикантов, необходимо учитывать действие веществ, не обладающих общей токсичностью, но способных избирательно ухудшать или блокировать усвоение нутриентов. Эти соединения принято называть а нтиалиментарными факторами питани я. Этот термин распространяется только на вещества природного происхождения, которые являются составными частями натуральных продуктов питания.
Перечень антиалиментарных факторов питания достаточно обширен.
Остановимся на рассмотрении некоторых из них.
Ингибиторы пищеварительных ферментов. К этой группе относятся вещества белковой природы, блокирующие активность пищеварительных ферментов (пепсин, трипсин, химотрипсин, -амилаза). Белковые ингибиторы обнаружены в семенах бобовых культур (соя, фасоль и др.), злаковых (пшеница, ячмень и др.), в картофеле, яичном белке и других продуктах растительного и животного происхождения.
Механизм действия этих соединений заключается в образовании стойких комплексов «фермент–ингибитор», подавлении активности главных пищеварительных ферментов и тем самым снижении усвоения белковых веществ и других макронутриентов.
К настоящему времени белковые ингибиторы достаточно хорошо изучены и подробно охарактеризованы: расшифрована первичная структура, изучено строение активных центров ингибиторов, исследован механизм действия ингибиторов и т. п.
На основании структурного сходства все белки-ингибиторы растительного происхождения можно разделить на несколько групп, основными из которых являются следующие.
- Семейство соевого ингибитора трипсина (ингибитора Кунитца).
- Семейство соевого ингибитора Баумана–Бирка.
- Семейство картофельного ингибитора I.
- Семейство картофельного ингибитора II.
- Семейство ингибиторов трипсина/-амилазы.
Ингибитор Кунитца был впервые выделен из семян сои еще в 1946 г. Его молекулярная масса 20 100 Да. Молекула ингибитора состоит из 181 аминокислотного остатка и содержит две дисульфидные связи в положении цис (39) — цис (86) и цис (136) — цис (145). Трипсиносвязывающий реактивный центр включает остаток аргинина, связанный пептидной связью с остатком изолейцина: арг (63) — иле (64), поэтому ингибиторы этого семейства также называют трипсиновыми ингибиторами аргининового типа.
Ингибитор Баумана–Бирка был впервые выделен также в 1946 г. из семян сои. Ингибитор эффективно подавляет активность трипсина и химотрипсина, причем с одной молекулой ингибитора могут связываться молекулы обоих ферментов. Ингибитор Баумана–Бирка — первый описанный «двухглавый» (или двухцентровой) ингибитор сериновых протеиназ. Его молекулярная масса примерно 8000 дальтон. Молекула ингибитора состоит из 71 аминокислотного остатка. Особенностью аминокислотного состава является высокое содержание остатков цистеина (7 на одну молекулу) и отсутствие остатков глицина и триптофана. Обращает на себя внимание, что молекула ингибитора Баумана–Бирка состоит из двух частей, сходных по структуре (доменов), которые соединены между собой короткими полипептидными цепочками. Реактивный центр, ответственный за связывание трипсина, локализован в первом домене и содержит пептидную связь: лиз (16) — сер (17); а реактивный центр, ответственный за связывание химотрипсина, находится во втором домене и содержит пептидную связь: лей (43) — сер (44), поэтому ингибиторы этого семейства иногда называют ингибиторами лизинового типа.
В клубнях картофеля содержится целый набор ингибиторов химотрипсина и трипсина, которые отличаются по своим физико-химическим свойствам: молекулярной массе, особенностям аминокислотного состава, изоэлектрическим точкам, термо- и рН-стабильности и т. п. Кроме картофеля, белковые ингибиторы обнаружены в других пасленовых, а именно в томатах, баклажанах, табаке. Наряду с ингибиторами сериновых протеиназ в них обнаружены и белковые ингибиторы цистеиновых, аспартильных протеиназ, а также металлоэкзопептидаз.
Заслуживает внимания и тот факт, что в семенах растений и в клубнях картофеля находятся «двухглавые» ингибиторы, способные одновременно связываться и ингибировать протеазу и -амилазу. Такие белковые ингибиторы были выделены из риса, ячменя, пшеницы, тритикале, ржи.
Рассматриваемые белковые ингибиторы растительного присхождения характеризуются высокой термостабильностью, что в целом не характерно для веществ белковой природы. Например, полное разрушение соевого ингибитора трипсина достигается лишь 20-минутным автоклавированием при 115 °С или кипячением соевых бобов в течение 2–3 ч. Из этого следует, что употребление семян бобовых культур, особенно богатых белковыми ингибиторами пищеварительных ферментов, как для корма сельскохозяйственных животных, так и в пищевом рационе человека, возможно лишь после соответствующей тепловой обработки.
Цианогенные гликозиды. Цианогенные гликозиды — это гликозиды некоторых цианогенных альдегидов и кетонов, которые при ферментативном или кислотном гидролизе выделяют синильную кислоту HCN, вызывающую поражение нервной системы.
Из представителей цианогенных гликозидов целесообразно отметить лимарин, содержащийся в белой фасоли, и амигдалин, который обнаруживается в косточках миндаля (до 8 %), персиков, слив, абрикос (от 4 до 6 %).
Амигдалин представляет собой сочетание дисахарида гентиобиозы и агликона, включающего остаток синильной кислоты и бензальдегида.
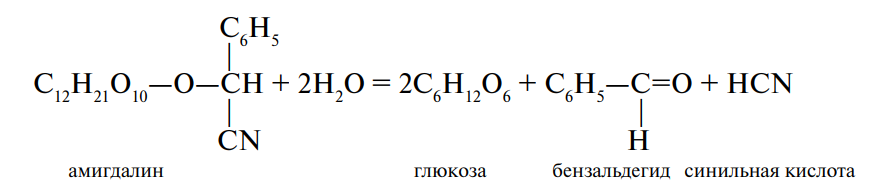
Биогенные амины. К соединениям этой группы относятся серотонин, тирамин, гистамин.
Серотонин главным образом содержится во фруктах и овощах. Например, содержание серотонина в томатах — 12 мг/кг; в сливе — до 10 мг/кг. Тирамин чаще всего обнаруживается в ферментированных продуктах, например в сыре его до 1100 мг/кг. Содержание гистамина коррелирует с содержанием тирамина в сыре — от 10 до 2500 мг/кг. В количествах более 100 мг/кг гистамин может представлять угрозу для здоровья человека.
Алкалоиды. Алкалоиды — весьма обширный класс органических соединений, оказывающих самое различное действие на организм человека. Это и сильнейшие яды, и полезные лекарственные средства. Печально известный наркотик, сильнейший галлюциноген — ЛСД — диэтиламид лизергиловой кислоты, был выделен из спорыньи — грибка, растущего на ржи, в 1943 г. швейцарским химиком А. Гофманом.
С 1806 г. известен морфин; он выделен из сока головок мака и является очень хорошим обезболивающим средством, благодаря чему нашел применение в медицине, однако при длительном употреблении приводит к развитию наркомании.
Хорошо изучены в настоящее время так называемые пуриновые алкалоиды, к которым относятся кофеин и часто сопровождающие его теобромин и теофиллин. Структурные формулы ЛСД, морфина, кофеина, теобромина и теофиллина представлены ниже:
Содержание кофеина в сырье и различных продуктах колеблется в достаточно широких пределах. В зернах кофе и листьях чая, в зависимости от вида сырья, его от 1 до 4 %, в напитках кофе и чая, в зависимости от способа приготовления, до 1500 мг/л (кофе) и до 350 мг/л (чай), а в напитках пепси-кола и кока-кола — до 1000 мг/л и выше. Здесь уместно подчеркнуть, что пуриновые алкалоиды при систематическом употреблении их на уровне 1000 мг в день вызывают у человека постоянную потребность в них, напоминающую алкогольную зависимость.
К группе стероидных алкалоидов относятся соланины и чаконины, содержащиеся в картофеле. Иначе их называют гликоалкалоидами; они содержат один и тот же агликон (соланидин), но различные остатки сахаров. В картофеле обнаружены шесть гликоалкалоидов, одним из которых является -соланин.
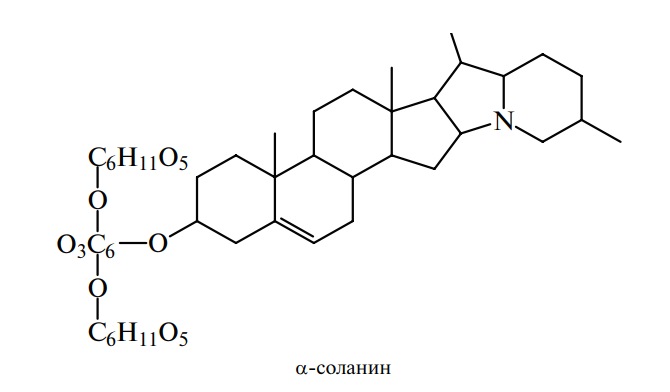
Особенности состава других гликоалкалоидов картофеля видны из сопоставления их структурных компонентов:
α-соланин соланидин + галактоза + глюкоза + рамноза
β-соланин соланидин + галактоза + глюкоза
γ-соланин соланидин + галактоза
α-чаконин соланидин + глюкоза + рамноза + рамноза
β-чаконин соланидин + глюкоза + рамноза
γ-чаконин соланидин + глюкоза
Таким образом, гликоалкалоиды картофеля весьма близки по составу и являются промежуточными продуктами при биосинтезе -соланина. Это вещества средней токсичности, их накопление в клубнях картофеля (в позеленевших частях клубня их количество может увеличиваться более чем в 10 раз и достигать 500 мг/кг) придает горький вкус и вызывает типичные признаки отравления. Эти соединения обладают антихолин-эстеразной активностью.
Соланины и чаконины могут содержаться в баклажанах, томатах, табаке.
Антивитамины. Согласно современным представлениям к антивитаминам относят две группы соединений.
1-я группа — соединения, являющиеся химическими аналогами витаминов, с замещением какой-либо функционально важной группы на неактивный радикал, то есть это частный случай классических антиметаболитов.
2-я группа — соединения, тем или иным образом специфически инактивирующие витамины, например с помощью их модификации, или ограничивающие их биологическую активность.
Если классифицировать антивитамины по характеру действия, как это принято в биохимии, то первая (антиметаболитная) группа может рассматриваться в качестве конкурентных ингибиторов, а вторая — неконкурентных, причем во вторую группу попадают весьма разнообразные по своей химической природе соединения и даже сами витамины, способные в ряде случаев ограничивать действие друг друга.
Рассмотрим некоторые конкретные примеры соединений, имеющих ярко выраженную антивитаминную активность.
Лейцин нарушает обмен триптофана, в результате чего блокируется образование из триптофана ниацина — одного из важнейших водорастворимых витаминов — витамина РР.
Индолилуксусная кислота и ацетилпиридин также являются антивитаминами по отношению к витамину РР; содержатся в кукурузе. Чрезмерное употребление продуктов, содержащих вышеуказанные соединения, может усиливать развитие пеллагры, обусловленной дефицитом витамина РР.
Аскорбатоксидаза и некоторые другие окислительные ферменты проявляют антивитаминную активность по отношению к витамину С. Аскорбатоксидаза (Н.Ф.1.10.3.3) катализирует реакцию окисления аскорбиновой кислоты в дегидроаскорбиновую кислоту (см. п. 1).
Содержание аскорбатоксидазы и ее активность в различных продуктах неодинакова: наиболее активна аскорбатоксидаза в огурцах, кабачках, наименее — в моркови, свекле, помидорах. При измельчении овощей за 6 часов хранения теряется более половины витамина С, так как измельчение способствует взаимодействию фермента и субстрата.
Тиаминаза (Н.Ф.3.5.99.2) — антивитаминный фактор для витамина В1 тиамина. Она содержится в продуктах растительного и животного происхождения, наибольшее содержание этого фермента отмечено у пресноводных и морских рыб, кроме того, тиаминаза продуцируется бактериями кишечного тракта — Bac. thiaminolytic и Bac. anekrinolytieny, что может являться причиной дефицита тиамина. Ортодифенолы и биофлавоноиды (вещества с Р-витаминной активностью), содержащиеся в кофе и чае, а также окситиамин, который образуется при длительном кипячении кислых ягод и фруктов, проявляют антивитаминную активность по отношению к тиамину.
Все это необходимо учитывать при употреблении, приготовлении и хранении пищевых продуктов.
Линатин — антагонист витамина В6, содержится в семенах льна. Кроме этого, ингибиторы пиродоксалевых ферментов обнаружены в съедобных грибах и некоторых видах семян бобовых.
Авидин — белковая фракция, содержащаяся в яичном белке, приводящая к дефициту биотина (витамина Н) за счет связывания и перевода его в неактивное состояние.
Гидрогенизированные жиры являются факторами, снижающими сохранность витамина А (ретинола).
Говоря об антиалиментарных факторах питания, нельзя не сказать о гипервитаминозах. Известны два типа их: гипервитаминоз А и гипервитаминоз D. Например, печень северных морских животных несъедобна из-за большого содержания витамина А.
Приведенные выше данные свидетельствуют о необходимости дальнейшего тщательного изучения вопросов, связанных с взаимодействием различных природных компонентов пищевого сырья и продуктов питания, влияния на них различных способов технологической и кулинарной обработки, а также режимов и сроков хранения с целью снижения потерь ценных макро- и микронутриентов и обеспечения рациональности и адекватности питания.
Факторы, снижающие усвоение минеральных веществ. К факторам, снижающим усвоение минеральных веществ, в первую очередь следует отнести щавелевую кислоту и ее соли (оксалаты), фитин (инозитолгексафосфорная кислота) и танины.
Наиболее изучена в этом плане щавелевая кислота: НООС–СООН. Продукты с высоким содержанием щавелевой кислоты способны приводить к серьезным нарушениям солевого обмена, необратимо связывать ионы кальция. Установлено, что интоксикация щавелевой кислотой проявляется в большей степени на фоне дефицита витамина D.
Известны случаи отравлений с летальным исходом как от самой щавелевой кислоты (при фальсификации продуктов, в частности вин, когда подкисление проводили дешевой щавелевой кислотой), так и от избыточного потребления продуктов, содержащих ее в больших количествах. Смертельная доза для взрослых людей колеблется от 5 до 150 г и зависит от целого ряда факторов. Содержание щавелевой кислоты в среднем в некоторых растениях таково (в мг/100 г): шпинат — 1000, ревень — 800, щавель — 500, красная свекла — 250.
Фитин благодаря своему химическому строению легко образует труднорастворимые комплексы с ионами Ca, Mg, Fe, Zn и Cu. Этим объясняется его деминерализующий эффект.
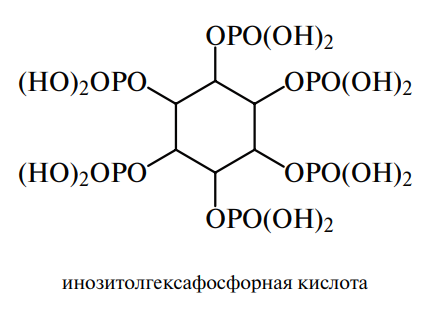
Достаточно большое количество фитина содержится в злаковых и бобовых культурах: в пшенице, горохе, кукурузе его содержание примерно 400 мг/100 г продукта, причем основная часть сосредоточена в наружном слое зерна. Хлеб, выпеченный из муки высшего сорта, практически не содержит фитина. В хлебе из ржаной муки его мало, благодаря высокой активности фитазы, способной расщеплять фитин. Дубильные вещества, кофеин, балластные соединения могут рассматриваться как факторы, снижающие усвоение минеральных веществ.
Яды пептидной природы. Интересным и важным является тот факт, что многие биологически активные вещества являются циклопептидами, то есть имеют циклическое строение. К таким циклопептидам относятся антибиотики, гормоны и токсины. Было показано, что ядовитый гриб бледная поганка (Amanita phalloides) содержит не менее 10 токсичных циклопептидов. Их молекулярная масса около 1000; они содержат атом серы, принадлежащий к остатку цистеина, связанному с индольным кольцом триптофана. Ниже представлена структура особенно ядовитого циклопептида бледной поганки -аманитина:
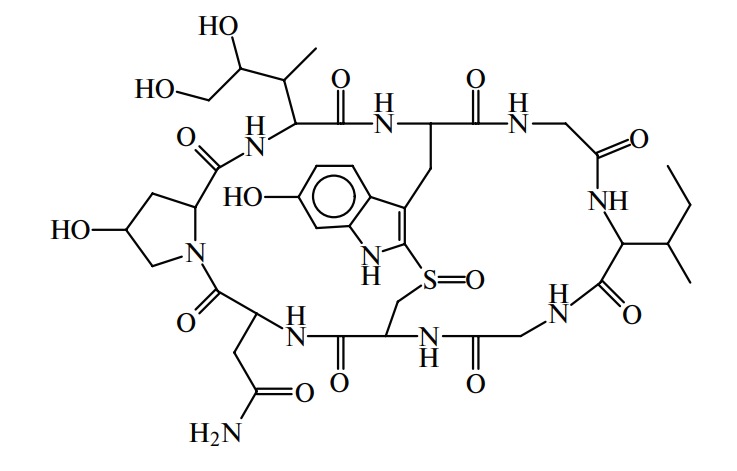
Из приведенной структуры видно, что сера цистеина, связываясь с остатком триптофана, разделяет циклопептид на два кольца. Подобная бициклическая структура свойственна всем циклопептидам бледной поганки. Лектины. Лектины — группа веществ гликопротеидной природы с молекулярной массой от 60 до 120 тысяч дальтон. Они широко распространены в семенах и других частях растений. Лектины обнаружены в бобовых, арахисе, проростках растений, а также в икре рыб.
Лектины обладают способностью: повышать проницаемость стенок кишечника для чужеродных веществ; нарушать всасывание нутриентов; вызывать агглютинацию (склеивание) эритроцитов крови. С этим связано их негативное действие при высоких концентрациях (см. в п. 6 «Белки бобовых культут»). Некоторые лектины токсичны, например лектин из семян клещевины (Ricinus communis) — рицин, а также лектины некоторых животных и микроорганизмов, в частности холерный токсин.
Алкоголь. Алкоголь можно рассматривать как рафинированный продукт питания, который имеет только энергетическую ценность. При окислении 1 г этанола выделяется 7 ккал энергии; данная величина лежит между калорийностью углеводов и жиров. Алкоголь не является источником каких-либо пищевых веществ, поэтому его часто называют источником «холостых» калорий.
Попадая в организм человека, этанол под воздействием фермента алкогольдегидрогеназы окисляется до ацетальдегида согласно уравнению
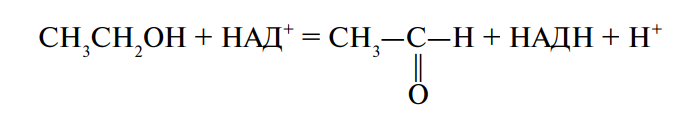
Далее ацетальдегид под воздействием другого фермента — альдегиддегидрогеназы окисляется до ацетата:
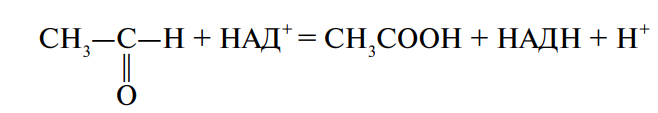
В результате этих двух реакций образуются две молекулы НАДН, которые служат донорами водорода в дыхательной цепи митохондрий. В ходе последующего переноса электронов к кислороду из АДФ и остатка фосфорной кислоты образуется 6 молекул АТФ. Образовавшийся из этанола ацетат в дальнейшем активируется и переходит в ацетил-кофермент А:
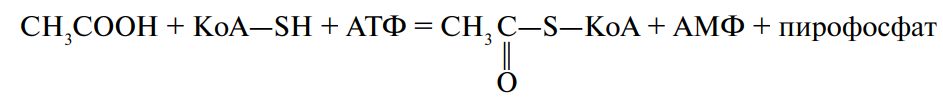
Образовавшийся ацетил-КоА в свою очередь может окисляться в цикле лимонной кислоты.
Алкоголь синтезируется ферментными системами организма для собственных нужд и в течение дня организм человека способен синтезировать от 1 до 9 г этилового спирта. Эндогенный алкоголь является естественным метаболитом, и ферментных мощностей организма вполне хватает для его окисления в энергетических целях. При потреблении алкоголя в больших количествах ферменты не справляются, происходит накопление этилового спирта и уксусного альдегида, что вызывает симптомы обширной интоксикации (головная боль, тошнота, аритмия сердечных сокращений). Таким образом, алкоголь можно рассматривать как антиалиментарный фактор питания, приводящий к специфическим нарушениям обмена веществ.
У людей, потребляющих большие количества алкоголя, обнаруживается дефицит незаменимых веществ. Примером могут служить тяжелые формы недостаточности витаминов у алкоголиков: алкогольные формы полиневрита, пеллагры, бери-бери и т. п., а также гипогликемия, так как этанол блокирует синтез глюкозы из лактата и аминокислот.
Хроническое потребление алкогольных напитков приводит не только к авитаминозам, но и к нарушению углеводного, жирового и белкового обмена и заканчивается, как правило, биохимической катастрофой с тяжелыми патологиями. Кроме того, совершенно очевидно, что алкоголь обладает наркотическим действием, вызывая устойчивую зависимость, которая приводит к негативным изменениям психики и в конечном счете к деградации личности.
Приведенные сведения о компонентах пищи, способных оказывать неблагоприятное воздействие на организм человека, свидетельствуют о необходимости их учета при составлении рационов питания, при решении ряда технологических вопросов в производстве продуктов питания, а также при их кулинарной обработке.
В табл. 1 приведены антиалиментарные факторы питания и их основные источники, а также возможные пути устранения их негативного влияния.
5. Метаболизм чужеродных соединений
Механизм детоксикации ксенобиотиков — две фазы. Изучение метаболизма чужеродных соединений, превращений, которые они претерпевают, попадая в организм человека, важны в первую очередь с точки зрения выяснения химических и биохимических механизмов детоксикации, а также для оценки возможностей защитной системы организма по детоксикации чужеродных веществ.
Таблица 1. Антиалиментарные вещества (Л. Ф. Павлоцкая и др., 1989)
| № п/п | Ингибируемое вещество | Природный антипищевой фактор | Источники и условия действия | Пути устранения влияния |
| 1 | Ферменты
Трипсин, химотрипсин, -амилаза |
Соответствующие белковые ингибиторы | Бобовые, злаковые, белок куриного яйца в сыром виде | Тепловая обработка |
| 2 | Аминокислоты
Лизин, триптофан и др. Триптофан |
Редуцирующие сахара
Лейцин |
Продукты, содержащие оба вида нутриентов
Пшено при его избыточном потреблении |
Рациональное сочетание продуктов, легкая тепловая обработка
Умеренное потребление пшена |
| 3 | Витамины
Аскорбиновая кислота Ниацин Биотин Ретинол Kальциферол
Токоферол |
Аскорбатоксидаза, полифенолоксидаза, пероксидазы, хлорофилл | Фрукты и овощи при их нарезании и хранении | Использование в целом виде, бланшировка |
| Биофлавоноиды, ортодифенолы | Чай, кофе при избыточном потреблении | Ограниченное потребление | ||
| Индолилуксусная кислота, ацетилпиридин | Kукуруза при одностороннем питании | Рациональное питание | ||
| Авидин | Яичный белок в сыром виде | Тепловая обработка | ||
| Длительно нагревавшиеся жиры, гидрогенизированные жиры | Пищевые жиры | Легкая тепловая обработка, дозированное потребление маргарина | ||
| Недостаточно идентифицированные вещества | Соя при недостаточной тепловой обработке | Тепловая обработка | ||
| Полиненасыщенные жирные кислоты | Растительные масла при избыточном потреблении | Потребление в пределах рекомендуемых норм | ||
| 4 | Минеральные вещества
Са, Мg и некоторые другие катионы Са, Мg, Nа Са Fe |
Щавелевая кислота
Фитин Kофеин Избыток фосфора Баластные вещества Дубильные вещества Серосодержащие соединения |
Щавель, шпинат, ревень, инжир, черника при избыточном потреблении
Бобовые, некоторые крупы, отруби при недостаточной тепловой обработке Черный хлеб при избыточном потреблении Kофеинсодержащие напитки Зерновые продукты Отруби, хлеб грубого помола, многие крупы, овощи, фрукты при избыточном потреблении Чай при избыточном потреблении Kапуста белокочанная, цветная, кольраби, турнепс, редис, некоторые бобовые, арахис при избыточном потреблении |
Увеличение потребления кальция
Тепловая обработка Потребление в пределах нормы Умеренное потребление Продукты, содержащие кальций, —молоко, творог, сыр Увеличение потребления источников железа, витамина С, кальция и фосфора Умеренное потребление Ограниченное потребление в условиях недостатка иода в пище |
Метаболизм чужеродных соединений в организме будет зависеть от множества различных факторов. Путь ксенобиотика, его воздействие и ответную реакцию организма можно представить в виде схемы (рис. 8).
Рис. 8. Путь и воздействие ксенобиотика в организме человека
Попадая в организм, определенная доза вещества всасывается в месте контакта, разносится и распределяется в крови и органах. Вследствие метаболистических изменений и ритмического протекания процессов детоксикации уровень его содержания падает. В тканях и клетках ксенобиотик проходит через одну или несколько мембран, взаимодействуя с рецепторами. В результате возникает ответная реакция, включаются механизмы противодействия с целью поддержания постоянства внутренней среды — гомеостаза.
Метаболизм ксенобиотиков протекает в виде двухфазного процесса: 1-я фаза — метаболистические превращения; 2-я фаза — реакции конъюгации.
1-я фаза (метаболистические превращения). Связана с реакциями окисления, восстановления, гидролиза и протекает при участии ферментов главным образом в эндоплазматическом ретикулуме печени и реже — других органов (надпочечниках, почках, кишечнике, легких и т. д.).
Окислени е. В осуществлении реакций окисления решающее значение имеют микросомальные ферменты печени. Окислительная система состоит из системы цитохрома Р-450, а также НАДФН- и НАДН-зависимых редуктаз. Система цитохрома Р-450 представляет собой электрон-транспортную цепь, организованную в белково-липидный комплекс, катализирующий окислительно-восстановительную реакцию включения атома кислорода в молекулу гидрофобных соединений RH. Эта реакция протекает с использованием электронов, поступающих от доноров НАДФН и НАДН к цитохромам Р-450 и b5 при участии редуктаз.

Микросомальные ферменты катализируют не только окисление жирных кислот, гидроксилирование стероидов, окисление терпенов и алкалоидов, но и окисление различных лекарств, пестицидов, канцерогенных ПАУ и других ксенобиотиков.
Такое многообразие субстратов, на которое воздействует цитохром Р-450, является следствием множественных форм фермента, число которых достигает сотни. В ответ на воздействие различных ксенобиотиков в печени и других органах происходит индукция синтеза тех изоформ цитохрома Р-450, которые метаболизируют данные токсиканты, что эквивалентно реакции иммунной системы организма на воздействие чужеродных белков.
Поэтому весь спектр этих ферментов обозначают как генное суперсемейство цитохрома Р-450, для которого была предложена специальная номенклатура. Например: цитохромы Р-450 1А1 и 1А2 метаболизируют полиароматические углеводороды (1-я арабская цифра обозначает генное семейство, латинская буква — генное подсемейство, 2-я цифра — конкретный фермент); цитохром Р-450 3А4 — афлатоксин В, цитохром Р-4502Е1 метаболизирует нитрозамины и т. п.
Восстановление. Чаще всего имеют место реакции восстановления нитро- и азосоединений в амины, восстановление кетонов во вторичные спирты.
Гидролиз. Речь идет главным образом о гидролизе сложных эфиров и амидов с последующей деэтерификацией и дезаминированием.
2-я фаза (реакции конъюгации). Это реакции, приводящие к детоксикации. Наиболее важные из них — реакции связывания активных –ОН-,–NH2-, –СООН- и –SH-групп и метаболита первичного ксенобиотика. Интересно, что некоторые ксенобиотики, в частности лекарственные средства, могут стимулировать активность ферментов, участвующих в
метаболизме различных веществ (не только собственном). Такая ферментативная индукция может считаться выгодной, так как метаболизм и выведение токсических веществ ускоряется, если только промежуточные метаболиты не окажутся более токсичными, чем исходные вещества.
Наиболее широка и многообразна активность ферментов семейства глутатионтрансфераз. Они участвуют в реакциях конъюгации с восстановленным глутатионом, которые могут протекать по следующей схеме:
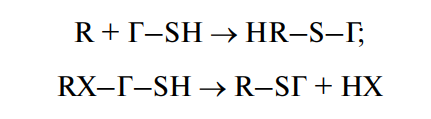
Кроме того, глутатионтрансферазы восстанавливают органические гидроперекиси в спирты.
Уридиндифосфат (УДФ) — глюкуронилтрансферазы присоединяют остаток глюкуроновой кислоты к фенолам, спиртам, аминам. Эти ферменты метаболизируют, например, анилин, фенол, морфин, левомицетин, парацетомол и др.
Ацетилтрансферазы присоединяют ацетил к Nили О-атомам, а метилтрансферазы метилируют ОН-, NH2- и SH-группы различных ксенобиотиков и лекарственных средств.
К ферментам второй фазы относятся и некоторые другие ферменты, такие как сульфотрансфераза и метилтрансфераза.
Функционирование всех ферментов 2-й фазы ограничивается тем, что они метаболизируют только те вещества, которые имеют функциональные группы, поэтому эти ферменты включаются после высвобождения или образования функциональных групп ферментами первой фазы метаболизма ксенобиотиков. Однако трансферазы имеют и важные достоинства: они присутствуют во всех клетках; функционируют при любых путях поступления ксенобиотиков в организм; завершают детоксикацию, а иногда исправляют ошибки первой фазы.
Факторы, влияющие на метаболизм чужеродных соединений. Чужеродные соединения обычно метаболизируются различными путями, образуя множество метаболитов. Скорость и направление этих реакций зависят от многих факторов, результатом действия которых могут быть изменения в картине метаболизма и, как следствие, возникают различия в токсичности. Эти факторы по своему происхождению можно разделить на следующие: а) генетические (генетически обусловленные дефекты ферментов, участвующие в метаболизме чужеродных соединений); б) физиологические (возраст, пол, состояние питания, наличие различных заболеваний); в) факторы окружающей среды (облучение ионизирующей радиацией, стресс из-за неблагоприятных условий, наличие других ксенобиотиков). Очень важно для процессов детоксикации, чтобы обе фазы детоксикации функционировали согласованно, с некоторым доминированием реакций конъюгации, особенно если на первой стадии в результате метаболистических превращений из первоначальных ксенобиотиков образуются вещества с выраженной токсичностью.
Принципиально важное значение для нормального функционирования обеих фаз детоксикации имеет и соответствующий уровень эффективности антиоксидантной системы клетки. Это определяется активностью антиоксидазных ферментов и уровнем низкомолекулярных антиоксидантов (токоферолов, биофлавоноидов, витамина С и др.), поскольку хорошо известно, что функционирование системы цитохрома Р-450 связано с образованием активных форм кислорода (оксидрадикала, Н2О2), вызывающих деструкцию мембран, в том числе мембран эндоплазматического ретикулума, и тем самым способствующих подавлению активности цитохром Р-450-зависимых ферментов и частично ферментов конъюгации, встроенных в мембраны, активность которых связана с мембранным окружением.
Таким образом, антиоксидазная система функционирует как еще одна важная система детоксикации, обеспечивающая защиту организма от агрессивных органических свободных радикалов, перекисных производных, которые также являются опасными факторами онкогенности, как и рассматриваемые экзогенные токсиканты.
6. Генетически модифицированные организмы. Критерии безопасности
Не последнюю роль в решении проблем в области продовольствия и медицины отводят бурно развивающейся в последние десятилетия биотехнологии. Важнейшей составляющей частью современной биотехнологии является генная инженерия.
Генная инженерия – это управление генетической основой организмов посредством внедрения или удаления специфических генов с использованием техники современной молекулярной биологии. Методы генной инженерии позволяют конструировать фрагменты рекомбинантных ДНК того или иного организма, которые при внедрении в генетический аппарат клетки придавали бы им свойства, полезные для человека.
Генетически модифицированные (трансгенные) продукты питания представляют особый научный и практический интерес. Проблемы, связанные с созданием и использованием генетически модифицированных организмов (ГМО), широко обсуждаются в научном мире и в средствах массовой информации. К обсуждению этой проблемы подключены международные, государственные и общественные экологические организации. Первые сообщения о генетически модифицированных (ГМ) растениях и полученных из них продуктах питания появились в начале 1990-х гг. В настоящее время генетическому изменению подвергается важнейшее растительное сырье, а без использования растительного сырья получают лишь очень немногие продукты питания.
Успехи в области генной инженерии позволяют получать новые сорта растений с заданными свойствами, причем в короткие сроки, в отличие от традиционной селекции. За счет встраивания генов, выделенных из одних организмов и несущих определенную генетическую информацию (например, устойчивость к заморозкам, гербицидам, болезням и паразитам, высокая урожайность, неполегаемость и др.) в ДНК других, были получены растения, которые называют трансгенными, то есть с перемещенными генами.
Начало производства сельскохозяйственных ГМ культур в крупных промышленных масштабах датируется 1996 г., когда ими было засеяно 1,7 млн га посевных площадей в мире. К 2006 г. площади посевов ГМ растений достигли 102,0 млн га. В настоящее время их выращивают в 22 странах мира, при этом лидерами являются США, Аргентина, Бразилия, Канада, Китай, Индия (табл. 2).
Таблица 2. Динамика выращивания ГМ культур (млн га) с 1996 по 2006 г.*
| Страна | Годы | ||||||||||
| 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | |
| США | 1,449 | 7,46 | 19,26 | 26,25 | 28,25 | 33,02 | 37,53 | 40,72 | 44,79 | 47,40 | 54,6 |
| Аргентина | 0,037 | 1,76 | 4,82 | 6,84 | 9,61 | 11,78 | 13,59 | 14,90 | 15,88 | 16,93 | 18,0 |
| Бразилия | 0,00 | 0,10 | 0,50 | 1,18 | 1,30 | 1,31 | 1,74 | 3,00 | 5,00 | 9,00 | 11,5 |
| Канада | 0,139 | 0,65 | 2,16 | 3,53 | 3,33 | 3,21 | 3,25 | 4,43 | 5,07 | 5,86 | 6,10 |
| Китай | 0,00 | 0,03 | 0,26 | 0,65 | 1,22 | 2,17 | 2,10 | 2,80 | 3,70 | 3,30 | 3,50 |
| Индия | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,04 | 0,10 | 0,50 | 1,30 | 3,80 |
| Парагвай | 0,00 | 0,00 | 0,00 | 0,06 | 0,09 | 0,34 | 0,48 | 0,74 | 1,20 | 1,80 | 2,00 |
| Австралия | 0,04 | 0,06 | 0,10 | 0,13 | 0,19 | 0,20 | 0,16 | 0,17 | 0,25 | 0,28 | 0,20 |
| ЮАР | 0,00 | 0,00 | 0,00008 | 0,0008 | 0,09 | 0,15 | 0,21 | 0,30 | 0,53 | 0,60 | 1,40 |
| Другие страны | 0,0009 | 0,02 | 0,06 | 0,07 | 0,09 | 0,11 | 0,14 | 0,21 | 0,53 | 0,71 | 0,90 |
| Всего | 1,67 | 10,08 | 27,16 | 38,73 | 44,16 | 52,30 | 59,25 | 67,36 | 77,45 | 87,16 | 102,0 |
* [Генетически модифицированные источники пищи: оценка безопасности и контроль / Под ред. В. А. Тутельяна. — М. : Изд-во РАМН, 2007].
В 2006 г. ГМ культуры выращивали шесть стран Европейского Союза: основные посевные площади ГМ растений сосредоточены в Испании (60 000 га), в остальных пяти странах ЕС (Франция, Чехия, Португалия, Германия, Словакия) — 5200 га. Основной трансгенной культурой здесь является соя — 57 % всей площади возделывания ГМО, далее следует кукуруза — 25 %, затем хлопок — 13 % и рапс — 5 %.
В 2007 г. в мире трансгенными культурами засеяно около 110 млн га, а по прогнозам этот показатель к 2015 г. достигнет 200 млн га или около 14 % всех посевных площадей в мире.
В 2007 г. в мире зарегистрировано и допущено к промышленному производству пищевых продуктов и кормов 168 линий ГМ растений: 13 линий сои, 43 — кукурузы (из них 13 с комбинированными признаками), 22 — хлопка (из них 7 с комбинированными признаками), 24 — рапса, 22 — картофеля, 9 — риса, 8 — томатов, 7 — пшеницы, 3 — сахарной свеклы, 3 — цикория, 2 — дыни, 2 — люцерны, 2 — папайи, 2 — табака, 2 — тыквы, 1 — льна, 1 — чечевицы, 1 — подсолнечника, 1 — полевицы побегоносной. И них 106 линий зарегистрировано в США, 29 — в Европейском Союзе, в Российской Федерации к середине 2007 г. зарегистрированы 17 линий ГМО: 3 линии сои, 8 линий кукурузы, 4 сорта картофеля, 1 линия риса, 1 линия сахарной свеклы.
Генетической модификации подвергаются не только растения; известны также генетически модифицированные дрожжи и ферментные препараты, полученные из трасгенных микроорганизмов. Основными ферментными препаратами, полученными методами генной инженерии, являются: -амилаза из B. stearothermophilus, экстрессированная в B. subtilis; -амилаза B. megaterium, экспрессированная в B. subtilis; химозин А, полученный их штамма E. coli К-12, содержащего ген телячьего прохимозина А. Кроме того, при производстве глюкозного сиропа из кукурузного крахмала применяются ферменты из генетически измененных бактерий. В Германии получены трансгенные пектиназы, используемые при производстве соков и вин.
Генная инженерия находит применение и в животноводстве, влияя на рост и продуктивность сельскохозяйственных животных. Так, свыше 500 000 коров молочных пород получают рекомбинантный гормон роста крупного рогатого скота — rBGH — фирмы „Monsanto“.
Возможны различные подходы к оценке генетически измененного сырья и готовых пищевых продуктов из него. Это можно проиллюстрировать на примере трансгенной сои и продуктов ее переработки (рис. 9).
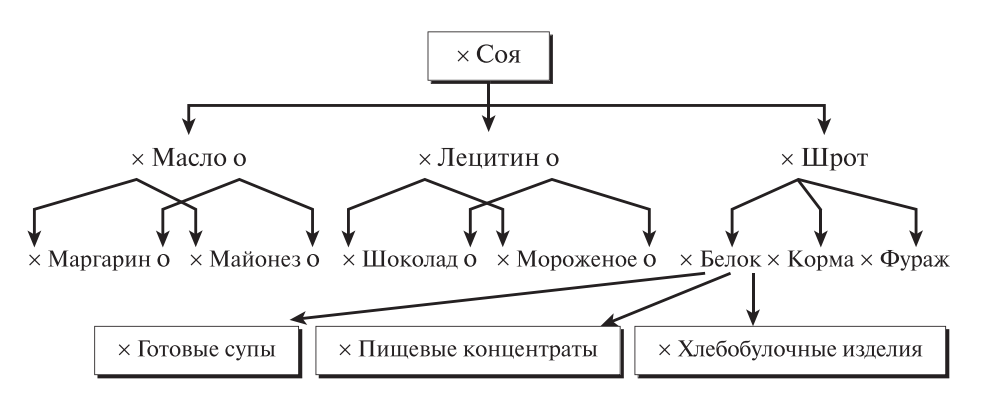
Рис. 9. Возможные продукты переработки трансгенной сои
Из трансгенного сырья (x) при технологической переработке (в зависимости от способа) можно получить продукты как содержащие (x), так и не содержащие (о) генетически измененные компоненты. Например, из сои получают масло, которое может быть трансгенным (x) или нет (о). Соответственно продукты, при изготовлении которых используется соевое масло, будут трансгенными (x) или обычными (о).
Проблема практического использования ГМ источников пищи, по мнению академика РАМН В. А. Тутельяна, имеет несколько равноценных по значимости аспектов.
Первый аспект касается совершенствования технологии получения ГМ растений и доведение производства нового вида растений до промышленных масштабов.
Второй аспект связан с разработкой и совершенствованием системы медико-биологической оценки безопасности новой продукции.
Третий аспект — обеспечение защиты общества от намеренного антигуманного использования новейших биотехнологий.
Четвертый аспект — информированность специалистов и населения в данной области.
6.1. Основные задачи и перспективы использования генно-модифицированных организмов
С точки зрения мировых перспектив многие специалисты предсказывают хорошее будущее коммерческому использованию трансгенных культур. Они считают, что трансгенные растения помогут снять остроту проблемы продовольствия и сократить затраты на химические средства защиты растений.
Как отмечалось выше, по прогнозам к 2015 г. посевные площади трансгенных культур будут составлять 14 % от общего количества и в процесс их промышленного производства будет вовлечено 40 стран на всех континентах.
Причинами столь беспрецедентных объемов освоения трансгенных культур является в первую очередь огромный прогресс биотехнологической науки, а также бесспорные технологические и экономические преимущества трансгенных растений в сельскохозяйственном производстве.
Основные задачи генной инженерии в создании трансгенных растений довольно многообразны:
- получение новых сортов — с более высокой урожайностью, культур, дающих несколько урожаев в год;
- изменение габитуса растения — высоты, формы листьев и корневой системы, строения и окраски цветков, времени цветения и др.;
- питание растений — фиксация атмосферного азота неазотфиксирующими растениями, повышение эффективности фотосинтеза, улучшение поглощения минеральных веществ и т. п.;
- качество продукции — изменение состава и (или) количества сахаров, крахмала, жиров; вкуса и запаха пищевых продуктов; получение новых видов лекарственного сырья; изменение сроков созревания плодов;
- устойчивость к абиотическим факторам — засухе, засолению, а также адаптация к холоду, жароустойчивость, устойчивость к гербицидам, кислотности почв, тяжелым металлам и др.;
- устойчивость к биотическим факторам — к вредителям, бактериальным, вирусным и грибным инфекциям.
На практике ситуация выглядит следующим образом: среди промышленно выращиваемых трансгенных растений доля устойчивых к гербицидам составляет 68 %, устойчивых к вредителям — 19 %, устойчивых одновременно к гербицидам и вредителям — 12 %, устойчивых к вирусным, бактериальным и грибным инфекциям — менее 1 %.
6.2. Основные способы создания генно-инженерномодифицированных организмов
Создание генетически измененного растения на данном этапе развития науки не представляет большой сложности. Существуют несколько достаточно широко распространенных методов для внедрения чужеродных ДНК в геном растения. Одной из основ этих методов явилось открытие ферментов — рестриктаз. Эти ферменты способны распознавать определенную последовательность своей ДНК и расщеплять «чужую» ДНК на фрагменты. Причем одни из них узнают тетрануклеотид, а другие — последовательность из 6 нуклеотидных пар. Кроме того, следует отметить, что рестриктазы поразному расщепляют ДНК.
Одни вносят разрывы по оси симметрии узнаваемой последовательности, тогда как другие — со сдвигом, с образованием «ступеньки». В первом случае образуются так называемые «тупые» концы, а во втором — «липкие», то есть фрагменты, которые имеют на своих концах однонитевые комплементарные участки длиной в четыре нуклеотида. Такие фрагменты удобны для создания рекомбинантных ДНК.
После того как ДНК сшита in vitro, ее надо ввести в живые клетки и обеспечить стабильное поддержание генетической информации. Это достигается при помощи так называемых векторных молекул (векторов). Векторы — это молекулы ДНК, способные акцептировать чужеродную ДНК и обеспечивающие ее репликацию и, возможно, экспрессию. В составе векторной молекулы должен быть маркерный ген (как правило, это гены устойчивости к антибиотикам). В качестве векторов используют плазмиды, бактериофаги, вирусы животных.
Один из методов создания трансгенных растений основан на использовании природного вектора из почвенных бактерий — Agrobacterium tumefaciens и Agrobacterium rhizogenes.
Существуют и другие методы введения чужеродной генетической информации: применение бинарных векторов, векторов на основе ДНК-содержащих вирусов растений, прямого переноса генов. Существует метод бомбардировки растительных клеток мельчайшими частичками золота или вольфрама (диаметр 1–2 микрона), несущими вектор ДНК. Они с огромной скоростью выбрасываются из биологической баллистической пушки, разрывая клеточные стенки, входят в цитоплазму и ядро клетки. С некоторой вероятностью такая «пуля» может правильно передать генетический материал клетке, и растение приобретает новые свойства.
Среди других способов внедрения чужеродной ДНК можно назвать способ растворения клеточной стенки растений ферментами и перенос таких клеток (протопластов) в раствор, содержащий ДНК и вещество, способствующее ее проникновению в клетку (чаще всего применяется полиэтиленгликоль). Иногда в мембране клеток проделывают микроотверстия короткими импульсами высокого напряжения, а иногда применяют впрыскивание ДНК микрошприцем под контролем микроскопа.
В дальнейшем из клеток, воспринявших нужный ген, выращивают целые растения (с использованием методов культуры клеток и тканей), которые затем размножают обычным способом.
6.3. Потенциальные опасности и риски ГМО
Несмотря на то что в настоящее время конкретных примеров серьезной экологической опасности трансгенных сортов и гидридов не выявлено, их потенциальная опасность не подвергается сомнению (рис. 10). Прогнозы потенциальной опасности строятся не на фактических данных, а на основании общих биологических закономерностей, которые дают возможность выявить вероятные механизмы отрицательных последствий широкого распространения генетически модифицированных растений и оценить потенциальные риски для окружающей среды и здоровья человека.
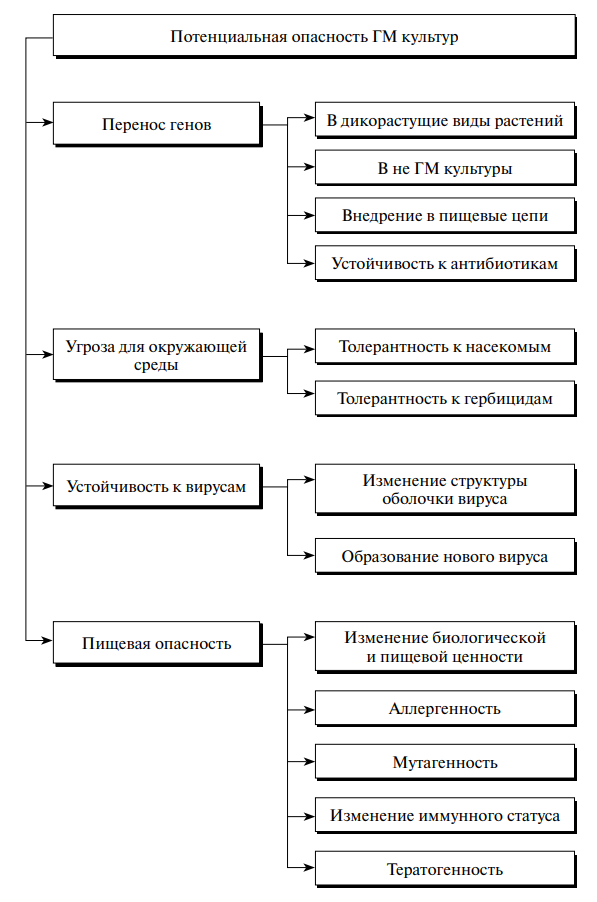
Рис. 10. Потенциальная опасность применения трансгенных культур [Л. В. Донченко, 2001]
В настоящее время мнения ученых по этому вопросу разделились. Сторонники употребления генетически модифицированных продуктов считают, что они безвредны для человека и даже имеют преимущества. Главный аргумент, который приводят эксперты, гласит: «ДНК из генетически модифицированных организмов так же безвредна, как и любая ДНК, присутствующая в пище».
Противники создания генетически модифицированных организмов приводят свои достаточно убедительные доводы. В связи с этим ниже даны выдержки из Декларации общественной организации «Врачи и ученые против генетически модифицированных продуктов питания»:
- Генная инженерия в корне отличается от выведения новых сортов и пород. Искусственное добавление чужеродных генов сильно нарушает точно отрегулированный генетический контроль нормальной клетки. Манипулирование генами коренным образом отличается от комбинирования материнских и отцовских хромосом, которое происходит при естественном скрещивании.
- В настоящее время генная инженерия технически несовершенна, т. к. она не в состоянии управлять процессом встраивания нового гена. Поэтому невозможно предвидеть место встраивания и эффекты добавленного гена. Даже в том случае, если место расположения гена окажется возможным установить после его встраивания в геном, имеющиеся сведения о ДНК очень неполны для того, чтобы предсказать результаты.
- В результате искусственного добавления чужеродного гена непредвиденно могут образовываться опасные вещества — токсичные вещества, аллергены и др.
- Не существует совершенно надежных методов проверки на безвредность. Степень риска того, что опасные свойства модифицированных продуктов питания останутся незамеченными, значительно больше, чем в случае с лекарствами.
- Созданные до настоящего времени с помощью генной инженерии продукты питания не имеют сколько-нибудь значительной ценности для человечества. Эти продукты удовлетворяют главным образом лишь коммерческие интересы.
- Знания о действии на окружающую среду модифицированных с помощью генной инженерии организмов, привнесенных туда, совершенно недостаточны. Экологами высказываются предположения о различных потенциальных экологических осложнениях. Эти осложнения невозможно будет исправить в дальнейшем.
- Могут возникнуть новые опасные вирусы. Экспериментально доказано, что возможна рекомбинация с инфекционными вирусами, что может привести к созданию более агрессивных вирусов. Кроме того, вирусы могут стать менее видоспецифичными, например вирусы растений смогут поражать полезных насекомых, животных и человека.
- Генная инженерия не может решить проблему голода в мире. Утверждение, что генная инженерия может внести существенный вклад в решение проблемы обеспечения продовольствием является научно необоснованным мифом.
На основании этого большое число врачей и ученых считают неправильным эксплуатировать технологию, которая может непредвиденно вызывать риски для здоровья человека и оказывать необратимое воздействие на окружающую среду.
6.4. Критерии безопасности ГМО
Безопасность генетически модифицированных продуктов питания остается все еще под вопросом. Нет и не может быть однозначного ответа на вопрос о возможной опасности отдаленных последствий от таких продуктов. Очевидно одно — трансгенная продукция должна проходить тщательную многофакторную проверку на безопасность и иметь специальную маркировку, что закреплено в соответствующих федеральных законах и постановлениях. Однако и в этом пока больше вопросов, чем ответов.
В разных странах существуют свои правила контроля за распространением трансгенных организмов. При этом оценка ГМО по критериям безопасности складывается из двух основных направлений:
- исследование биобезопасности ГМО;
- определение пищевой безопасности ГМО и продуктов питания из них.
Биобезопасность ГМО. Потенциальную опасность трансгенных организмов для окружающей среды связывают со следующими отрицательными воздействиями:
- вытеснение природных организмов из их экологических ниш с последующим нарушением экологического равновесия;
- уменьшение биоразнообразия;
- бесконтрольный перенос чужеродных генов из трасгенных организмов в природные, что предположительно может привести к активации ранее известных или образованию новых патогенов.
Следует отметить, что порядок проведения исследований на биобезопасность в разных странах различен. В США, например, активные ингредиенты генно-модифицированных растений должны быть охарактеризованы по следующим позициям:
- молекулярно-генетические исследования ГМО (идентификация последовательности встроенных генов, описание вектора, изменения организма-реципиента, перенос генов в обычные культуры, в дикорастущие культуры);
- экотоксикологические исследования (острое и (или) хроническое воздействие на лабораторных животных, исследования, полевые агротехнические возможности переноса генов, влияние на почвенную микрофлору);
- токсикологические исследования (острая перроральная токсичность, усвояемость in vitro, аллергенность).
Исследования биобезопасности трансгенных растений в России осуществляют путем проведения ограниченных полевых испытаний на изолированных участках.
Пищевая безопасность ГМО. В большинстве стран считают необходимым проводить оценку безопасности композиционной или реальной эквивалентности, которая заключается в сравнении ГМО с традиционными аналогами. Для этого изучаются содержание основных нутриентов, антиалиментарных факторов и токсических веществ и аллергенов, характерных для данного вида продукта или определяемых свойствами переносимых генов.
Если в результате такой оценки не обнаруживается отличий от традиционных аналогов, такой трансгенный продукт причисляют к «первому классу безопасности» и предлагают считать его полностью безвредным для здоровья потребителей. При обнаружении отличий — «второй класс безопасности»; при полном несоответствии традиционным аналогам — «третий класс безопасности». Оценка безопасности генно-модифицированных пищевых продуктов предусматривает оценку пищевых свойств и токсикологических характеристик продукта. Оценка пищевых свойств включает изучение пищевой ценности нового продукта, нормы потребления, способов использования в питании, биодоступности, влияния на микрофлору кишечника и некоторых других параметров.
Токсикологическая характеристика базируется на определении следующих показателей: токсикокинетика, генотоксичность, потенциальная аллергенность, потенциальная колонизация в желудочно-кишечном тракте, результаты длительного (180 суток) токсикологического эксперимента на лабораторных животных. Однако такая система может быть рекомендована для продукции, не содержащей белки и ДНК. К таким продуктам относятся ароматические добавки, рафинированные масла, модифицированные крахмалы, мальтодекстрины, сиропы глюкозы и других сахаров.
В Российской Федерации с учетом международного и отечественного опыта разработан и введен в действие порядок оценки безопасности и качества пищевой продукции, полученной из генетически модифицированных источников, согласно которому каждый впервые поступающий на рынок России ГМО растительного происхождения подлежит санитарно-эпидемиологической экспертизе, которая проводится по трем направлениям: медико-генетическая оценка (Центр «Биоинженерия» РАН), медико-биологическая оценка (ГУ НИИ питания РАМН), оценка технологических параметров продукта (Московский государственный университет прикладной биотехнологии) (рис. 11).
Медико-генетическая оценка пищевых продуктов, полученных из ГМО, включает определение вносимой последовательности генов, маркерных генов антибиотиков, оценку регуляторных последовательностей (генов промоторов и терминаторов), стабильности генетически модифицированных организмов на протяжении нескольких поколений.
Медико-биологическая оценка пищевых продуктов, полученных из ГМО, осуществляется путем определения санитарно-гигиенических показателей безопасности и качества, проведения токсикологических исследований на лабораторных животных, оценки аллергенных свойств, возможных мутагенных и канцерогенных эффектов, изучения влияния на функцию воспроизводства, наблюдений эпидемиологических исследований.
Технологическая оценка пищевых продуктов, полученных из ГМО, проводится путем определения органолептических и физико-химических свойств, изучения сохранности и влияния генетической модификации на технологические параметры продукции.
Экспертиза пищевой продукции из ГМО проводится на основании документов и материалов, представленных заявителем, и результатов исследований, проведенных в РФ; заключение о безопасности продукта представляется в Роспотребнадзор, который выдает разрешение на использование ГМО для пищевых целей и реализацию данной продукции населению или мотивированный отказ в регистрации.
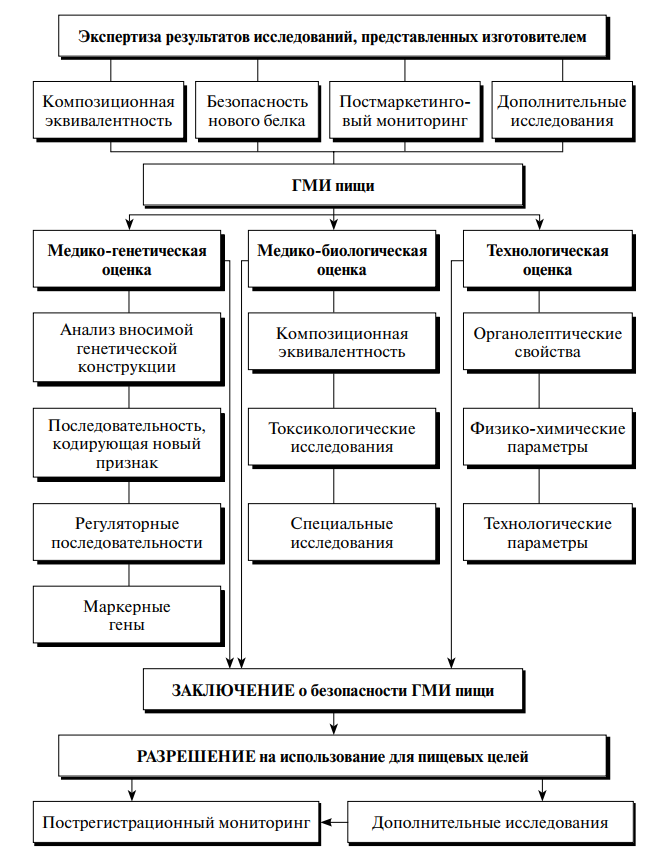
Рис. 11. Система оценки безопасности генетически модифицированных источников пищи в РФ [Генетически модифицированные источники пищи, 2007]
В настоящее время одной из первоочередных задач является совершенствование системы контроля за ГМО и усовершенствование методов оценки качества и безопасности для здоровья человека продовольственного сырья и продуктов питания из ГМО. В России разработаны два метода, позволяющие определить наличие ГМО в пищевых продуктах и продовольственном сырье, в основе которых лежит полимеразная цепная реакция (ПЦР). Метод ПЦР-анализа позволяет с высокой степенью чувствительности определять ДНК трансгенных растений в исследуемых образцах, при этом индикация трансгенных вставок осуществляется по наличию в образцах специальных регуляторных последовательностей, обеспечивающих правильную экспрессию внесенных генов. Однако для точного анализа результата исследования необходимо не только обнаружение регуляторных последовательностей, лишь косвенно указывающих на трансформационное событие, но и определение конкретной линии генетически модифицированного растения, позволяющее провести как качественную, так и количественную оценку содержания ГМО в исследуемом образце.
Для осуществления подобных исследований необходимо наличие тест-систем, обнаруживающих цельный ген, введенный в растение, а также тест-системы, содержащей стандартные образцы с заранее известной концентрацией трансгенной ДНК (для построения калибровочного графика), на основе которой и определяется, не превышает ли концентрация ГМО в образце установленных 0,9 %.