Содержание страницы
Вода, не являясь собственно питательным веществом, жизненно необходима как стабилизатор температуры тела, переносчик нутриентов (питательных веществ) и пищеварительных отходов, реагент и реакционная среда в ряде химических превращений, стабилизатор конформации биополимеров и, наконец, как вещество, облегчающее динамическое поведение макромолекул, включая проявление ими каталитических (энзиматических) свойств.
Вода — важная составляющая пищевых продуктов. Она присутствует в разнообразных растительных и животных продуктах как клеточный и внеклеточный компонент, как диспергирующая среда и растворитель, обусловливая их консистенцию и структуру и влияя на внешний вид, вкус и устойчивость продукта при хранении. Благодаря физическому взаимодействию с белками, полисахаридами, липидами и солями вода вносит значительный вклад в текстуру пищи.
Содержание влаги (в %) в пищевых продуктах изменяется в широких пределах:
- Мясо 65–75
- Мука 12–14
- Молоко 87
- Kофе-зерна (обжаренный) 5
- Фрукты, овощи 70–95
- Сухое молоко 4
- Хлеб 35
- Пиво, соки 87–90
- Мед 20
- Сыр 37
- Масло, маргарин 16–18
- Джем 28
Многие виды пищевых продуктов содержат большое количество влаги, что отрицательно сказывается на их стабильности в процессе хранения. Поскольку вода непосредственно участвует в гидролитических процессах, ее удаление или связывание за счет увеличения содержания соли или сахара тормозит многие реакции и ингибирует рост микроорганизмов, таким образом удлиняя сроки хранения продуктов.
Важно также отметить, что удаление влаги путем высушивания или замораживания существенно влияет на химический состав и природные свойства продукта. Это определяет интерес исследователей к изучению свойств и особенностей поведения воды и льда в пищевых продуктах.
1. Физические и химические свойства воды и льда
1.1. Физические свойства воды и льда
Вода имеет молекулярную массу, примерно равную 18,02, и может существовать в состояниях жидкости, пара и льда, характеризующихся следующими показателями фазовых переходов:
Точка при 101,3 кПа (1 атм),°С
- замерзания (плавления) 0,00
- кипения 100,00
Тройная точка
- температура,°С 0,0099
- давление, Па (мм рт. ст.) 610,4 (4,579)
Теплота, кДж/моль (ккал/моль)
- плавления при 0 °С 6,01 (1,435)
- парообразования при 100 °С 40,63 (9,704)
- сублимации при 0 °С 50,91 (12,16)
Как видно из этих данных, для воды характерны высокая температура кипения и плавления, высокие значения теплоты фазовых переходов (плавления, парообразования, сублимации). По этим свойствам вода существенно отличается от гидридов некоторых элементов, расположенных близко к кислороду в периодической системе (СН4, NН3, НF, Н2S, НСl). Это иллюстрируется некоторыми сведениями, представленными в табл. 1.
Вода обладает аномально высокой теплоемкостью. Это имеет большое значение в жизни природы — в ночное время, а также при переходе от лета к зиме вода остывает медленно, а днем или при переходе от зимы
Таблица 1. Физические свойства некоторых гидридов
| Вещество | Точка плавления, °С | Точка кипения, °С | Теплота парообразования при 100 °C, ккал/моль |
| СН4 | –184 | –161 | 2,20 |
| NН3 | –78 | –33 | 5,55 |
| НF | –92 | +19 | 7,22 |
| Н2О | 0 | +100 | 9,70 |
к лету так же медленно нагревается, являясь, таким образом, регулятором температуры на земном шаре.
Вода обнаруживает необычное свойство расширяться при замерзании, вследствие чего плотность льда ниже, чем воды при той же температуре (табл. 2), что нехарактерно для других веществ при переходе из жидкого состояния в твердое. Среди других аномалий воды следует отметить высокое значение поверхностного натяжения и диэлектрической постоянной и значительную теплопроводность (табл. 2).
Теплопроводность воды выше, чем других жидкостей, а льда — больше, чем других неметаллических твердых веществ. Следует также отметить, что теплопроводность льда при 0 °С приблизительно в четыре раза больше, чем воды при той же температуре, то есть лед проводит тепло значительно быстрее, чем иммобилизованная (неподвижная) вода, находящаяся в тканях. Если при этом учесть, что температуропроводность льда на порядок выше, чем воды, становится понятным, почему ткани замерзают быстрее, чем оттаивают, если задается одинаковая (но обратная) разность температур.
Таблица 2. Влияние температуры на некоторые свойства воды и льда
| Показатели | Вода при температуре, °C | Лед при температуре, °C | ||
| 20 | 0 | 0 | -20 | |
| Плотность, г/см3 | 0,9982 | 0,9998 | 0,9168 | 0,9193 |
| Давление водяного пара, Па (мм рт. ст.) | 2337 (17,53) | 610,4 (4,58) | 610,4 (4,580) | 103,4 (0,77) |
| Вязкость, Па · с | 1,002 · 10-3 | 1,787 · 10-3 | — | — |
| Поверхностное натяжение, Н/мм | 72,75 · 10-3 | 75,6 · 10-3 | — | — |
| Теплоемкость, Дж/(кг · К) | 4,18 | 4,22 | 2,10 | 1,95 |
| Теплопроводность, Дж/(м · с · К) | 5,98 · 102 | 5,64 · 102 | 22,40 · 103 | 24,33 · 102 |
| Температуропроводность, м2/с | 1,4 · 10-5 | 1,3 · 10-5 | 1,1 · 10-4 | 1,1 · 10-4 |
| Диэлектрическая проницаемость | 80,36 | 80 | 91 | 98 |
1.2. Диаграмма состояния воды
Диаграмма состояния (или фазовая диаграмма) представляет собой графическое изображение зависимости между величинами, характеризующими состояние системы, и фазовыми превращениями в системе (переход из твердого состояния в жидкое, из жидкого в газообразное и т. д.).
Для однокомпонентных систем обычно используются диаграммы состояния, показывающие зависимость фазовых превращений от температуры и давления; они называются диаграммами состояния в координатах Р – t.
На рис. 1 приведена в схематической форме (без строгого соблюдения масштаба) диаграмма состояния воды. Любой точке на диаграмме отвечают определенные значения температуры и давления.
Диаграмма показывает те состояния воды, которые термодинамически устойчивы при определенных значениях температуры и давления. Она состоит из трех кривых, разграничивающих все возможные температуры и давления на три области, отвечающие льду, жидкости и пару.
Кривая ОА представляет зависимость давления насыщенного водяного пара от температуры: точки кривой показывают те пары значений температуры и давления, при которых жидкая вода и водяной пар находятся в равновесии друг с другом. Кривая ОА называется кривой равновесия жидкость–пар, или кривой кипения.
Кривая ОС — кривая равновесия твердое состояние–жидкость, или кривая плавления, — показывает те пары значений температуры и давления, при которых лед и жидкая вода находятся в равновесии.
Кривая ОВ — кривая равновесия твердое состояние–пар, или кривая сублимации. Ей отвечают те пары значений температуры и давления, при которых в равновесии находятся лед и водяной пар.
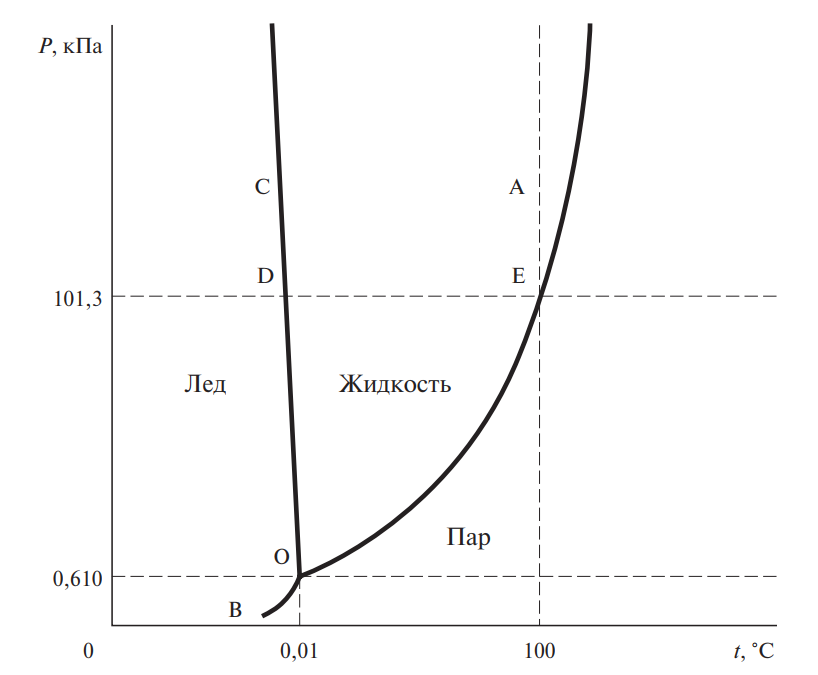
Рис. 1. Диаграмма состояния воды в области невысоких давлений
Все три кривые пересекаются в точке О. Координаты этой точки — это единственная пара значений температуры и давления, при которых в равновесии могут находиться все три фазы: лед, жидкая вода и пар. Она носит название тройной точки.
Тройная точка отвечает давлению водяного пара 0,610 кПа и температуре 0,01 °С.
Диаграмма состояния воды имеет значение при разработке технологических режимов для получения пищевых продуктов. Например, как следует из рис. 1, если лед нагревается при давлении меньше чем 0,610 кПа (4,58 мм рт. ст.), то он непосредственно переходит в пар. Это является основой при разработке способов получения пищевых продуктов сушкой замораживанием.
Одной из особенностей воды, отличающих ее от других веществ, является понижение температуры плавления льда с ростом давления. Это обстоятельство отражается на рис. 1. Кривая плавления ОС на диаграмме состояния воды идет вверх влево, тогда как почти для всех других веществ она идет вверх вправо.
Превращения, происходящие с водой при атмосферном давлении, отражаются на диаграмме точками или отрезками, расположенными на горизонтали, отвечающей 101,3 кПа (760 мм рт. ст.). Так, плавление льда или кристаллизация воды отвечает точке D, кипение воды — точке Е, нагревание или охлаждение воды — отрезку DЕ и т. п.
1.3. Свойства воды и строение ее молекул
Аномальные свойства воды предполагают существование прочных сил между молекулами воды. Это можно объяснить уже при рассмотрении природы единичной молекулы воды, а затем и группы молекул. Шесть валентных электронов кислорода в молекуле воды гибридизированы в четырех sр3-орбиталях, которые вытянуты к углам, образуя тетраэдр.
Две гибридные орбитали образуют О–Н-ковалентные связи с углом 105°, тогда как другие две орбитали имеют неподеленные электронные пары. Ковалентные О–Н-связи благодаря высокой электроотрицательности кислорода частично (на 40 %) имеют ионный характер.
Таким образом, молекула воды имеет два отрицательных и два положительных заряда по углам тетраэдра. Вследствие этого каждая молекула воды тетраэдрически координирована с четырьмя другими молекулами воды благодаря водородным связям (рис. 2). Энергия диссоциации водородной связи ~25 кДж/моль.
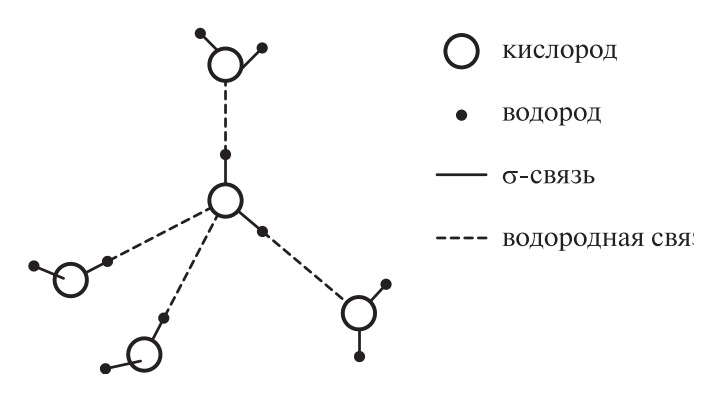
Рис. 2. Тетраэдрическая координация молекул воды
Одновременное присутствие в молекуле воды двух доноров и двух акцепторов делает возможной ассоциацию в трехмерную сеть, стабилизированную водородными связями, что обеспечивает большую силу взаимодействия между молекулами. Эта структура объясняет особые физические свойства воды, необычные для малых молекул. Так, например, спирт и соединения с изоэлектрическими диполями, такие как НF или NH3, образуют, в отличие от воды, только линейную или двухмерную ассоциацию.
Частичная поляризация Н–О-связи в дальнейшем усиливается за счет образования водородных связей. Поэтому дипольный момент комплекса, состоящего из увеличенного числа водных молекул (мультимолекулярный диполь), тем больше, чем больше молекул ассоциировано и, естественно, больше дипольного момента единичной молекулы. Как следствие, диэлектрическая постоянная воды оказывается большой и превышает величину, которая может быть вычислена на основе дипольного момента единичной молекулы.
Транспорт (перенос) протона осуществляется вдоль водородной связи. Это поистине прыжок протона от одной молекулы воды к соседней молекуле воды. Независимо от того, получен ли протон путем диссоциации воды или будет получен от кислоты, он будет погружаться в орбитали неподеленных электронов молекулы, образуя гидратированный ион водорода H О+ (ион гидроксония) с исключительно сильной водородной связью (энергия диссоциации — 100 кДж/моль):
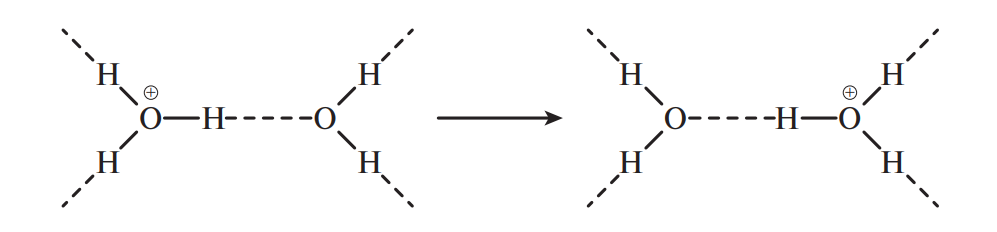
Подобный механизм действует и в транспорте ионов ОН–, который осуществляется вдоль водородных связей:
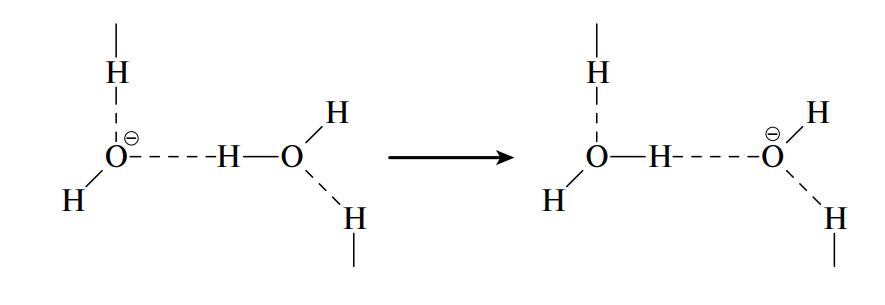
Переход протона от одного атома кислорода к другому осуществляется чрезвычайно быстро (v > 1012 c–1), поэтому подвижность протона весьма велика. Она превышает подвижность других ионов в 4–5 раз и соизмерима только с подвижностью ионов ОН–, которая, однако, примерно на 40 % меньше. При этом скорость протонов во льду примерно в 100 раз больше, чем в воде.
Способность воды образовывать трехмерные водородные связи, для разрушения которых необходима дополнительная энергия, объясняет рассмотренные выше необычные свойства воды, например высокие значения теплоемкости, точек плавления и кипения, поверхностного натяжения и теплот фазовых переходов.
Вода может влиять на конформацию макромолекул, если там имеют место какие-либо нековалентные связи, которые стабилизируют конформацию большой молекулы. Эти нековалентные связи могут быть трех видов: водородные, ионные и неполярные. В белках существует конкуренция между СО…HN водородными связями и вода–амид водородными связями. Чем больше способность растворителя к образованию водородных связей, тем слабее СО…HN связь. В водной среде теплота образования или разрыва этой связи равна нулю. Это означает, что СО…HN водородная связь не может обеспечить стабилизацию в водном растворе. Конкурирующая водородная связь от Н2О ослабляет термодинамическую тенденцию к образованию СО…HN водородных связей.
Водные молекулы вокруг неполярных групп (молекул) становятся более упорядоченными, приводя к потере энтропии, и в результате возникает тенденция к ассоциации отдельных неполярных групп в водной среде с другими, большими чем водные, молекулами (гидрофобное взаимодействие). Концепция гидрофобной связи схематично показана на рис. 3.
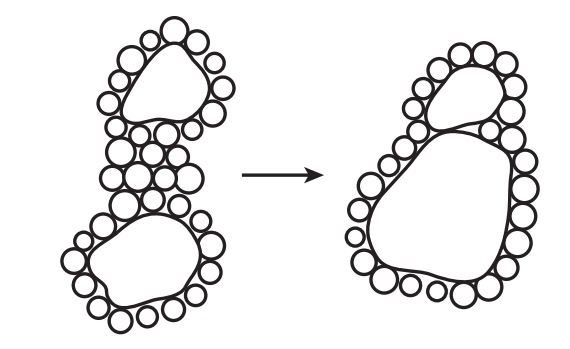
Рис. 3. Образование гидрофобной связи
С химической точки зрения вода является весьма реакционноспособным веществом. Она соединяется со многими оксидами металлов и неметаллов, взаимодействует с активными металлами и вступает в различные другие реакции самого разнообразного характера.
Превращения белков, липидов, углеводов с участием воды имеют важное значение в пищевых технологиях.
Помимо химических реакций, в которые вступает вода, при растворении веществ в воде имеют место взаимодействия физико-химического характера. Ниже мы кратко рассмотрим взаимодействие воды с ионами и ионными группами, группами, обладающими способностью к образованию водородных
связей, и с неполярными веществами (группами). Эти взаимодействия необходимо принимать во внимание при рассмотрении классификации видов влаги в пищевых продуктах и ее причастности к химическим, биохимическим и микробиологическим изменениям в продукте при хранении.
1.4. Взаимодействие вода–растворенное вещество
При добавлении различных веществ к воде изменяются свойства как самого вещества, так и воды. Гидрофильные вещества взаимодействуют с водой путем ион-дипольного или диполь-дипольного механизма, вызывая изменения в структуре воды, ее подвижности, а также в структуре и реакционной способности гидрофильных веществ. Гидрофобные группы добавленных веществ взаимодействуют с близлежащей водой слабо, предпочитая неводное окружение.
Молекулы около гидрофобных групп становятся более упорядоченными, что приводит к уменьшению энтропии. Чтобы уменьшить контакт с водой, гидрофобные группы агрегируются. Как уже говорилось, этот процесс известен как гидрофобное взаимодействие.
Взаимодействие воды с ионами и ионными группами. Вода, взаимодействующая с ионами и ионными группами, является наиболее прочно связанной в пищевых продуктах. Нормальная структура чистой воды (основанная на водородных связях тетраэдрическая конфигурация) нарушается при добавлении диссоциирующих веществ. Для простых неорганических ионов, которые не обладают донорными или акцепторными местами для образования водородных связей, связь просто полярна. Простейший пример — гидратированные ионы хлорида натрия. Вода в мультислое существует в структурно разрушенном состоянии из-за конкурирующего влияния, с одной стороны, монослоя, с другой — внешней массы воды.
Способность ионов изменять структуру воды тесно связана с силой электрического поля иона. Малые и (или) многовалентные (главным образом положительные) ионы, такие как Li+, Na+, Н3О+, Ca2+, Ba2+, Мg2+, Al3+ , F– , ОН– , имеют сильное электрическое поле и являются образователями сетчатой структуры. Около каждого из этих ионов расположено от 4 до 6 молекул воды. Связанная вода менее лабильна и обладает более плотной структурой по сравнению с чистой водой (рис. 4).
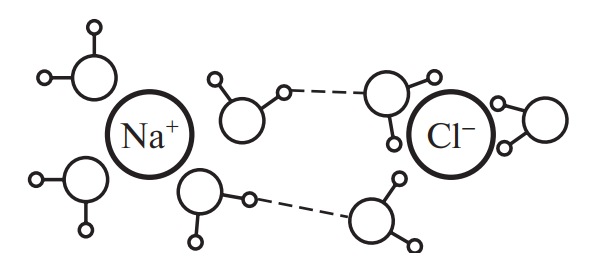
Рис. 4. Структура связанной воды
Большие и моновалентные ионы (главным образом отрицательно заряженные ионы и большие положительные ионы), такие как К+, Cs+, NH4+, Cl–, Br–, I–, NO3–, BrO3–, IО3— и СlО4–, имеют относительно слабое электрическое поле и являются разрушителями сетчатой структуры, хотя для К++ этот эффект очень слаб.
Благодаря различной способности ионов гидратироваться, изменять водную структуру, влиять на диэлектрическую постоянную водной среды и толщину двойного электрического слоя около коллоидов они сильно воздействуют на суспендированные и другие растворенные вещества в среде. Поэтому, например, конформация белков и стабильность коллоидов сильно зависят от вида и количества присутствующих ионов.
Взаимодействие воды с нейтральными группами, обладающими способностью образовывать водородные связи. Водородные связи вода–растворенное вещество являются более слабыми, чем при взаимодействиях вода–ион. Тем не менее вода, связанная посредством водородных связей с растворенным веществом, может быть классифицирована как «органически связанная» или «близлежащая» и должна проявлять пониженную подвижность по сравнению с водой в массе раствора (водной фазы).
Можно ожидать, что вещества, способные к образованию водородных связей, не повышают или, по крайней мере, не разрушают нормальную структуру чистой воды. Однако в ряде случаев отмечается ориентация водородных связей, отличная от нормальной структуры воды.
Водородные связи воды образуются с различными группами (гидроксил-, амино-, карбонил-, амидили имино-). Например, вода образует водородные связи с двумя видами функциональных групп белков. Эти связи могут быть как в одной макромолекуле между различными группами, так и между разными макромолекулами:
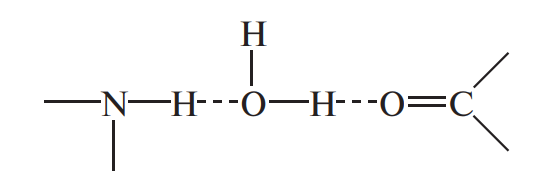
Взаимодействие вода–неполярное вещество. В системе «вода–неполярное вещество» важны два аспекта структурных образований: образование клатратных гидратов и гидрофобные взаимодействия в белках.
Клатратные гидраты являются соединениями включения, то есть это соединения, имеющие молекулу-«хозяина», образующуюся за счет водородных связей, и молекулу-«гостя». Образования такого типа имеют место в биологических материалах.
«Гости» в клатратных гидратах являются низкомолекулярными соединениями, а «хозяин» представляет собой «сетку» из 20–74 водных молекул. Типичные «гости» — это низкомолекулярные углеводороды, галогенуглеводороды, диоксид углерода, этиленоксид, этиловый спирт, короткоцепочные первичные, вторичные и третичные амины, алкил-аммоний. Взаимодействие между водой и «гостем» часто обусловлено слабыми ван-дер-ваальсовыми силами, но может иметь место и электростатическое взаимодействие.
Клатратные гидраты имеют важное значение, таккак влияют на конформацию, реакционноспособность и стабильность таких молекул, как белки. Гидрофобные взаимодействия в водном окружении также важны, так как примерно 40 % общих аминокислот в большинстве белков имеют неполярные группы. Неполярные группы других компонентов, таких как спирты, жирные кислоты, свободные аминокислоты, также могут участвовать в гидрофобных взаимодействиях. Эти взаимодействия являются слабыми, по силе они примерно такие же, как силы Ван-дер-Ваальса. Гидрофобные взаимодействия важны для четвертичной структуры многих белков, поэтому вода (и водная структура) играет важную роль в конформации белка.
1.5. Структура и свойства льда
Молекула воды, кристаллизуясь, может связывать четыре других молекулы воды в тетраэдрической конфигурации. Поэтому образующийся лед имеет гексагональную кристаллическую решетку. Структура льда была установлена методами дифракции рентгеновских лучей, нейтронов и электронов, ИК- и Рамановской спектроскопии.
Обычный лед принадлежит к бипирамидальному классу гексагональных систем. Кроме того, лед может существовать в девяти других кристаллических полиморфных конфигурациях, а также в аморфном состоянии неопределенной структуры. Однако только обычная гексагональная структура льда стабильна при нормальных условиях (760 мм рт. ст., 0 °С).
Надо отметить, что лед состоит не только из НОН-молекул, ориентированных так, что один атом водорода расположен на линии между каждой парой кислородных атомов. Чистый лед содержит также и ионы Н+ (Н3О+) и ОН–. Кроме того, кристаллы льда не являются совершенными, и имеющие место дефекты связаны с изменением положения протонов, сопровождаемым новой (нейтральной) ориентацией или изменениями ионного характера (с образованием Н3О+ или ОН–).
Наличием этих дефектов можно объяснить большую мобильность протона во льду, чем в воде, и небольшое увеличение электрической проводимости при замерзании воды. Кроме того, каждая молекула воды может колебаться (предполагая, что она колеблется как единое целое) с амплитудой около 0,4 A° при –10 °С. Следует также иметь в виду, что молекулы воды, которые, по-видимому, существуют в некоторых образующих щели пространствах льда, могут медленно диффундировать через решетку.
Вполне вероятно, что величина активности воды аw во льду имеет определенное отношение к скорости порчи пищевых продуктов и биологических веществ в условиях хранения при низких температурах.
На структуру кристаллов льда оказывают влияние растворенные вещества. Тем не менее для большинства пищевых продуктов и биологических материалов наиболее характерна гексагональная структура. Она была обнаружена при замораживании модельных водных растворов сахарозы, глицерина, альбумина и других соединений.
2. Свободная и связанная влага в пищевых продуктах
Вода в пищевых продуктах играет, как уже отмечалось, важную роль, так как обусловливает консистенцию и структуру продукта, а ее взаимодействие с присутствующими компонентами определяет устойчивость продукта при хранении.
Общая влажность продукта указывает на количество влаги в нем, но не характеризует ее причастность к химическим, биохимическим и микробиологическим изменениям в продукте. В обеспечении его устойчивости при хранении важную роль играет соотношение свободной и связанной влаги. Связанная влага — это ассоциированная вода, прочно связанная с различными компонентами — белками, липидами и углеводами за счет химических и физических связей.
Свободная влага — это влага, не связанная полимером и доступная для протекания биохимических, химических и микробиологических реакций.
Рассмотрим некоторые примеры.
При влажности зерна 15–20 % связанная вода составляет 10–15 %. При большей влажности появляется свободная влага, способствующая усилению биохимических процессов (например, прорастанию зерна).
Плоды и овощи имеют влажность 75–95 %. В основном, это свободная вода, однако примерно 5 % влаги удерживается клеточными коллоидами в прочно связанном состоянии. Поэтому овощи и плоды легко высушить до 10–12 %, но сушка до более низкой влажности требует применения специальных методов.
Большая часть воды в продукте может быть превращена в лед при –5 °С, а вся — при –50 °С и ниже. Однако определенная доля прочно связанной влаги не замерзает даже при температуре –60 °С.
«Связывание воды» и «гидратация» — определения, характеризующие способность воды к ассоциации с различной степенью прочности с гидрофильными веществами. Размер и сила связывания воды или гидратации зависит от таких факторов, как природа неводного компонента, состав соли, рН, температура.
Что же такое связанная вода? Надо сказать, что в ряде случаев термин «связанная вода» используется без уточнения его смысла, однако предлагается и достаточно много его определений. В соответствии с ними связанная влага:
- характеризует равновесное влагосодержание образца при некоторой температуре и низкой относительной влажности;
- не замерзает при низких температурах (–40 °С и ниже);
- не может служить растворителем для добавленных веществ;
- дает полосу в спектрах протонного магнитного резонанса;
- перемещается вместе с макромолекулами при определении скорости седиментации, вязкости, диффузии;
- существует вблизи растворенного вещества и других неводных веществ и имеет свойства, значительно отличающиеся от свойств всей массы воды в системе.
Указанные признаки дают достаточно полное качественное описание связанной воды. Однако ее количественная оценка по тем или иным признакам не всегда обеспечивает сходимость результатов. Поэтому большинство исследователей склоняются к определению связанной влаги только по двум из перечисленных выше признаков: это вода, которая существует вблизи растворенного вещества и других неводных компонентов, имеет уменьшенную молекулярную подвижность и другие свойства, отличающиеся от свойств всей массы воды в той же системе, и не замерзает при –40 °С.
Такое определение объясняет физическую сущность связанной воды и обеспечивает возможность сравнительно точной ее количественной оценки, так как вода, не замерзающая при –40 °С, может быть измерена с удовлетворительным результатом (например, методом ПМР или калориметрически). При этом действительное содержание связанной влаги изменяется в зависимости от вида продукта.
Причины связывания влаги в сложных системах различны. Наиболее прочно связанной является так называемая органически связанная вода. Она представляет собой очень малую часть воды в высоковлажных пищевых продуктах и находится, например, в щелевых областях белка или в составе химических гидратов. Другой весьма прочно связанной водой является близлежащая влага, представляющая собой монослой при большинстве гидрофильных групп неводного компонента.
Вода, ассоциированная таким образом с ионами и ионными группами, является наиболее прочно связанным типом близлежащей воды. К монослою примыкает мультислойная вода (вода полимолекулярной адсорбции), образующая несколько слоев за близлежащей водой. Хотя мультислой — это менее прочно связанная влага, чем близлежащая, она все же еще достаточно тесно связана с неводным компонентом, и потому ее свойства существенно отличаются от чистой воды. Таким образом, связанная влага состоит из «органической», близлежащей и почти всей воды мультислоя.
Кроме того, небольшие количества воды в некоторых клеточных системах могут иметь уменьшенные подвижность и давление пара из-за нахождения воды в капиллярах. Уменьшение давления пара и активности воды (аw ) становится существенным, когда капилляры имеют диаметр меньше, чем 0,1 мкм. Большинство же пищевых продуктов имеют капилляры диаметром от 10 до 100 мкм, которые, по-видимому, не могут заметно влиять на уменьшение аw в пищевых продуктах.
В пищевых продуктах имеется также вода, удерживаемая макромолекулярной матрицей. Например, гели пектина и крахмала, растительные и животные ткани при небольшом количестве органического материала могут физически удерживать большие количества воды.
Хотя структура этой воды в клетках и макромолекулярной матрице точно не установлена, ее поведение в пищевых системах и важность для качества пищи очевидна. Эта вода не выделяется из пищевого продукта даже при большом механическом усилии. С другой стороны, в технологических процессах обработки она ведет себя почти как чистая вода. Ее, например, можно удалить при высушивании или превратить в лед при замораживании. Таким образом, свойства этой воды как свободной несколько ограничены, но ее молекулы ведут себя подобно водным молекулам в разбавленных солевых растворах.
Именно эта вода составляет главную часть воды в клетках и гелях, и изменение ее количества существенно влияет на качество пищевых продуктов. Например, хранение гелей часто приводит к потере их качества из-за потери этой воды (так называемого синерезиса). Консервирование замораживанием тканей часто приводит к нежелательному уменьшению способности к удерживанию воды в процессе оттаивания.
В табл. 3 и 4 описаны свойства различных видов влаги в пищевых продуктах.
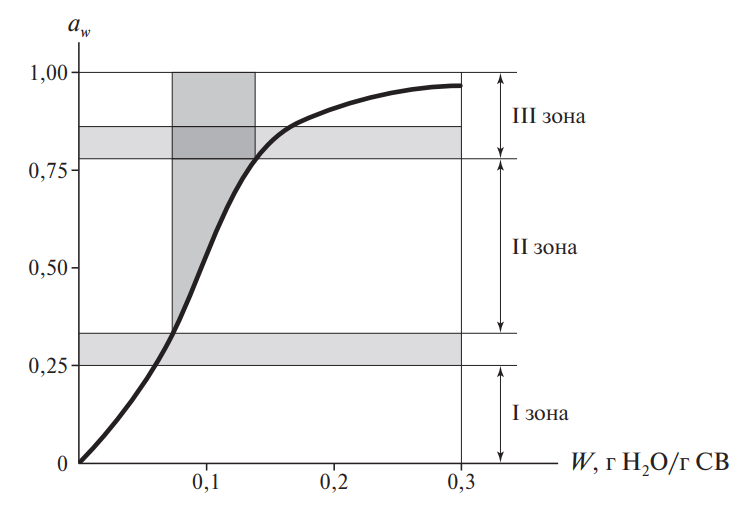
Рис. 5. Изотерма сорбции влаги для области низкого содержания влаги в пищевых продуктах
Таблица 3. Категории свободной влаги в пищевых продуктах (Fennema)
| Cвойства | Свободная вода | Вода в макромолекулярной матрице |
| Общее описание | Вода, которая может быть легко удалена из продукта. Вода—вода-водородные связи преобладают. Имеет свойства, похожие на воду в слабых растворах солей. Обладает свойством свободного истечения | Вода, которая может быть удалена из продукта. Водавода—водородные связи превалируют. Свойства воды подобны воде в разбавленных солевых растворах. Свободное истечение затруднено матрицей геля или ткани |
| Точка замерзания | Несколько ниже по сравнению с чистой водой | |
| Способность быть растворителем | Большая | |
| Молекулярная подвижность по сравнению с чистой водой | Несколько меньше | |
| Энтальпия парообразования по сравнению с чистой водой | Без существенных изменений | |
| Содержание в расчете на общее содержание влаги в продуктах с высокой влажностью (90% Н2О) | ~ 96% | |
| Зона изотермы сорбции (рис. 5) | Вода в зоне III состоит из воды, присутствующей в зонах I и II, + вода, добавленная или удаленная внутри зоны III | |
| В отсутствии гелей и В присутствии гелей или клеточных структур эта клеточных структур вся вода вода является свободной, связана в макромолекулярнижняя граница зоны III ной матрице. Нижняя нечеткая и зависит от граница зоны III нечеткая и продукта и температуры зависит от продукта и температуры | ||
| Обычная причина порчи пищевых продуктов | Высокая скорость большинства реакций. Рост микроорганизмов | |
Таблица 4. Категории связанной влаги в пищевых продуктах (Fennema)
| Свойства | Органически связанная вода | Монослой | Мультислой |
| Общее описание | Вода как общая часть неводного компонента | Вода, которая сильно взаимодействует с гидрофильными группами неводных компонентов путем вода—ион, или вода—диполь ассоциации; вода в микрокапиллярах (d — 0,1 мкм) | Вода, которая примыкает к монослою и которая образует несколько слоев вокруг гидрофильных групп неводного компонента. Превалируют вода–вода и вода–растворенное вещество–водородные связи |
| Точка замерзания по сравнению с чистой водой | Не замерзает при –40 °С | Не замерзает при –40 °С | Большая часть не замерзает при –40 °С. Остальная часть замерзает при значительно пониженной температуре |
| Способность служить растворителем | Нет | Нет | Достаточно слабая |
| Молекулярная подвижность по сравнению с чистой водой | Очень малая | Существенно меньше | Меньше |
| Энтальпия парообразования по сравнению с чистой водой | Сильно увеличена | Значительно увеличена | Несколько увеличена |
| Содержание в расчете на общее содержание влаги в продуктах с высокой влажностью (90% Н2О), % Зона изотермы сорбции (рис. 5) | — 0,03
Органически связанная вода показывает практически нулевую активность и, таким образом, существует в экстремально левом конце зоны I |
0,1–0,9
Вода в зоне I изотермы состоит из небольшого количества органической влаги с остатком монослоя влаги. Верхняя граница зоны I не является четкой и варьирует в зависимости от продукта и температуры |
1–5
Вода в зоне II состоит из воды, присутствующей в зоне I, + вода, добавленная или удаленная внутри зоны II (мультислойная влага). Граница зоны II не является четкой и варьирует в зависимости от продукта и температуры |
| Стабильность пищевых продуктов | Самоокисление | Оптимальная стабильность при аw = 0,2—0,3 | Если содержание воды увеличивается выше нижней части зоны II, скорость почти всех реакций увеличивается |
3. Активность воды
Давно известно, что существует взаимосвязь (хотя и далеко не совершенная) между влагосодержанием пищевых продуктов и их сохранностью (или порчей). Поэтому основным методом удлинения сроков хранения пищевых продуктов всегда было уменьшение содержания влаги путем концентрирования или дегидратации.
Однако часто различные пищевые продукты с одним и тем же содержанием влаги портятся по-разному. В частности, было установлено, что при этом имеет значение, насколько вода ассоциирована с неводными компонентами: сильнее связанная вода меньше способна поддержать процессы, разрушающие (портящие) пищевые продукты, такие как рост микроорганизмов и гидролитические химические реакции.
Чтобы учесть эти факторы, был введен термин «активность воды». Этот термин, безусловно, лучше характеризует влияние влаги на порчу продукта, чем просто содержание влаги. Естественно, существуют и другие факторы (такие как концентрация О2, рН, подвижность воды, тип растворенного вещества), которые в ряде случаев могут сильно влиять на разрушение продукта. Тем не менее водная активность хорошо коррелирует со скоростью многих разрушительных реакций, она может быть измерена и использована для оценки состояния воды в пищевых продуктах и ее причастности к химическим и биохимическим изменениям.
Активность воды (аw ) — это отношение давления паров воды над данным продуктом к давлению паров над чистой водой при той же
температуре. Это отношение входит в основную термодинамическую формулу определения энергии связи влаги с материалом (уравнение Ребиндера):
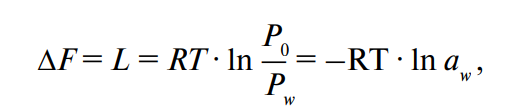
где ΔF — уменьшение свободной энергии (при постоянной температуре); L — работа отрыва 1 моля воды от сухого скелета материала (без изменения состава); R — универсальная газовая постоянная.
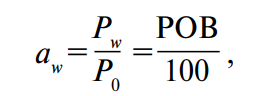
где Pw — давление водяного пара в системе пищевого продукта; P0 — давление пара чистой воды; РОВ — относительная влажность в состоянии равновесия, при которой продукт не впитывает влагу и не теряет ее в атмосферу, %.
По величине активности воды (табл. 5) выделяют: продукты с высокой влажностью (aw = 1,0–0,9); продукты с промежуточной влажностью (aw = 0,9–0,6); продукты с низкой влажностью (aw = 0,6–0,0).
Таблица 5. Активность воды (aw ) в некоторых пищевых продуктах
| Продукт | Влажность, % | аw | Продукт | Влажность, % | аw |
| Фрукты | 90—95 | 0,97 | Мука | 16—19 | 0,80 |
| Яйца | 70—80 | 0,97 | Мед | 10—15 | 0,75 |
| Мясо | 60—70 | 0,97 | Kарамель | 7—8 | 0,65 |
| Сыр | 40 | 0,92—0,96 | Печенье | 6—9 | 0,60 |
| Джем | 30—35 | 0,82—0,94 | Шоколад | 5—7 | 0,40 |
| Хлеб | 40—50 | 0,95 | Сахар | 0—0,15 | 0,10 |
| Kекс | 20—28 | 0,83 |
3.1. Изотермы сорбции
Кривые, показывающие связь между содержанием влаги (масса воды, г Н2О/г СВ*) в пищевом продукте с активностью воды в нем при постоянной температуре, называются изотермами сорбции. Информация, которую они дают, полезна для характеристики процессов концентрирования и дегидратации (так как простота или трудность удаления воды связана с aw ), а также для оценки стабильности пищевого продукта (что будет рассмотрено ниже). На рис. 6 изображена изотерма сорбции влаги для продуктов с высокой влажностью (в широкой области влагосодержания).
Однако, с учетом наличия связанной влаги, больший интерес представляет изотерма сорбции для области низкого содержания влаги в пищевых продуктах (см. рис. 5). Для понимания значения изотермы сорбции полезно рассмотреть зоны I — III.
Свойства воды в продукте сильно отличаются по мере перехода от зоны I (низкие влагосодержания) к зоне III (более высокая влажность). Зона I изотермы соответствует воде, наиболее сильно адсорбированной и наиболее неподвижной в пищевых продуктах. Эта вода абсорбирована благодаря полярным вода — ион и вода — диполь взаимодействиям. Энтальпия парообразования этой воды много выше, чем чистой воды, и она не замерзает при –40 °С. Такая влага не способна быть растворителем, и не присутствует в значительных количествах, чтобы влиять на пластичные свойства твердого вещества; она просто является его частью.
Высоковлажный конец зоны I (граница зон I и II) соответствует монослою влаги. В целом зона I соответствует чрезвычайно малой части всей влаги в высоковлажном пищевом продукте.
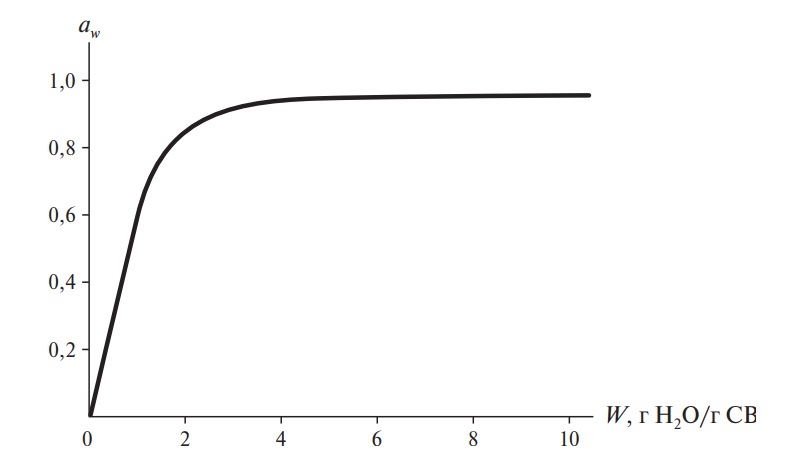
Рис. 6. Изотерма сорбции влаги для продуктов с высокой влажностью
Вода в зоне II состоит из воды зоны I и добавленной влаги (ресорбция) для получения воды, заключенной в зону II. Эта влага образует мультислой и взаимодействует с соседними молекулами через вода — вода — водородные связи. Энтальпия парообразования для мультислойной воды несколько больше, чем для чистой воды.
Большая часть этой воды не замерзает при –40 °С, как и вода, добавленная к пищевому продукту с содержанием влаги, соответствующим границе зон I и II. Эта вода участвует в процессе растворения, действует как пластифицирующий агент и способствует набуханию твердой матрицы. Вода в зонах II и I обычно составляет менее 5 % от общей влаги в высоковлажных пищевых продуктах.
Вода в зоне III изотермы состоит из воды, которая была в зоне I и II, и добавленной для образования зоны III. В пищевом продукте эта влага наименее связана и наиболее мобильна. В гелях или клеточных системах она является физически связанной, так что ее макроскопическое течение затруднено. Во всех других отношениях эта вода имеет те же свойства, что и вода в разбавленном солевом растворе.
Вода, добавленная (или удаленная) для образования зоны III, имеет энтальпию парообразования практически такую же, как чистая вода, она замерзает и является растворителем, что важно для протекания химических реакций и роста микроорганизмов. Обычная влага зоны III (не важно, свободная или удерживаемая в макромолекулярной матрице) составляет более 95 % от всей влаги в высоковлажных материалах.
Состояние влаги, как будет показано ниже, имеет важное значение для стабильности пищевых продуктов.
В заключение тут следует отметить, что изотермы сорбции, полученные добавлением воды (ресорбция) к сухому образцу, не совпадают полностью с изотермами, полученными путем десорбции. Это явление называется гистерезисом.
Изотермы сорбции влаги для многих пищевых продуктов имеют гистерезис (рис. 7), величина которого, наклон кривых, точки начала и конца петли гистерезиса могут значительно изменяться в зависимости от таких факторов, как природа пищевого продукта, температура, скорость десорбции, уровень воды, удаленной при десорбции.
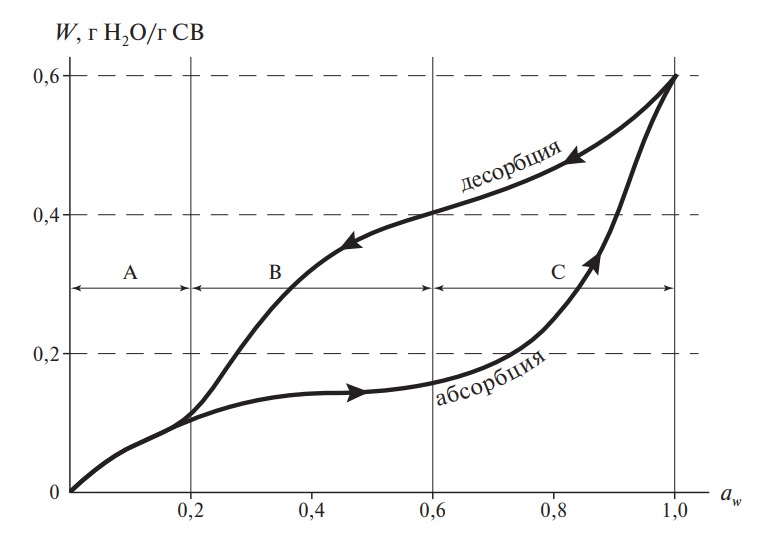
Рис. 7. Гистерезис изотермы сорбции влаги
Как правило, изотерма абсорбции (ресорбции) нужна при исследовании гигроскопичности продуктов, а десорбции — полезна для изучения процессов высушивания.
3.2. Активность воды и стабильность пищевых продуктов
С учетом вышесказанного ясно, что стабильность пищевых продуктов и активность воды тесно связаны.
На рис. 8 показано отношение между aw и скоростью различных реакций, происходящих в пищевых продуктах при температуре 25–45 °С.
Для сравнения здесь же представлена изотерма сорбции. Нужно помнить, что точная скорость реакции, наклон кривых и т. д. могут несколько изменяться в зависимости от состава, физического состояния, структуры образца, состава атмосферы (особенно присутствия кислорода), температуры, эффекта гистерезиса.
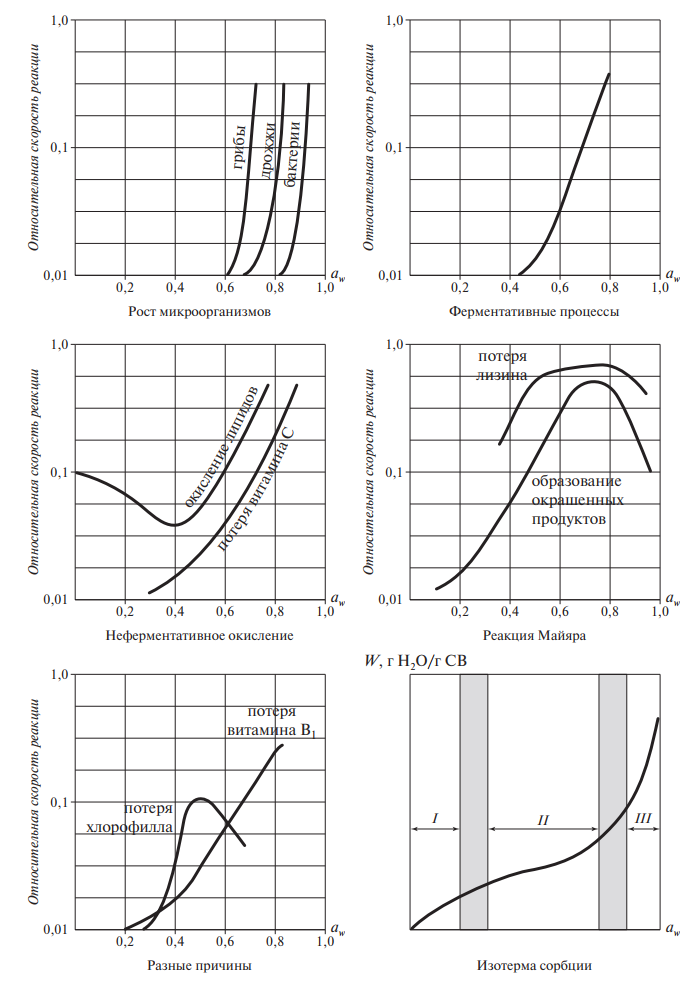
Рис. 8. Влияние аw на скорость реакций в пищевых продуктах
В продуктах с низкой влажностью могут происходить окисление жиров, неферментативное потемнение, потеря водорастворимых веществ (витаминов), порча, вызванная ферментами. Активность микроорганизмов здесь подавлена. В продуктах с промежуточной влажностью могут протекать разные процессы, в том числе с участием микроорганизмов. В процессах, протекающих при высокой влажности, микроорганизмам принадлежит решающая роль.
Для большинства химических реакций, показанных на рис. 8, бол´ ьшая, или максимальная, скорость имеет место, как правило, в области aw, характерной для продуктов с промежуточной влажностью (0,7–0,9). Минимальная скорость этих реакций на кривой изотермы наблюдается на границе зон I и II (aw = 0,2–0,4), и для всех реакций, кроме окисления липидов, скорость остается минимальной, если aw еще меньше. Влагосодержание, соответствующее этому состоянию, составляет мономолекулярный слой. Окисление липидов начинается при низкой aw.
По мере ее увеличения скорость окисления уменьшается примерно до границы зон I и II на изотерме, а затем снова увеличивается до границы зон II и III. Дальнейшее увеличение aw снова уменьшает скорость окисления (на рис. 8 не показано). Эти изменения можно объяснить тем, что при добавлении воды к сухому материалу сначала имеет место столкновение с кислородом. Эта вода (зона I) связывает гидропероксиды, сталкивается с продуктами их распада и таким образом препятствует окислению. Кроме того, добавленная вода гидратирует ионы металлов, которые катализируют окисление, уменьшая их действенность.
Добавление воды за границей I—II приводит к увеличению скорости окисления. Предполагается, что вода, добавленная в этой области изотермы, может ускорять окисление путем увеличения растворимости кислорода и набухания макромолекул. При еще больших значениях aw (больше чем 0,8) имеет место уменьшение скорости окисления, что можно объяснить разбавлением катализаторов, приводящим к уменьшению их действия. На модельных системах (глюкоза — глицин, глюкоза — лизин) показано влияние aw на реакцию неферментативного потемнения. При aw = 0,75 и температуре 40 °С продолжительность реакции потемнения составляет 40 часов (глюкоза — лизин); при aw = 0,55 и температуре 40 °С — 192 часа (глюкоза — глицин). Максимум потемнения наблюдается при aw = 0,6–0,75.
Наблюдаемый максимум потемнения может объясняться наступлением равновесия в процессе диффузии, которая регулируется величиной вязкости, степенью растворения и массообменом. При низкой активности воды медленная диффузия реагентов замедляет скорость реакции. По мере увеличения влагосодержания более свободная диффузия ускоряет реакцию, пока в верхней точке диапазона влажности растворение реагентов снова не замедляет ее. Точно так же более высокая концентрация воды замедляет ход реакции на тех обратимых стадиях, на которых образуется вода.
Ферментативные реакции могут протекать при более высоком содержании влаги, чем влага монослоя, то есть тогда, когда есть свободная вода. Она необходима для переноса субстрата. Учитывая это, легко понять, почему скорость ферментативных реакций зависит от aw.
При аw, соответствующей влаге монослоя, нет свободной воды для переноса субстрата. Кроме того, в ряде ферментативных реакций вода сама играет роль субстрата. На рис. 9 показано влияние аw на ферментативные процессы в сублимированной говядине при ее хранении. Распад АТФ и глюкозо-6-фосфата существенно увеличивается при увеличении аw от 0,4 до 0,7. Ферментативные процессы под действием липаз имели место даже при аw = 0,1–0,2. Это, по-видимому, связано с тем, что липиды в меньшей степени нуждаются в воде как транспортном средстве, ибо подвижность самих липидов достаточна, чтобы образовать фермент-субстратный комплекс.
В табл. 6 приведены предельные значения aw для роста микроорганизмов (средние данные по разным источникам). Для большинства бактерий предельное значение aw = 0,9, но, например, для S. aureus aw = 0,86.
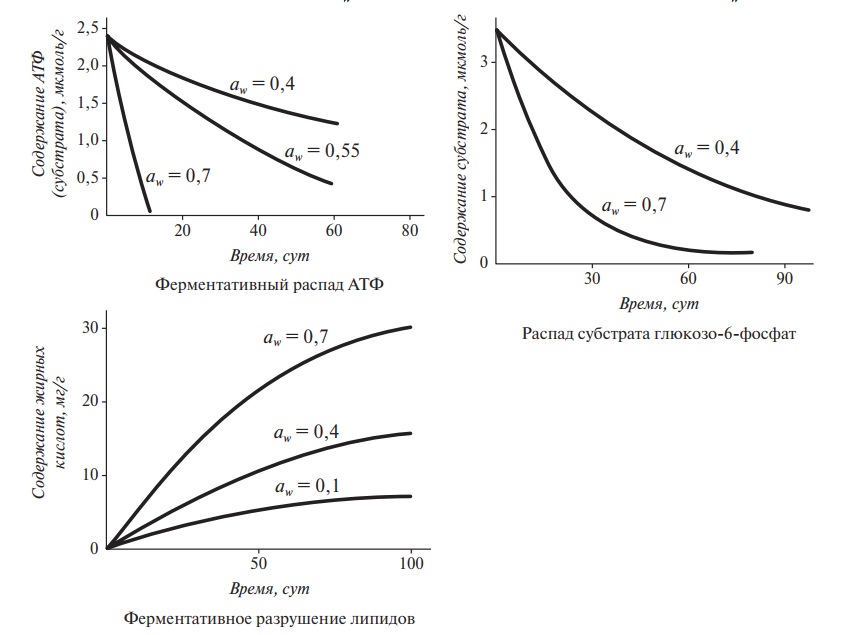
Рис. 9. Ферментативные процессы при хранении сублимированного мяса
Этот штамм продуцирует целый ряд энтеротоксинов типа А, В, С, D, Е. Большинство пищевых отравлений связаны с токсинами А и D. Дрожжи и плесени могут расти при более низких значениях активности воды.
Таблица 6. Предельные значения aw для роста микроорганизмов, встречающихся в пищевых продуктах
| Минимальное
значение aw |
Бактерии | Дрожжи | Плесени |
| 0,98 | Pseudomonas | ||
| 0,96 | Klebsiella; Shigella | ||
| 0,93 | Clostridium; Lactobacillus | ||
| 0,92 | Salmonella | ||
| 0,90 | Vibrio; Pediococcus | Rhodotorula;
Saccharomyces* |
|
| 0,88 | Candida, Torulopsis;
Debariomyces |
Clodosporium | |
| 0,86 | Staphylococcus | ||
| 0,80 | Saccharomyces* | Penicillium; Aspergillus* | |
| 0,75 | Hulophilic bacteria | ||
| 0,62 | Saccharomyces* | ||
| 0,60 | Aspergillus* |
* Некоторые штаммы.
При хранении пищевых продуктов активность воды оказывает влияние на жизнеспособность микроорганизмов (рис. 10). Поэтому активность воды в продукте имеет значение для предотвращения его микробиологической порчи.
В основном порчу продуктов с промежуточной влажностью вызывают дрожжи и плесени, меньше — бактерии. Дрожжи вызывают порчу сиропов, кондитерских изделий, джемов, сушеных фруктов; плесени — мяса, джемов, пирожных, печенья, сушеных фруктов (табл. 7).
Эффективным средством для предупреждения микробиологической порчи и целого ряда химических реакций, ухудшающих качество пищевых продуктов при хранении, является снижение активности воды в пищевых продуктах (рис. 10).
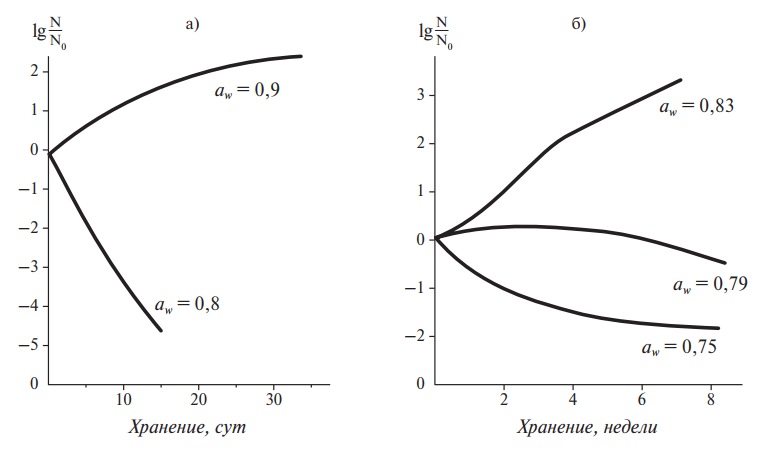
Рис. 10. Жизнеспособность S. aureus в кубиках свинины (а) и Asp. niger в куриных кубиках (б) при 25 °С и разной активности воды
Для снижения активности воды используют такие технологические приемы, как сушка, вяление, добавление различных веществ (сахар, соль и др.), замораживание. С целью достижения той или иной активности воды в продукте можно применять следующие технологические приемы:
- адсорбция — продукт высушивают, а затем увлажняют до определенного уровня влажности;
- сушка посредством осмоса — пищевые продукты погружают в растворы, активность воды в которых меньше активности воды пищевых продуктов (рис. 11).
Часто для этого используют растворы сахара или соли. В этом случае имеет место два противотока: из раствора в продукт диффундирует растворенное вещество, а из продукта в раствор — вода. К сожалению, природа этих процессов сложна, и в литературе нет достаточных данных по этому вопросу.
Для достижения требуемой активности воды добавляют различные ингредиенты в продукт, обработанный одним из указанных выше способов, и дают ему возможность прийти в равновесное состояние, так как один лишь процесс сушки часто не позволяет получить нужную консистенцию. Применяя увлажнители, можно увеличить влажность продукта, но снизить aw. Потенциальными увлажнителями для пищевых продуктов являются крахмал, молочная кислота, сахара, глицерин и др.
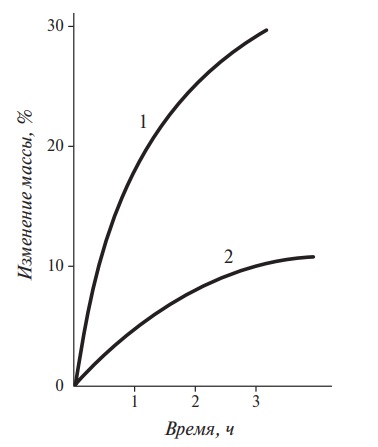
Рис. 11. Потеря влаги и поглощение углеводов кусочками яблок в процессе осмотической обработки: 1 — потеря влаги; 2 — увеличение содержания сухих веществ в яблоках
Таблица 7. Активность воды и рост микроорганизмов в пищевых продуктах (Fennema, 1985)
| Область
aw |
Микроорганизмы, которые
ингибируются при более низком значении aw, чем эта область |
Пищевые продукты, характерные
для этой области aw |
| 1,00—0,95 | Pseudomonas; Escherichia;
Proteus; Shigella, Klebsiella; Bacillus; Clostridium perfingens; некоторые дрожжи |
Фрукты, овощи, мясо, рыба, молоко, домашняя колбаса и хлеб, продукты с содержанием сахара (~40%), хлорида натрия (~7%) |
| 0,95—0,91 | Salmonella, Vibrio
parahaemolyticus, C. botulinum, Serratia, Lactobacillus, Pediococcus, некоторые грибы, дрожжи (Rhodotorula, Pichia) |
Некоторые сыры, консервированная ветчина, некоторые фруктовые концентраты соков, продукты с содержанием сахара (~55%), хлорида натрия (~12%) |
| 0,91—0,87 | Многие дрожжи (Candida;
Torulopsis, Hansenula) Micrococcus |
Ферментированная колбаса типа салями, сухие сыры, маргарин, рыхлые бисквиты, продукты с содержанием сахара (65%), хлорида натрия (15%). |
| 0,87—0,80 | Многие грибы
(микотоксигенные пенициллы Penicillium); Staphylococcus aureus; большинство Saccharomyces; Debaryomyces |
Большинство концентратов фруктовых соков, сладкое сгущенное молоко, шоколад, сироп, мука, рис, взбитые изделия с содержанием влаги 15—17%, фруктовые пирожные, ветчина |
| 0,80—0,75 | Большинство галофильных
бактерий, микотоксигенные аспергиллы |
Джем, мармелад, замороженные фрукты |
| 0,75—0,65 | Kсерофильные виды плесеней
(грибов) (Asp. chevalieri; Asp. canidus; Wallemia sebi); Saccharomyces bisporus |
Патока, сухие фрукты, орехи |
| 0,65—0,60 | Осмофильные дрожжи
(Saccharomyces rouxii); некоторые плесени (Asp. echinulatus, Monascus bisporus) |
Сухофрукты, содержащие 15—20% влаги, карамель, мед |
| 0,5 | Нет микроорганизмов | Тесто с влажностью 12%, специи с влажностью 10% |
| 0,4 | Нет микроорганизмов | Яичный порошок с влажностью ~5% |
| 0,3 | Нет микроорганизмов | Печенье, крекеры, сухари с
влажностью ~3—5% |
| 0,2 | Нет микроорганизмов | Сухое молоко с влажностью ~2—3%, сухие овощи с влажностью ~5%, зерновые хлопья с влажностью ~5%, крекеры |
В табл. 8 приведены данные о содержании влаги в некоторых потенциальных увлажнителях пищевых продуктов при трех уровнях активности воды.
Таблица 8. Содержание влаги в некоторых продуктах при комнатной температуре
| Продукт | Влажность, % СВ, |
при aw | ||
| 0,7 | 0,8 | 0,9 | ||
| Глицерин | 64 | 108 | 215 | |
| Сахароза | 38 | 56 | 77 | |
| Сахарный гидролизат
с глюкозным эквивалентом: |
||||
| 10 | 15 | 23 | 40 | |
| 42 | 26 | 37 | 80 | |
На рис. 12 показано влияние увлажнителей, снижающих активность воды, на реакцию неферментативного потемнения.
Помимо влияния на химические реакции и рост микроорганизмов, активность воды имеет значение и для текстуры продуктов. Например, максимальная активность воды, допустимая в сухих продуктах без потери желаемых свойств, может изменяться в пределах 0,35–0,5 в зависимости от вида продукта (сухое молоко, крекеры, инстант-продукты и т. п.). Большая aw необходима для продуктов мягкой текстуры, которые не должны обладать хрупкими свойствами.
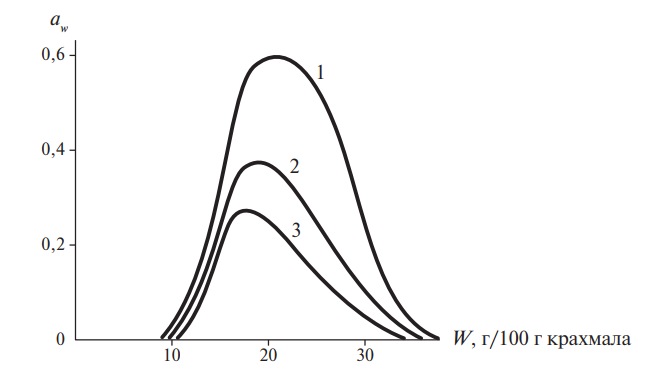
Рис. 12. Неферментативное потемнение желатинированного картофельного крахмала (λ = 420 нм): 1 — контроль; 2 — с добавлением 10 % глицерина; 3 — с добавлением 10 % лактата натрия
4. Роль льда в обеспечении стабильности пищевых продуктов
Замораживание является наиболее распространенным способом консервирования (сохранения) многих пищевых продуктов. Необходимый эффект при этом достигается в большей степени от воздействия низкой температуры, чем от образования льда. Последнее в клеточных структурах пищевых продуктов и гелях имеет два важных следствия:
- а) неводные компоненты концентрируются в незамерзающей фазе (незамерзающая фаза существует в пищевых продуктах при всех температурах хранения);
- б) вся вода, превращаемая в лед, увеличивается примерно на 9 % в объеме.
Во время замораживания вода переходит в кристаллы льда различной, но достаточно высокой степени чистоты. Все неводные компоненты поэтому концентрируются в уменьшенном количестве незамерзшей воды. Благодаря этому эффекту незамерзшая фаза существенно изменяет такие свойства, как рН, титруемая кислотность, ионная сила, вязкость, точка замерзания, поверхностное натяжение, окислительно-восстановительный потенциал. Структура воды и взаимодействие «вода — растворенное вещество» также могут сильно изменяться.
Эти изменения могут увеличить скорости реакций. Таким образом, замораживание имеет два противоположных влияния на скорость реакций: низкая температура как таковая будет ее уменьшать, а концентрирование компонентов в незамерзшей воде — иногда увеличивать (табл. 9). Так, в ряде исследований показано увеличение при замораживании скорости реакций неферментативного потемнения, имеющих место при различных реакциях.
Таблица 9. Влияние температуры и концентрирования растворенного вещества при замораживании на скорость реакций
| Опыт | Изменение скорости, вызванное | Относительное влияние двух эффектов | Общий эффект замораживания на скорость реакции | |
| понижением
температуры (7) |
концентрированием растворенных веществ и другими эффектами льда (5) | |||
| 1 | Уменьшение | Уменьшение | Кооперативное | Уменьшается |
| 2 | То же | Слегка увеличивается | Т> S | Незначительно
уменьшается |
| 3 | « | Средне увеличивается | T*S | Нет влияния |
| 4 | « | Значительно
увеличивается |
Т< S | Увеличивается |
-
- Роль льда в обеспечении стабильности пищевых продуктов
Ускорение процессов неферментативного потемнения при замораживании представлено ниже:

Фактор возможности увеличения скорости различных реакций в замороженных продуктах необходимо учитывать при их хранении, поскольку этот фактор будет влиять на качество продукта (табл. 10).
Многочисленными исследованиями показано, что существенное снижение скорости реакций (более чем в 2 раза) имеет место при хранении пищевых продуктов в условиях достаточно низкой температуры (–18 °С).
На рис. 13 показано изменение такого важного показателя для качества пищевых продуктов, как инсолюбилизация белка, в течение 30 дней в зависимости от температуры.
Таблица 10. Примеры увеличения скорости ферментативных реакций при замораживании
| Тип реакции | Образец | Температура, при
которой наблюдалось увеличение скорости реакции,°С |
| Потеря гликогена и (или) аккумулирование молочной кислоты | Рыба, говядина, масло, птица | –2,5 до –6 |
| Деградация высокоэнергетических фосфатов | То же | –2 до –8 |
| Гидролиз фосфолипидов | Треска | –4 |
| Окисление L-аскорбиновой кислоты | Земляника | –6 |
Солюбилизация (коллоидное растворение) — проникновение низкомолекулярного вещества внутрь мицелл поверхностно-активного вещества или макромолекулярных клубков полимера.
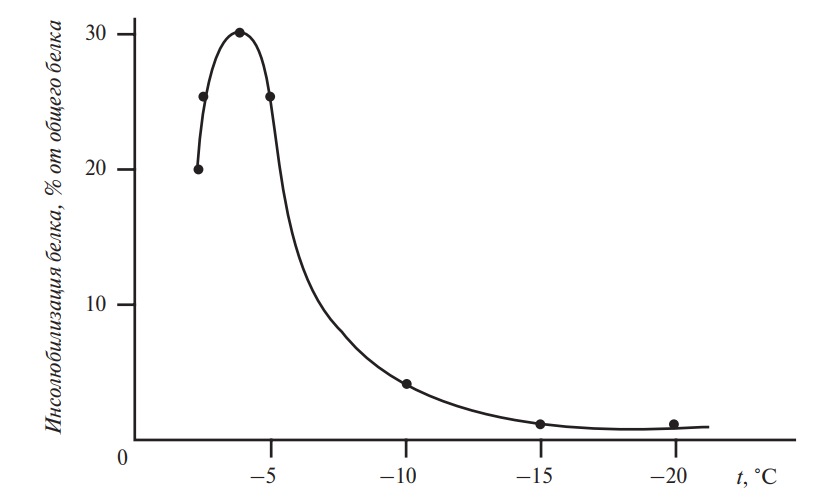
Рис. 13. Инсолюбилизация белка в течение 30 дней
При отрицательных температурах, достаточно близких к температуре замерзания воды (0 °С), имеет место увеличение доли несолюбилизованного белка. При температуре –18 °С инсолюбилизация белка уменьшается существенно, и это создает оптимальные условия для хранения продуктов.
5. Методы определения влаги в пищевых продуктах
5.1. Определение общего содержания влаги
Высушивание до постоянной массы. Содержание влаги рассчитывают по разности массы образца до и после высушивания в сушильном шкафу при температуре 100–105 °С. Это стандартный метод определения влаги в технохимическом контроле пищевых продуктов. Поскольку в основе метода лежит высушивание образца до постоянной массы, метод требует много времени для проведения анализа.
Титрование по модифицированному методу Карла Фишера. Метод основан на использовании реакции окисления-восстановления с участием йода и диоксида серы, которая протекает в присутствии воды. Использование специально подобранных органических реагентов позволяет достичь полного извлечения воды из пищевого продукта, а использование в качестве органического основания имидазола способствует практически полному протеканию реакции. Содержание влаги в продукте рассчитывается по количеству йода, затраченному на титрование. Метод отличается высокой точностью и стабильностью результатов (в том числе при очень низком содержании влаги) и быстротой проведения анализа.
5.2. Определение свободной и связанной влаги
Дифференциальная сканирующая калориметрия. Если образец охладить до температуры меньше 0 °С, то свободная влага замерзнет, связанная — нет. При нагревании замороженного образца в калориметре можно измерить тепло, потребляемое при таянии льда. Незамерзающая вода определяется как разница между общей и замерзающей водой.
Термогравиметрический метод. Метод основан на определении скорости высушивания. В контролируемых условиях граница между областью постоянной скорости высушивания и областью, где эта скорость снижается, характеризует связанную влагу.
Диэлектрические измерения. Метод основан на том, что при 0 °С значения диэлектрической проницаемости воды и льда примерно равны. Но если часть влаги связана, то ее диэлектрические свойства должны сильно отличаться от диэлектрических свойств объемной воды и льда.
Измерение теплоемкости. Теплоемкость воды больше, чем теплоемкость льда, так как с повышением температуры в воде происходит разрыв водородных связей. Это свойство используют для изучения подвижности молекул воды. Значение теплоемкости воды в зависимости от ее содержания в полимерах дает сведения о количестве связанной воды. Если при низких концентрациях вода специфически связана, то ее вклад в теплоемкость мал. В области высоких значений влажности ее в основном определяет свободная влага, вклад которой в теплоемкость примерно в 2 раза больше, чем льда.
ЯМР. Метод заключается в изучении подвижности воды в неподвижной матрице. При наличии свободной и связанной влаги получают две линии в спектре ЯМР вместо одной для объемной воды.