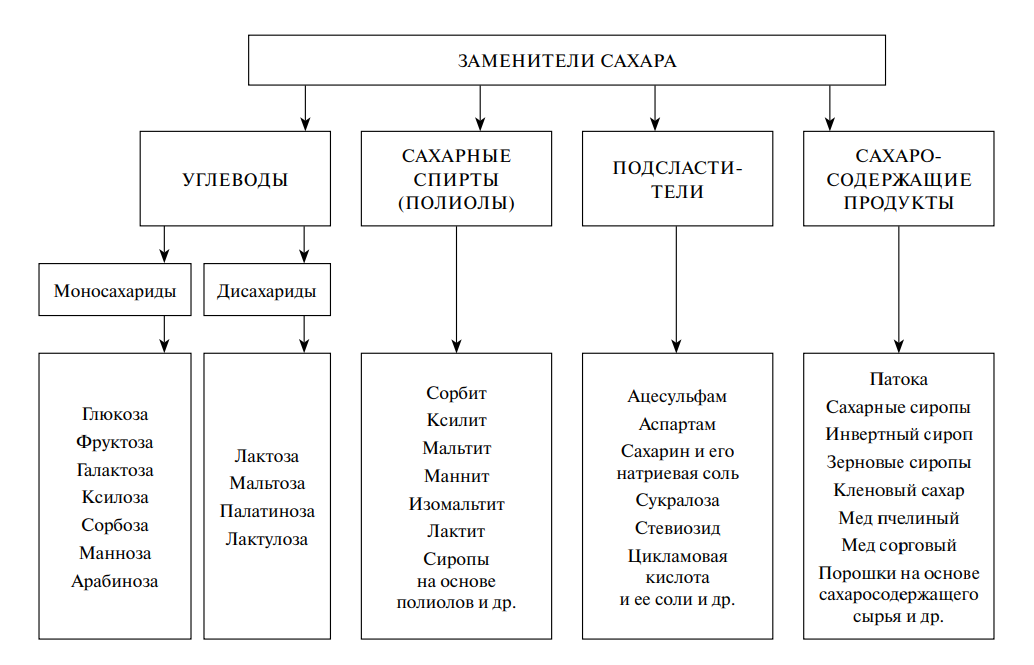
Содержание страницы
- 1. Белки в питании человека. Проблема белкового дефицита на земле
- 2. Белково-калорийная недостаточность и ее последствия. Пищевые аллергии
- 3. Аминокислоты и их функции в организме
- 4. Незаменимые аминокислоты. Пищевая и биологическая ценность белков
- 5. Строение пептидов и белков. Физиологическая роль пептидов
- 6. Белки пищевого сырья
- 7. Новые формы белковой пищи. Проблема обогащения белков лимитирующими аминокислотами
- 8. Функциональные свойства белков
- 9. Превращения белков в технологическом потоке
- 10. Состав и техно-функциональные свойства белковых композитов
Белки, или протеины, — высокомолекулярные азотсодержащие органические соединения, молекулы которых построены из остатков аминокислот. Названием «белки» (или «белковые вещества») в отечественной литературе принято обозначать класс соединений, которые, по аналогии с белком куриного яйца, при кипячении (денатурации) приобретают белый цвет. Термин «протеины», введенный Барцелиусом в 1838 г., происходит от греческого слова pro~tos, означающего «первый». Оно достаточно точно отражает главенствующее биологическое значение важнейшего класса соединений, которое заключается в обеспечении сложной иерархии молекулярной структуры и специфических функций живых организмов.
В природе существует примерно от 1010 до 1012 различных белков, составляющих основу 1,2 · 106 видов живых организмов, начиная от вирусов и заканчивая человеком. Огромное разнообразие белков обусловлено способностью 20 протеиногенных α-аминокислот взаимодействовать друг с другом с образованием полимерных молекул с молекулярной массой от 5000 до 1 млн (и более) дальтон*.
* Дальтон (Да) — единица массы, практически равная массе атома водорода (1,0000 по шкале атомных масс). Наименование дано в честь Д. Дальтона, разработавшего атомарную теорию строения материи. Килодальтон (кД) — единица массы, равная 1000 дальтон.
К примеру, включение в состав белка остатков только 15 аминокислот приводит к получению приблизительно 1,3 · 1012 изомеров. Поэтому нетрудно представить, какое многообразие белков со всеми особенностями структурной организации возможно в природе при условии включения в полимерную цепь около сотни и более протеиногенных аминокислот.
Каждый вид живых организмов характеризуется индивидуальным набором белков, определяемым наследственной информацией, закодированной в ДНК. Информация о линейной последовательности нуклеотидов ДНК переписывается в линейную последовательность аминокислотных остатков, которая, в свою очередь, обеспечивает самопроизвольное формирование трехмерной устойчивой структуры индивидуального белка. Расположение белковых молекул в пространстве определяет их биологические функции, главными из которых являются структурная (кератин волос, ногтей, коллаген соединительной ткани, эластин, муцины слизистых выделений), каталитическая (ферменты), транспортная (гемоглобин, миоглобин, альбумины сыворотки), защитная (антитела, фибриноген крови), сократительная (актин, миозин мышечной ткани), гормональная (инсулин поджелудочной железы, гормон роста, гастрин желудка) и резервная (овальбумин яйца, казеин молока, ферритин селезенки).
Резервная, или питательная, функция заключается в использовании белков в качестве источника аминокислот, расходующихся на синтез белков и других активных соединений, регулирующих процессы обмена, например, в развивающемся плоде или проростках растений. Подобного рода белки откладываются про запас в процессах созревания семян и жизнедеятельности животных. Поэтому их еще называют запасными. Запасные белки растительного происхождения в соответствии с классификацией Осборна относятся к классам проламинов (глиадин пшеницы, гордеин ячменя, зеин кукурузы) и глютелинов (оризенин риса, глютенин пшеницы). Такие белки достаточно широко распространены в природе и в относительно большом количестве входят в состав пищи и кормов животных.
Белковые вещества участвуют в осуществлении множества и других важнейших процессов в организме, таких, например, как возбудимость, координация движений, дифференцировка клеток. Учитывая, что белки составляют значительную часть сухого вещества (с. в.) не только живых организмов, но и продуктов питания, и то, что они наделены рядом уникальных свойств и функций, которыми не обладают другие соединения, познание состава и структурно-функциональной их организации заключает в себе ответ на решение важнейших проблем не только в биологии и медицине, но и в производстве, хранении и потреблении пищевых изделий. Углубленное изучение данного класса соединений в курсе пищевой химии связано с необходимостью сохранения здорового образа жизни человека и ее продления. Этим следует руководствоваться специалистам, занятым в современном производстве пищевых продуктов.
В естественных науках проблема белка включает два аспекта. Первый из них заключается в исследовании природы белка и его биологических функций в качестве ингредиента протоплазмы клетки, играющего первостепенную роль в развитии живых организмов (прижизненные процессы). Второй включает изучение его ресурсов как обязательного компонента пищи, путей их увеличения (с приданием особого значения белку растительного происхождения), разработку способов улучшения качества белка с учетом функциональных свойств и зависимости их от реакционной способности, структурной организации, физико-химических, биохимических и других видов превращений в технологических процессах производства и хранения пищевых продуктов. Несмотря на то что обе стороны проблемы изучения белка самостоятельны, в то же время они и взаимосвязаны, поскольку дополняют друг друга конкретными знаниями как при изучении физиологических процессов в организме, так и процессов приготовления пищи при разработке продуктов питания и условий их хранения. Вопросы первого аспекта проблемы белка составляют предмет изучения биохимии и молекулярной биологии, второго — пищевой химии.
1. Белки в питании человека. Проблема белкового дефицита на земле
Белки в питании человека занимают особое место. Они выполняют ряд специфических функций, свойственных только живой материи. Белковые вещества наделяют организм пластическими свойствами, заключающимися в построении структур субклеточных включений (рибосомы, митохондрии и т. д.), и обеспечивают обмен между организмом и окружающей внешней средой. В обмене веществ участвуют как структурные белки клеток и тканей, так и ферментные и гормональные системы. Белки координируют и регулируют все то многообразие химических превращений в организме, которое обеспечивает функционирование его как единого целого.
Все элементы клеток находятся в процессе обновления, при котором распад уравновешивается ресинтезом, то есть имеет место стационарное состояние фиксации равновесия. О стационарном состоянии и целостности организма свидетельствует равновесие между скоростью синтеза и распада белков тела. Постоянный обмен и обновление осуществляются между тканевыми белками и фондом свободных аминокислот, образующихся в процессе переваривания пищи и поступающих в кровь (рис. 1). Белки в организме человека обновляются постоянно независимо от его возраста. В молодом растущем организме скорость синтеза белков превышает скорость распада; при тяжелых заболеваниях или голодании — наоборот. Наиболее быстрому обновлению подвергаются белки печени и слизистой оболочки кишечника (до 10 дней), наиболее медленному (до 180 дней) — белки мышц (миозин), соединительной ткани (коллаген) и мозга (миелин). Период обновления гормонов измеряется часами или даже минутами (инсулин). Скорость обновления белков выражается временем, необходимым для обмена половины всех молекул. Эта величина носит название периода полужизни (Т1/2). Средняя величина Т1/2 для белков всего организма составляет примерно 3 недели. Общая скорость синтеза белков у человека достигает 500 г в день, что почти в 5 раз превосходит потребление их с пищей. Достижение такого результата осуществляется за счет повторного использования продуктов распада белков и предшественников аминокислот в организме.
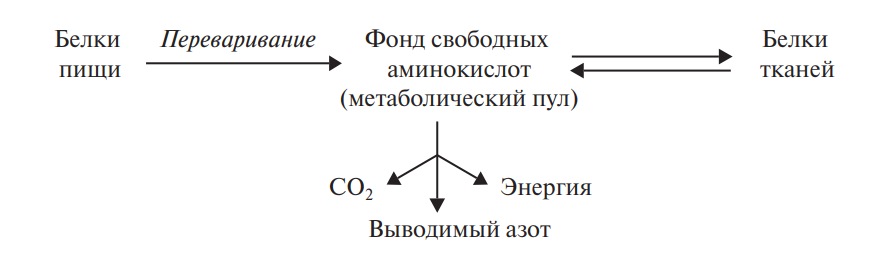
Рис. 1. Стационарное состояние обмена белков
Эффективность обмена белков в значительной степени зависит от количественного и качественного состава пищи. При поступлении белков с пищей ниже рекомендуемых норм в организме начинают распадаться белки тканей (печень, плазма крови и т. д.), а образующиеся аминокислоты расходуются на синтез ферментов, гормонов и других биологически активных соединений, необходимых для поддержания жизнедеятельности организма. Небольшое повышение количества белка в составе пищи значительного влияния на обмен веществ в организме человека не оказывает, так как избыток азотистых продуктов обмена выводится с мочой. Потребление белка в количестве более 2 г/кг массы тела считается вредным.
Состояние белкового обмена в большей степени зависит от недостатка или отсутствия незаменимых аминокислот. Клетки организма человека не могут синтезировать необходимые белки, если в составе пищи отсутствует хотя бы одна незаменимая аминокислота. Синтез белков также нарушается, если часть аминокислот в кишечнике разрушается патогенной микрофлорой, аминокислоты плохо всасываются, а протеолитические ферменты желудочно-кишечного тракта малоактивны. Удаление части аминокислот из организма с продуктами обмена веществ обусловливает его отрицательный азотистый баланс.
Показатель азотистого баланса используется для оценки степени обеспеченности человека белковой пищей. Он представляет собой разность между количеством поступающего с пищей азота и количеством азота, выводимого в виде конечных продуктов обмена, выраженными в одних и тех же единицах (г/сут). При положительном балансе количество выводимого из организма азота меньше количества азота, поступающего с пищей, а при отрицательном — количество выделяемого азота превышает количество азота, поступающего в течение суток. Положительный баланс азота характерен для молодого организма и беременных женщин, отрицательный — для людей, пища которых бедна белком, для больных с нарушениями процессов переваривания пищи и людей пожилого возраста.
Состояние, при котором количество азота, поступающего с пищей, равно количеству азота, выводимого из организма, характерно для азотистого равновесия. Им обладает здоровый взрослый человек, потребляющий полноценные белки в необходимом количестве. Азотистый баланс у такого организма равен нулю.
На состояние азотистого обмена любого организма существенное влияние оказывают жиры и калорийность пищи, витамины (В1, В2, В6, РР и др.), минеральные вещества и гормоны. Например, гормоны щитовидной железы и низкокалорийная диета стимулируют распад белков, а гормоны роста и половых желез, наоборот, способствуют их синтезу. Таким образом, организм человека требует обеспечения его белковой пищей, в противном случае могут развиваться патологические процессы и наступит гибель организма. Следовательно, здесь уместно рассмотреть нормы потребления человеком белка.
Средняя суточная физиологическая потребность человека в белке в течение более чем ста лет постоянно исследуется и периодически отражается в решениях ВОЗ, ФАО и национальных организаций различных стран. Эти величины носят ориентировочный характер, так как они находятся в стадии постоянного уточнения в зависимости от возраста человека, пола, характера профессиональной деятельности, физиологического состояния, климата, индивидуальных, национальных особенностей и степени загрязнения окружающей среды. В соответствии с рекомендациями ВОЗ и ФАО величина оптимальной потребности в белке составляет 60–100 г в сутки или 12–15 % от общей калорийности пищи. В общем количестве энергии на долю белка животного и растительного происхождения приходится по 6–8 %. В пересчете на 1 кг массы тела потребность белка в сутки у взрослого человека составляет 0,75 г, тогда как для детей, в зависимости от возраста, она колеблется от 1,05 до 4,00 г.
Приведенные здесь данные отражают общие требования к оптимальному уровню белка для обеспечения здоровья человека. К примеру, еще в 1904 г. Читтенден (Chittenden) установил, что уровень порядка 44–53 г белка в день способствует нормальному физиологическому состоянию взрослого человека (весом 70 кг). Известны случаи, когда люди хорошо себя чувствовали при употреблении и повышенного количества белка в день, например, мяса до 337 г в сутки (Shah, 1953). Это все крайние случаи, в питании следует придерживаться рекомендуемых норм.
Рекомендуемые нормы потребления пищевых веществ для основных групп населения, выработанные российской научной школой питания, включают 73–120 г белка в сутки для мужчин и 60–90 г — для женщин, в том числе белка животного происхождения 43–65 и 43–49 г, соответственно. Нижняя граница относится к тем, чья деятельность не связана с физическим трудом, верхняя — к людям, испытывающим тяжелые физические нагрузки. В среднем, для взрослого мужчины в возрасте 30 лет необходимый уровень потребления белка в пересчете на азот равен 9,0–9,2 г в сутки на 1 кг массы тела. Потребность в белке для лиц, перенесших инфекции, операции, болезни органов пищеварения, дыхания увеличивается в среднем до 110–120 г в день, а в высокобелковой диете, например у диабетиков, его количество может достигать 135–140 г. Белок ограничивается до 20–40 г в сутки при заболеваниях, связанных с почечной недостаточностью, подагре и некоторых других.
В мире существует дефицит пищевого белка и недостаток его в ближайшие десятилетия, вероятно, сохранится. На каждого жителя Земли приходится около 60 г белка в сутки, при норме 70 г. По данным Института питания РАМН, за последние годы в России потребление животных белковых продуктов снизилось на 25–35 % и соответственно увеличилось потребление углеводсодержащей пищи (картофель, хлебопродукты, макаронные изделия). Среднедушевое потребление белка уменьшилось на 17–22 %, в том числе с 47,5 до 38,8 г/сут белка животного происхождения (49 против 55 % рекомендуемых); в семьях с низким доходом потребление общего белка в сутки не превышает 29–40 г.
Снижение употребления белка с пищей соответствует современным мировым тенденциям снижения степени обеспеченности населения Земли белком. Общий дефицит белка на планете оценивается в 10–25 млн т в год. Из около 7 млрд человек, живущих на Земле, приблизительно половина страдает от недостатка белка. Нехватка пищевого белка является не только экономической, но и социальной проблемой современного мира. Не во всех странах продукты животного происхождения доступны широким слоям населения. В районах тропической Африки, Латинской Америки и Азии, население которых занято тяжелым сельскохозяйственным трудом, проблема обеспеченности белком яиц, мяса и молока особенно острая. До тех пор, пока животные белки будут оставаться ценным источником питания, экономически развитым странам предстоит решать проблемы по разработке рациональных способов хранения, сбыта продуктов животного происхождения и поиску новых ресурсов пищевого белка, в противном случае бо´льшая часть населения земного шара вынуждена будет употреблять в пищу только белки растительного происхождения, большинство которых, как правило, неполноценно по аминокислотному составу.
Традиционным путем увеличения ресурсов пищевого белка является повышение производительности растениеводства и животноводства на основе технологий возделывания зернобобовых, масличных, злаковых культур, употребляемых в пищу и на корм скоту. Наибольшие количества белка обеспечивают посевы зернобобовых культур (сои, нута, чечевицы, гороха, люпина). Однако бобовые культуры не являются традиционными культурами для многих народов, к тому же трудно достичь высоких урожаев и расширения площадей посева любой культуры в силу особенностей почвенно-климатических условий выращивания и применения агротехнических мероприятий.
Растительный рацион, содержащий полноценный белок в необходимом количестве, может быть создан на основе использования пищевых продуктов, полученных из разных источников. Например, кукуруза бедна триптофаном и лизином, а бобовые — метионином, поэтому смесь, состоящая из кукурузы и соевых белковых продуктов или овощей, обеспечивает поступление в организм «качественного» белка. Возможность же использования однокомпонентного состава диеты в пище человека повышается за счет практического применения достижений генетики растений. В нашей стране и за рубежом выведены сорта высоколизиновой кукурузы «Опейк-2», ячменя «Хайпроли», сорго, пшеницы с повышенным количеством белка. Путем скрещивания, например, ячменя «Хайпроли» с высокобелковыми мутантами, получены сорта с содержанием лизина 4,5–4,8 % и белка 13,5–15,5 %. Создан гибрид ржи и пшеницы (тритикале) с 3,7 % лизина и средним содержанием белка 13,4 %.
В последние годы все большее внимание уделяется получению новых видов белковой пищи, производство которых основано на использовании полноценных по аминокислотному составу растительных белков. Научные и практические основы производства пищевых изделий с применением белкового сырья растительного происхождения для замены продуктов из натурального мяса, рыбы и птицы в нашей стране заложены А. Н. Несмеяновым с сотрудниками еще в 1971 г. Однако, учитывая сложность и высокую стоимость отдельных стадий производства, данное направление пищевой промышленности только зарождается.
Увеличение количества пищевого белка за счет животноводства является менее перспективным путем по сравнению с растениеводством. На получение 1 кг животного белка, содержащегося в молоке, мясе и яйцах, требуется израсходовать 5–8 кг кормового белка. При этом коэффициенты трансформации растительных белков в белки высокопродуктивных животных и птиц очень низкие (25–39 %). В процессе трофической (пищевой) цепи теряется 60–75 % белка в непереваренных остатках корма, неутилизированных в организме аминокислотах, выделяемых с мочой в виде продуктов распада, в процессах обмена (движении, обновлении белков тканей и т. д.) и через кожно-волосяные покровы.
Особенно большие потери белков происходят за счет затрат на их биосинтез, так как животные белки значительно отличаются по аминокислотному составу от белков растений. Отсутствие у животных способности синтезировать ряд аминокислот приводит к тому, что свои потребности в последних они удовлетворяют за счет повышенного количества растительных белков. Организм животного может синтезировать ряд недостающих аминокислот, но только в ущерб деятельности гормональной и ферментативной систем. Отсюда актуальным является сбалансированное кормление животных (отходы мясомолочной, рыбной промышленности, соевый шрот и т. д.) в целях повышения коэффициента трансформации белков в животноводческую продукцию.
В ближайшие годы растениеводство и животноводство, вероятно, будут основными источниками пищевого белка, но важное место в решении белковой проблемы отводится и рыболовству. Однако и запасы морепродуктов ограничены, поэтому поиск новых эффективных путей покрытия белкового дефицита с учетом природных ресурсов каждой страны остается актуальным. Так, в недавнем прошлом Россия была единственной страной, производящей м икробиологический белок для кормления животных — БВК (белково-витаминный препарат). Из объема свыше 1 млн т/год 60 % продукции выпускалось на основе парафинов нефти, а 40 % — на основе гидролизатов древесины. Организация производства белка осуществлялась и с использованием спирта и природного газа. Такие технологические процессы экономически выгодны при отсутствии сои для кормления животных. По содержанию незаменимых аминокислот и витаминов дрожжевая масса не уступает, а иногда даже и превосходит соевые белки. Добавка БВК в корма экономит фуражное зерно (5 т на 1 т БВК) и увеличивает привесы животных.
В решении проблемы дефицита белка за последние два десятилетия определилось новое биотехнологическое направление — получение пищевых объектов с повышенным содержанием и улучшенным качеством белка методами генетической инженерии. Сущность генетической инженерии заключается в переносе генов любого организма в клетку реципиента для получения растений, животных или микроорганизмов с рекомбинированными генами, а следовательно, и с новыми полезными свойствами. Растения, животные и микроорганизмы, полученные генетической инженерией, называются генетически измененными, а продукты их переработки — трансгенными пищевыми продуктами (см. п. 7 и 6).
Генетическая инженерия, или рекомбинация in vitro, включает выделение чужеродного гена ДНК, получение гибридных (рекомбинированных) молекул ДНК и введение их в живые клетки модифицируемого, например, растения для получения новых признаков организма.
ДНК растения предварительно подвергается гидролизу ферментом рестриктазой в специфических участках двойной спирали, при этом на обоих концах расщепленной молекулы становятся свободными четыре нуклеотида, в которых азотистые основания представлены, например, тимином и аденином (ТТАА и ААТТ) (рис. 2). Ген, который необходимо встроить в ДНК, «выщипывают» из ДНК организма-донора с помощью того же фермента рестрикции так, чтобы его концы были комплементарными нуклеотидными последовательностями на концах ДНК модифицируемого организма (ААТТ и ТТАА). Обе ДНК «сшивают» вместе ферментом лигазой. Полученную рекомбинантную ДНК вводят в клетку растения, признаки которого хотят изменить. Клетка, размножаясь, образует клон, содержащий чужеродный ген, индуцирующий синтез белка с новой аминокислотной последовательностью.
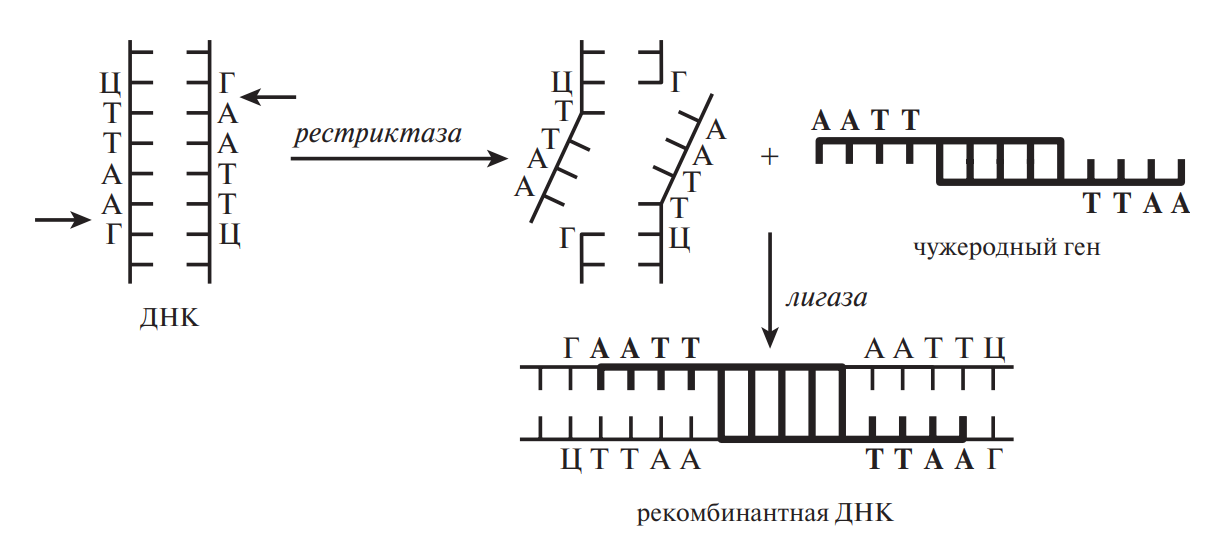
Рис. 2. Введение гена в ДНК модифицируемого растения
Наиболее интенсивно проводятся работы с такими сельскохозяйственными культурами, как соя, пшеница, кукуруза, томаты, сахарная свекла, картофель, хлопчатник, рапс. Практические разработки уже сейчас внедрены во многих странах мира, увеличиваются площади под трансгенной соей, рисом, картофелем и ягодными культурами (малина, клубника). С генетически измененной соей только в США выпускается около 3000 пищевых продуктов: супов, рыбных консервов, детских каш, соусов и т. д.
Продукты, полученные с использованием генов микроорганизмов и растений, по сравнению с традиционными продуктами содержат меньше пестицидов, консервантов, тяжелых металлов; они не требуют обработки химическими препаратами. Трансгенные соя и кукуруза устойчивее к сорнякам, насекомым, томаты — к вирусным заболеваниям, а ботва картофеля несъедобна для колорадского жука. Растения могут обладать и другими полезными свойствами — такими как морозо- и засухоустойчивость, отсутствие способности к полеганию, повышенная биологическая ценность и т. д. Соя, содержащая ген, например, пшеницы, имеет биологическую ценность 1,0 против 0,92 у традиционной, а картофель, полученный с геном фасоли, содержит повышенное количество белка (6 %).
С помощью генетически измененных бактерий получают амилолитические ферменты, которые применяются при производстве глюкозного сиропа из крахмала, кондитерских, хлебобулочных изделий, а пектолитические ферменты — для производства соков и вин. При этом улучшаются органолептические и физико-химические показатели качества пищевых продуктов.
Потребление генетически модифицированных продуктов находится под контролем специальных органов, так как введение в организм растений генов, ответственных за синтез белков, например альбуминов молока, яиц и т. д., заключает в себе опасность употребления в пищу продуктов питания, непереносимых определенной группой людей (пищевая аллергия). Это может быть связано с появлением антиалиментарных и токсичных веществ, определяемых свойствами переносимых генов. При условии пересадки генов из микроорганизмов может синтезироваться белок с низкой усвояемостью.
Подходы к оценке безопасности и качества генетически модифицированных объектов в различных странах разные и по содержанию и по объему, но во всех них разрабатываются специальные методы и критерии. Так, в России принят Закон «О государственном регулировании в области генной инженерной деятельности» и создана специальная Комиссия во главе с главным санитарным врачом РФ, задача которой состоит в разработке подзаконных актов и методик для контроля общей безопасности трансгенных продуктов. С учетом выполненных комплексных мер, в РФ разрешена для использования в питании населения соя линии 40-3-2 («Монсанто Ко», США) и белковый концентрат из нее. Включение этого концентрата в рацион крыс не сопровождалось биохимическими и физиологическими изменениями в их органах и тканях.
Таким образом, признано, что ликвидация в питании человека дефицита белка всеми эффективными методами, включая генетическую инженерию, является одной из насущных проблем нашего столетия.
2. Белково-калорийная недостаточность и ее последствия. Пищевые аллергии
Белковая недостаточность является важнейшей проблемой питания. Бедно живущие семьи на фоне недостаточно калорийной пищи потребляют мало белка, в результате чего возникает синдром дистрофии, который называется квашиоркором. Богатая белком пища дорого стоит, поэтому не все слои населения могут ею постоянно питаться. Квашиоркор у человека развивается при частичном (или полном) голодании и при потреблении неполноценных белков. Заболевание сопровождается нарушением функции кишечника, так как с надлежащей скоростью не синтезируются ферменты поджелудочной железы и не обновляются клетки его слизистой оболочки. Возникает порочный круг квашиоркора, характеризующийся прекращением процесса усвоения белка пищи. В организме развивается отрицательный азотистый баланс, нарушается водно-солевой обмен, появляется атония мышц и остановка роста. Пищевая дистрофия особенно опасна для младенцев. Квашиоркор может сопровождаться их гибелью от диареи, острых инфекций, заболеваний печени или отставанием в физическом и умственном развитии. Резкое снижение синтеза белка в печени на фоне недостаточного поступления его в организм уменьшает количество сывороточного альбумина, липопротеидов низкой плотности (ЛНП) и гемоглобина в крови (рис. 3).
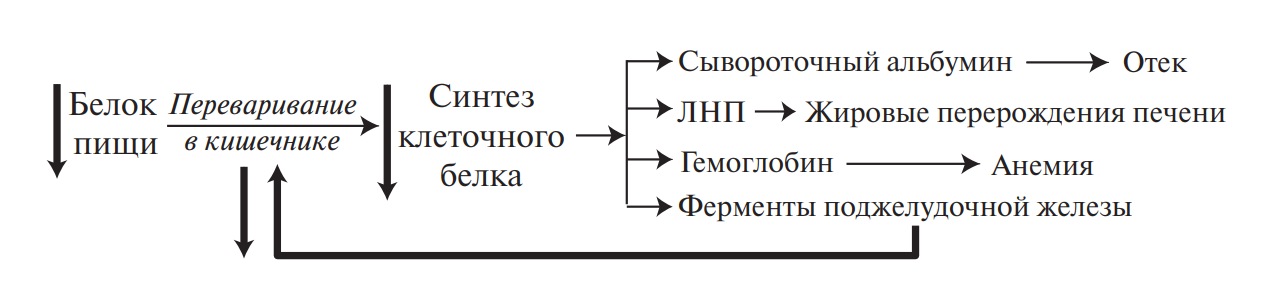
Рис. 3. Порочный круг при квашиоркоре
Наряду с общими нарушениями обмена аминокислот в организме существуют специфические изменения некоторых из них. Так, нарушения обмена гистидина выражаются в снижении активности фермента гистидинаммиаклиазы и повышении активности гистидиндекарбоксилазы. Это вызывает, в свою очередь, накопление избытка гистидина в тканях. При недостатке триптофана снижается синтез никотиновой кислоты и накапливается ксантуреновая кислота, которая угнетает β-клетки островков Лангерганса поджелудочной железы, провоцируя тем самым возникновение диабета.
Тяжелые последствия недостаточного поступления белка в организм человека невозможно лечить терапевтическими методами, поэтому предоставление всем нуждающимся материальной помощи для употребления в пищу белковых добавок может решить проблему охраны и сохранения здоровья людей как в детском, так и в зрелом возрасте. Использование в рационе полноценного животного белка или сбалансированных растительных белковых смесей необходимо для исключения необратимых отклонений в здоровье человека.
Отрицательную роль для человека играют пищевые аллергии, связанные с непереносимостью организмом отдельных видов белковой пищи (молоко, яйца, орехи, белки некоторых злаков). Термин «аллергия» происходит от двух греческих слов: allos — другой и ergon — действие. При нормальном пищеварении белки расщепляются в желудочно-кишечном тракте до аминокислот, которые не являются антигенами (аллергенами) и не вызывают ответной иммунной (защитной) реакции. Если в кровяное русло без предварительного расщепления через эпителий кишечника проникает незначительное количество белков пищи, то в организме поддерживается как бы тренинг иммунной системы для защиты от действия чужеродных компонентов. При значительном поступлении в кровяное русло аллергенов возникает острая реакция, проявляющаяся в зуде, кожных высыпаниях или желудочно-кишечных расстройствах. Природа таких реакций до конца не выяснена. Предотвратить пищевую аллергию у младенцев возможно грудным вскармливанием или нагреванием некоторых белков до 120 °С, однако наиболее эффективным способом борьбы является исключение аллергена из диеты.
3. Аминокислоты и их функции в организме
Общее число встречающихся в природе аминокислот достигает 300. Среди них различают:
- а) аминокислоты, входящие в состав белков;
- б) аминокислоты, образующиеся из других аминокислот, но только после включения последних в процесс синтеза белка (их обнаруживают в гидролизатах белков);
- в) свободные аминокислоты.
С точки зрения питания отдельно выделяют эссенциальные (незаменимые) аминокислоты. Эти аминокислоты не могут синтезироваться в организме человека и должны поступать с пищей.
Аминокислоты — полифункциональные соединения, содержащие по меньшей мере две разные химические группировки, способные реагировать друг с другом с образованием ковалентной пептидной (амидной) связи:
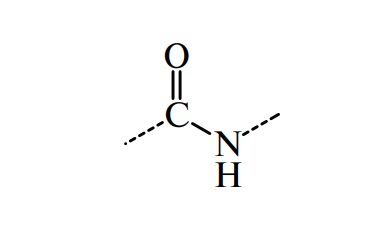
В аминокислотах амино- (–NH2) и карбоксильная (–СООН) группы присоединены к одному и тому же атому углерода, который называют α-углеродом. Природа боковых цепей 20 протеиногенных аминокислот приведена на рис. 4.
А. Гидрофобные аминокислоты (с неполярными радикалами):
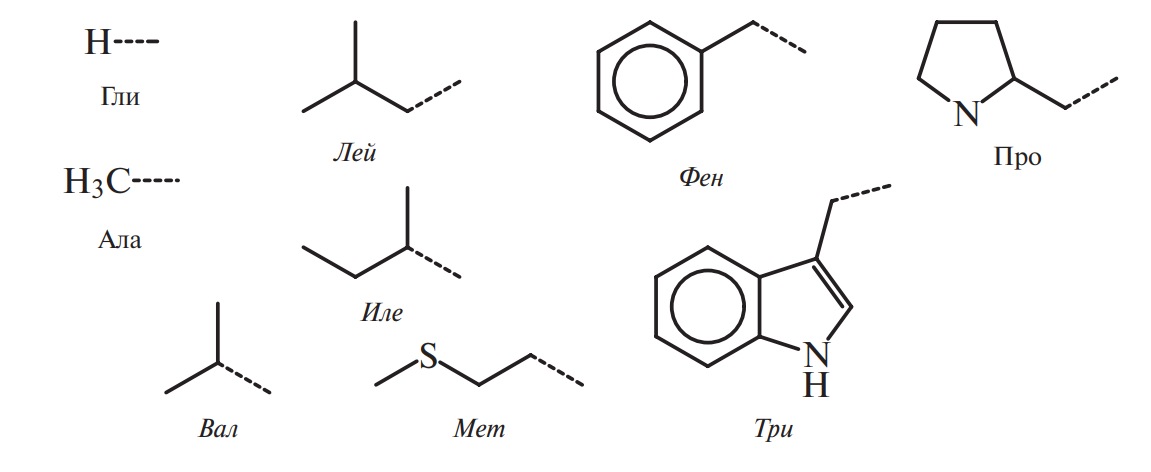
Б. Полярные аминокислоты
Б1. С гидрофильными радикалами (неионогенные):
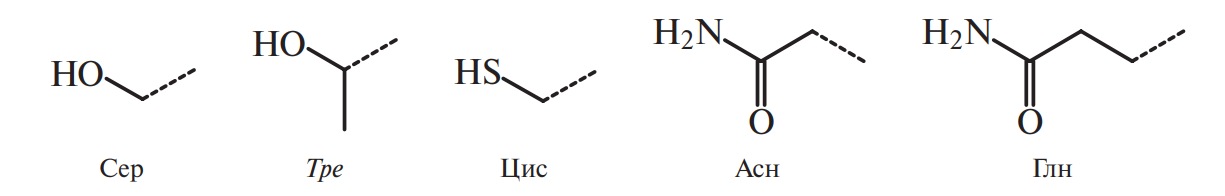
Б2. Кислые (ионогенные):
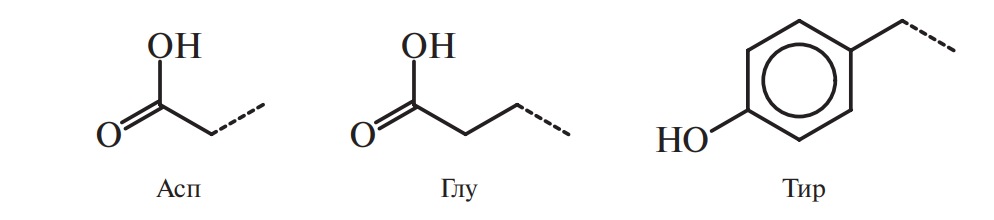
Б3. Основные (ионогенные):
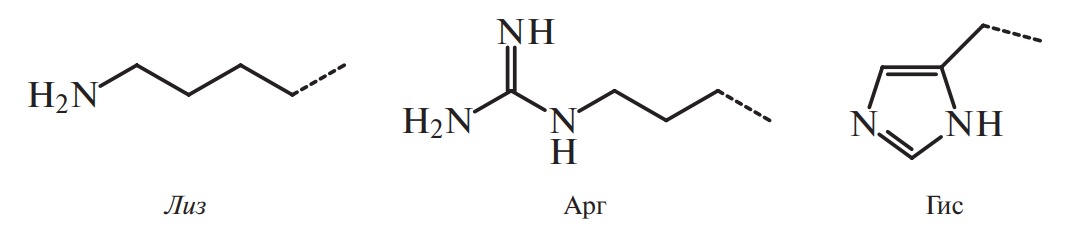
Рис. 4. Боковые цепи аминокислот, входящих или способных включаться в состав белков (курсивом выделены названия незаменимых аминокислот)
Для объяснения и понимания свойств аминокислот следует помнить следующее.
- Аминокислоты, существуя в твердом или растворенном состоянии, всегда находятся в форме биполярных ионов (цвиттерионов), положение равновесия которых зависит от рН среды:
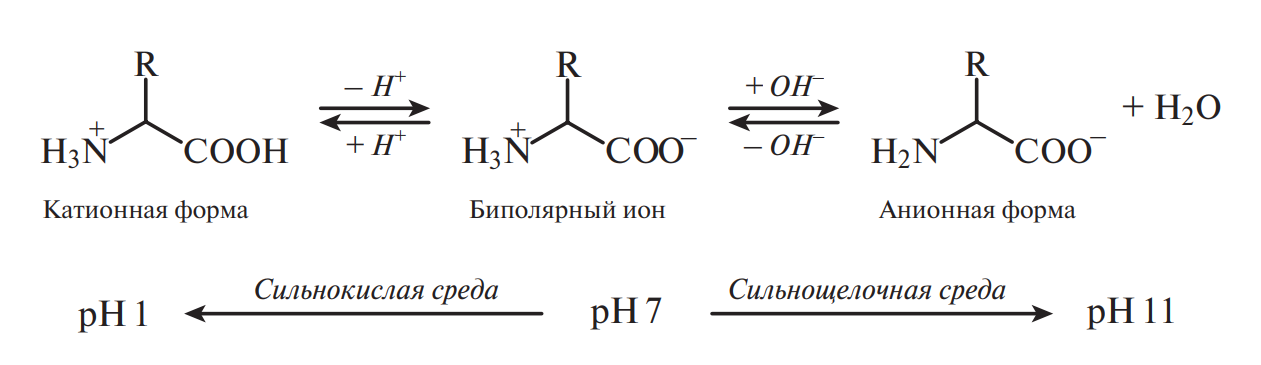
Нахождение аминокислот в виде ионов обусловливает растворимость в воде и нерастворимость в неполярных жидкостях. Большинство аминокислот растворимы в воде, но у аминокислот с гидрофобными группами (изолейцин, лейцин, тирозин) растворимость относительно невысока. В организме ионное состояние аминокислот определяет их всасываемость в желудочно-кишечном тракте после гидролитического расщепления белков и транспорт к различным органам и тканям. Способность к ионизации в кислой или щелочной среде лежит в основе разделения аминокислот ионообменной хроматографией и электрофорезом.
- Большинство природных α-аминокислот относятся к L-стереохимическому ряду, однако в некоторых пептидах (антибиотики грамицидин, актиномицин) встречаются аминокислоты D-ряда. Последние, как правило, не усваиваются организмом человека. Аминокислоты D- и L-рядов значительно отличаются по вкусу. Так, D-глутаминовая кислота не имеет вкуса, а L-глутаминовая кислота обладает вкусом мяса. Получая последнюю из клейковины пшеницы, ее используют в качестве вкусовой добавки к пищевым концентратам. Сладкий вкус имеют другие аминокислоты L-ряда: валин, треонин, пролин, серин и т. д. Они все в большей степени привлекают к себе внимание как заменители сахара в питании диабетиков.
- Аминокислоты отличаются друг от друга структурой боковых цепей, от которой зависят химические, физические свойства и физиологические функции белков в организме. Аминокислоты с гидрофобными боковыми группами большей частью локализованы внутри белковых макромолекул, тогда как аминокислоты с полярными боковыми группами располагаются на их поверхности. В составе полярных α-аминокислот имеются функциональные группы, способные к ионизации (ионогенные), и группы, не способные переходить в ионное состояние (неионогенные). При этом кислые и основные ионогенные группы радикалов, как правило, располагаясь на поверхности молекул белков, принимают участие в ионных (электростатических) взаимодействиях. В роли полярных неионогенных групп в молекулах белков выступают гидроксильные группы серина, треонина и амидные группы глутамина (Глн) и аспарагина (Асн). Эти группы могут располагаться как на поверхности, так и внутри белковой молекулы, и принимать участие в образовании водородных связей с другими полярными группировками.
Почти все α-аминокислоты, поступающие из пищеварительного тракта человека в кровяное русло организма, претерпевают ряд общих превращений, назначение которых заключается в обеспечении пластическим материалом процесса синтеза белков и пептидов и осуществлении дыхания с образованием АТФ (рис. 5). В основе таких превращений лежат реакции дезаминирования, трансаминирования и декарбоксилирования. Эти реакции подробно рассматриваются в курсе биохимии, здесь же остановимся на специфических путях обмена и модификации отдельных α-аминокислот.
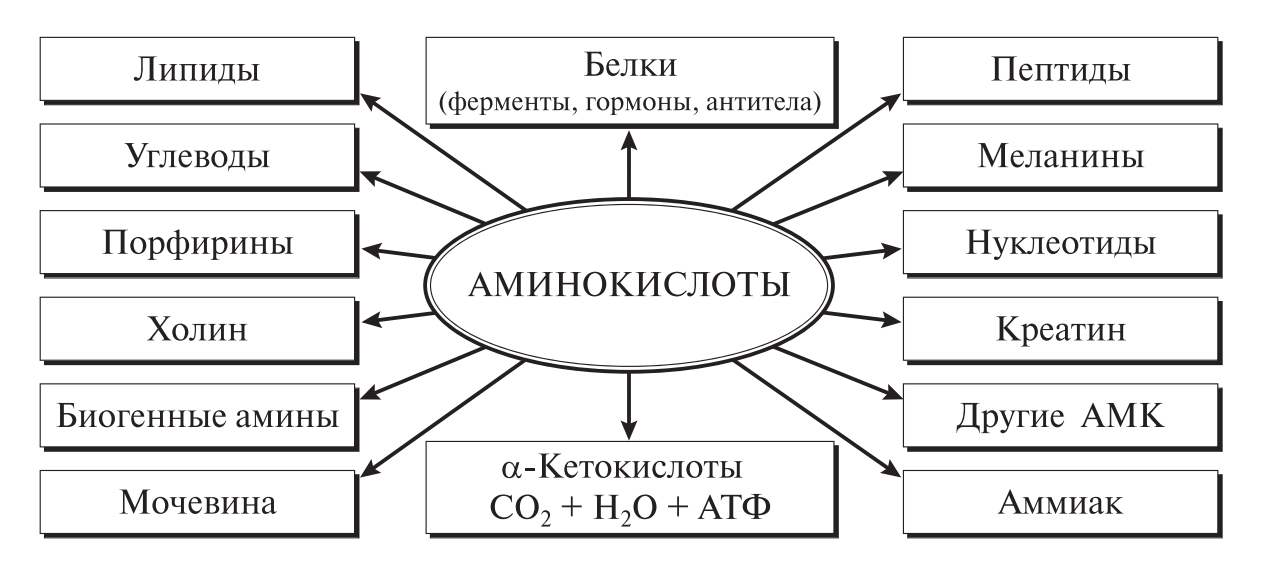
Рис. 5. Основные функции аминокислот в организме
В тканях организма легко осуществляется ферментативная окислительно-восстановительная реакция, обусловленная наличием в цистеине реакционноспособной SH-группы:
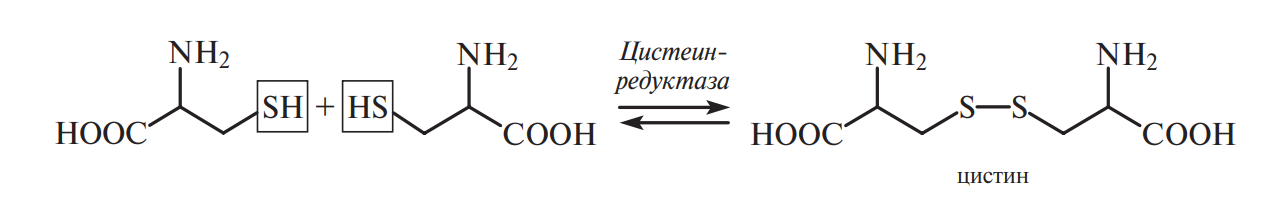
Способность цистеина окисляться придает ему защитные и радиопротекторные свойства. В его присутствии снижается интенсивность окислительных процессов в липидах, белках, повышается устойчивость организма к ионизирующим излучениям, стабилизируется качество принимаемых лекарственных препаратов. При участии двух остатков цистеина в полипептидных цепях образуются дисульфидные связи, которые обусловливают биологическую активность или функциональные свойства белков в составе пищи. Особо важную роль дисульфидные связи играют в белках пшеницы, так как они придают клейковине упругие и эластичные свойства (см. в п. 6 подпараграф «Белки злаков»).
Физиологическая роль другой серосодержащей аминокислоты — метионина — связана с наличием лабильной метильной группы. Отдавая группу –СН3 через образование S-аденозилметионина, метионин принимает участие в синтезе глицерофосфолипидов:
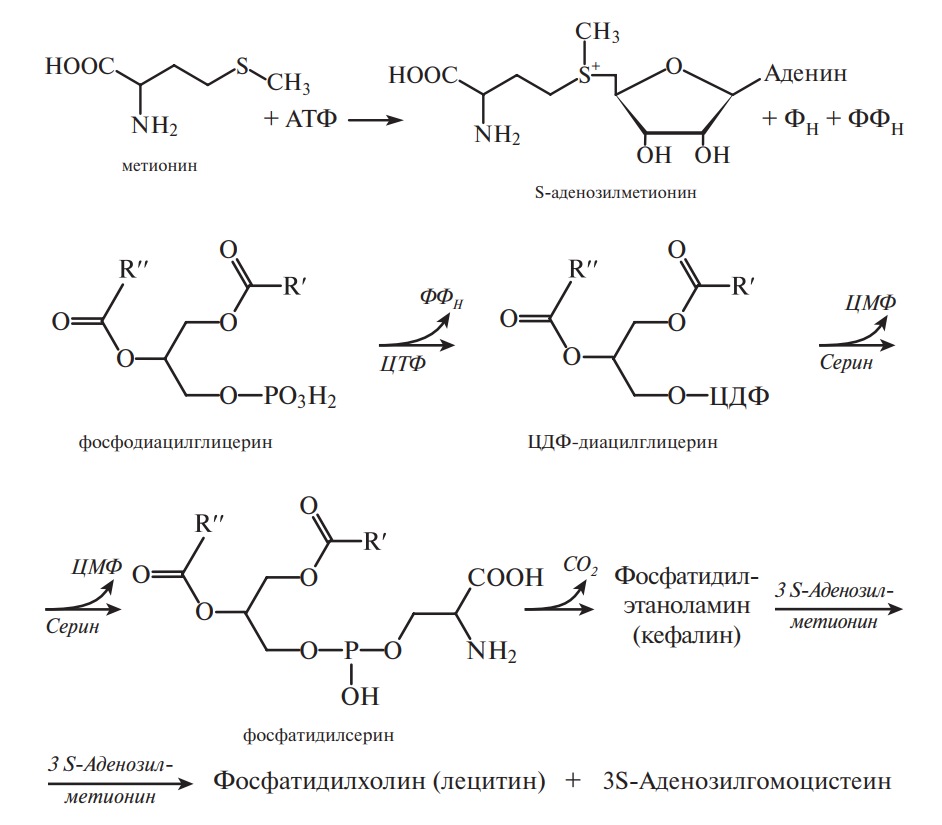
Из приведенных выше реакций видна физиологическая роль и аминокислоты серин, которая (так же как и треонин) в этерифицированном виде при участии фосфорной кислоты входит в состав сложных белков — фосфопротеидов (казеин молока, вителлин яйца):
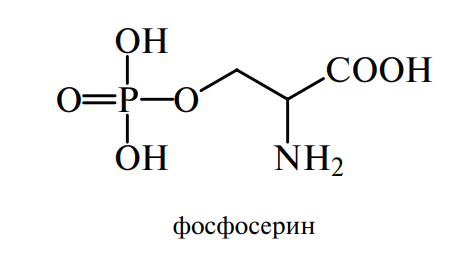
Серин же в свою очередь синтезируется из глицина под действием фермента, содержащего тетрагидрофолиевую кислоту (ТГФК). Эта реакция изучена с помощью метода меченых атомов:
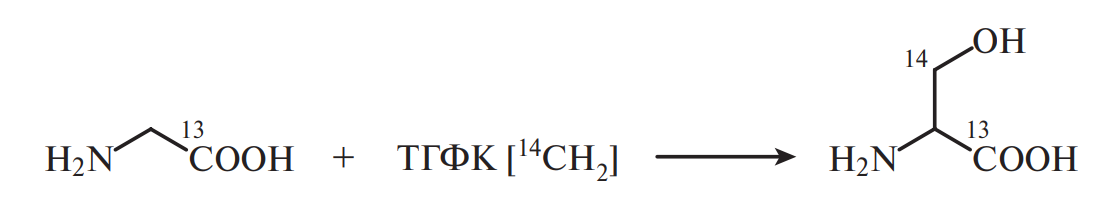
Глицин является предшественником пуринового кольца гема крови и образует так называемые парные соединения. С желчными кислотами, например холевой, он образует гликохолевую кислоту, с бензойной кислотой — гиппуровую:
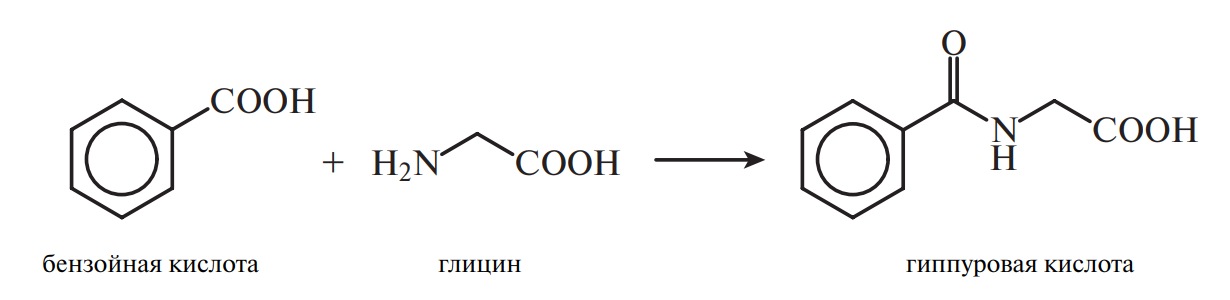
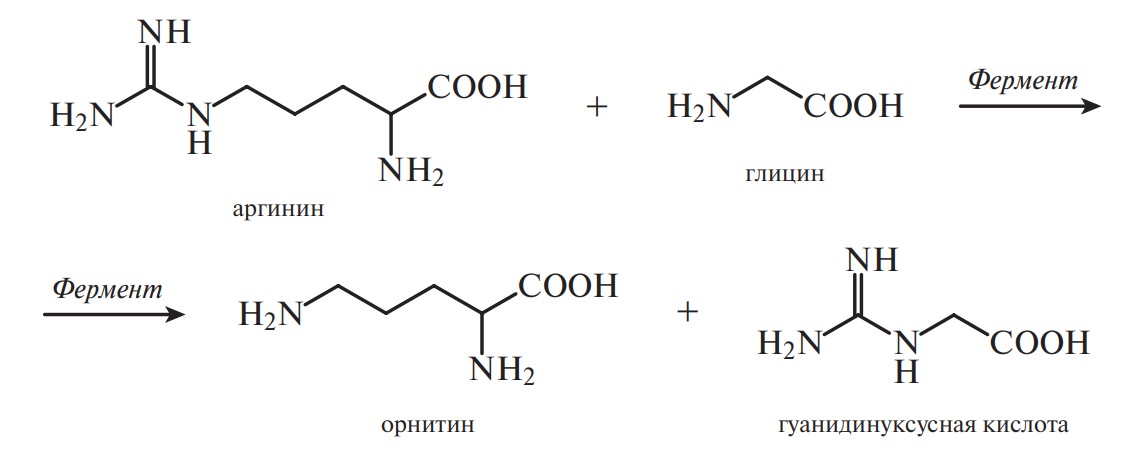
Гликохолевая кислота принимает участие в процессе усвоения липидов, гиппуровая кислота обеззараживает токсичную бензойную кислоту. Три аминокислоты — аргинин, глицин и метионин — участвуют в синтезе креатина — соединения, с помощью которого в мышечной ткани происходит непрерывный ресинтез макроэрга АТФ:
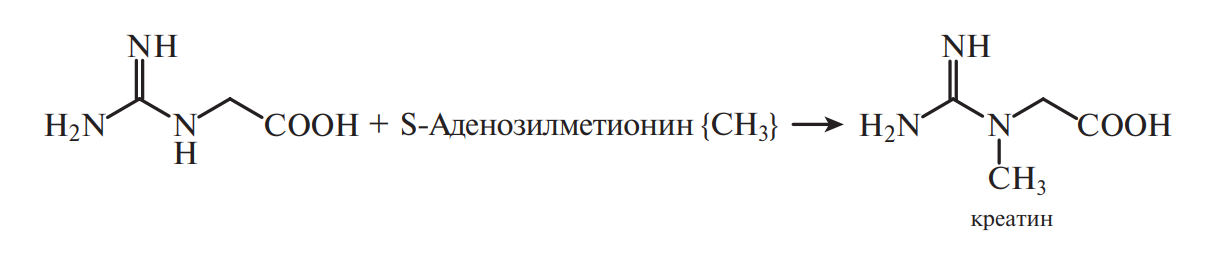
При участии креатина в организме человека и животных образуется креатинфосфат, который по мере необходимости отдает свою фосфатную группу молекулам АДФ, превращаясь в креатинин:
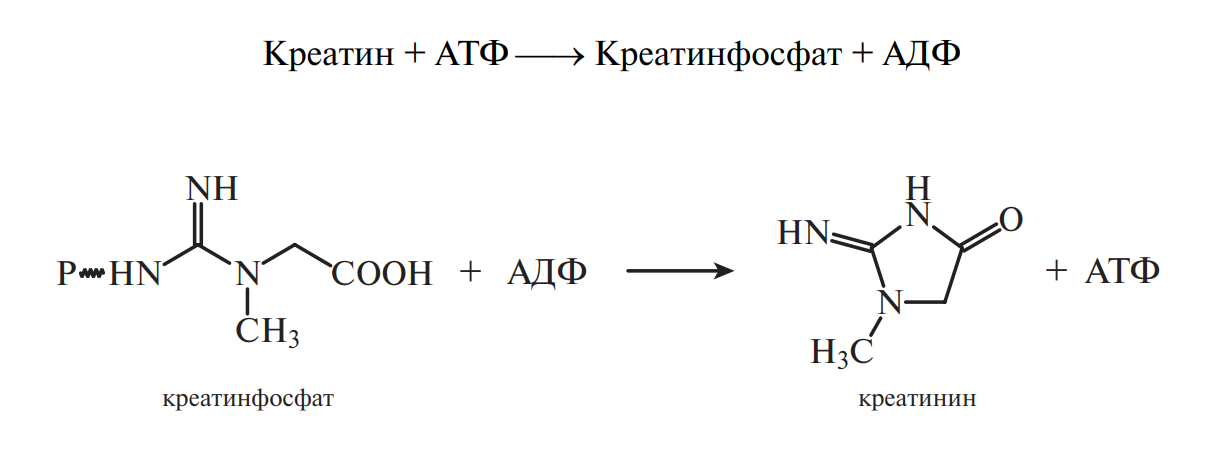
Креатин и циклический креатинин входят в состав мясного экстракта; их соотношение зависит от pH среды и температуры. Так, при нагревании мяса в кислой среде в экстракте преобладает креатинин.
В составе живых организмов, пищевых продуктов и сырья встречаются и другие, так называемые «редкие» аминокислоты, или их производные, не входящие в состав белков. Так, β-аланин является составной частью мясных бульонов, а бетаин — продукт метилирования глицина, отхода свеклосахарного производства — мелассы.
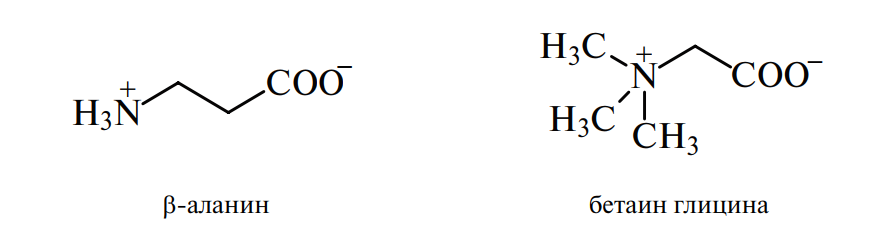
Аминокислоты цитруллин и орнитин вместе с аргинином участвуют в цикле образования мочевины у человека и животных.
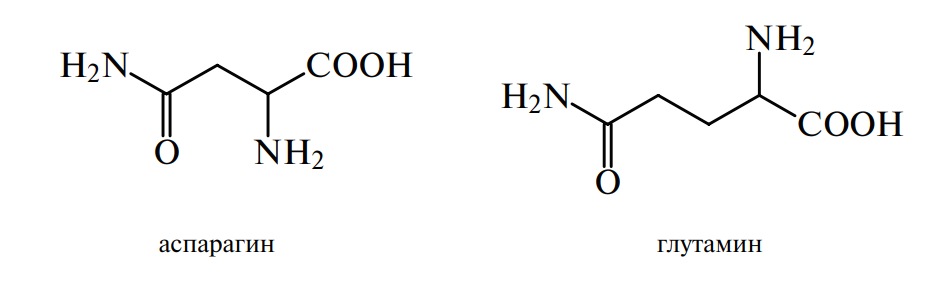
Фундаментальную роль в обмене веществ живых организмов играют глутаминовая и аспарагиновая кислоты. Они участвуют в процессах расщепления, синтеза и переноса, часто в форме амидов.
Глутамин, например, является основной формой переноса аммиака в крови человека и вместе с аспарагиновой кислотой служит предшественником пиримидинового кольца нуклеотидов. Азот 1 происходит из аспарагиновой кислоты, азот 3 — из глутамина, углероды 4, 5, 6 кольцу отдает аспарагиновая кислота, а углерод 2 происходит от СО2. Предварительно молекула СО2 и амидная группа глутамина образуют карбамоилфосфат:
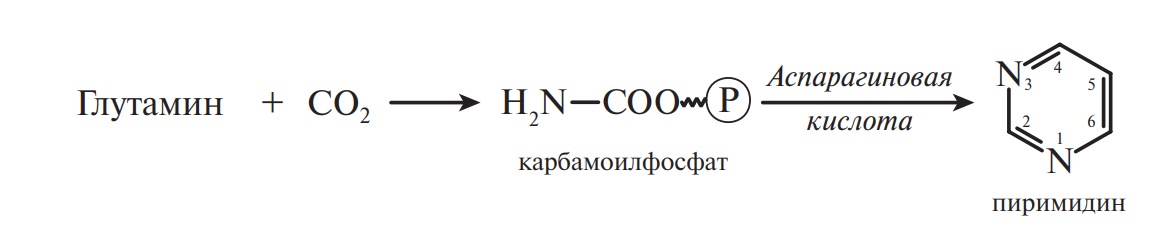
Реакции декарбоксилирования глутаминовой кислоты с образованием γ-аминомасляной кислоты, относящейся к группе медиаторов, отводится важная роль в обмене веществ мозга и нервной ткани.
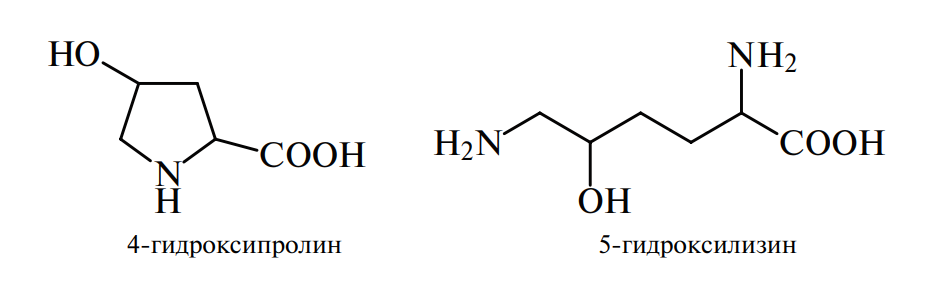
С обменом глутаминовой кислоты тесно связан обмен пролина, который синтезируется из нее в результате восстановления пролиндегидрогеназой. Пролин играет важную роль при формировании структуры коллагена и белков пшеничной клейковины, вызывая изгибы в полипептидных цепях. В фибриллярных белках соединительной ткани мяса, а также в коллагене наряду с пролином встречаются 4-гидроксипролин и 5-гидроксилизин, образующиеся за счет окисления соответствующих аминокислот уже после включения их в белок. Присутствие гидроксипролина в мясных и колбасных изделиях влияет на качество продуктов, что учитывается при их оценке.
Тирозин является ответственным за окраску волос, кожи, глаз, за темный цвет пищевых продуктов (ржаной хлеб), так как с его участием
синтезируются темноокрашенные пигменты — меланины. Механизм реакции до конца не изучен, но известны первые этапы их синтеза. Под действием медьсодержащего фермента тирозин превращается в диоксифенилаланин (ДОФА), который далее окисляется и циклизуется с образованием индолхинона. Полимеризация последнего приводит к синтезу меланинов:
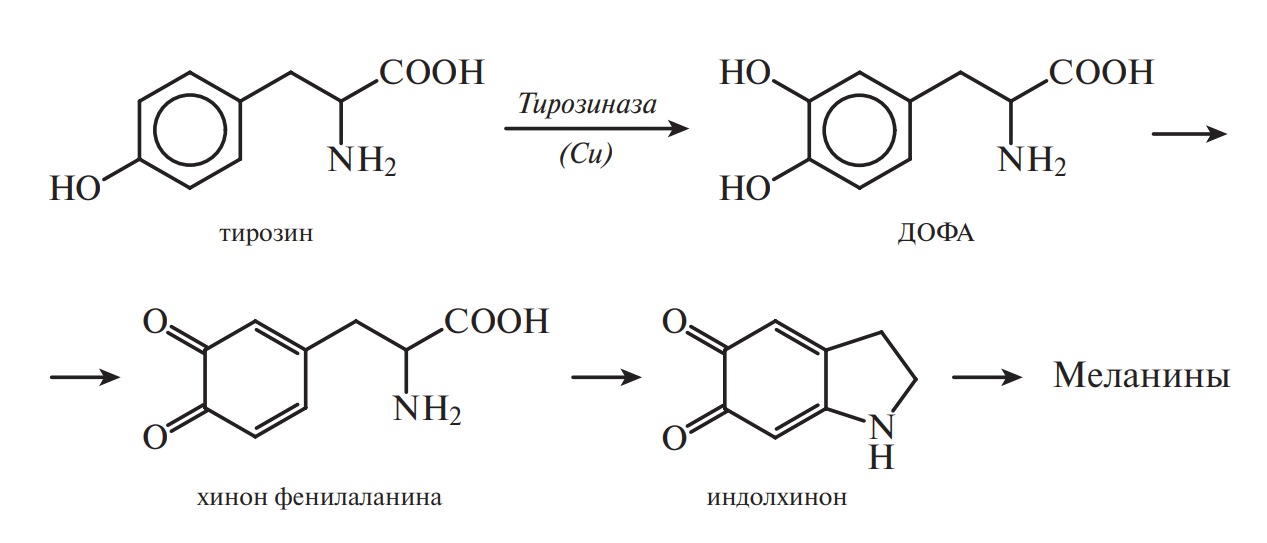
Образование меланинов усиливается под влиянием ультрафиолетовых лучей (при загаре) и может быть причиной злокачественных новообразований. При наследственном заболевании — альбинизме, характеризующемся отсутствием фермента тирозиназы, наоборот, не наблюдается пигментации кожи, волос, но присутствует боязнь света. Сам же тирозин образуется из фенилаланина. В здоровом организме реакция синтеза тирозина протекает с участием двухкомпонентного фермента фенилаланингидроксилазы по схеме:
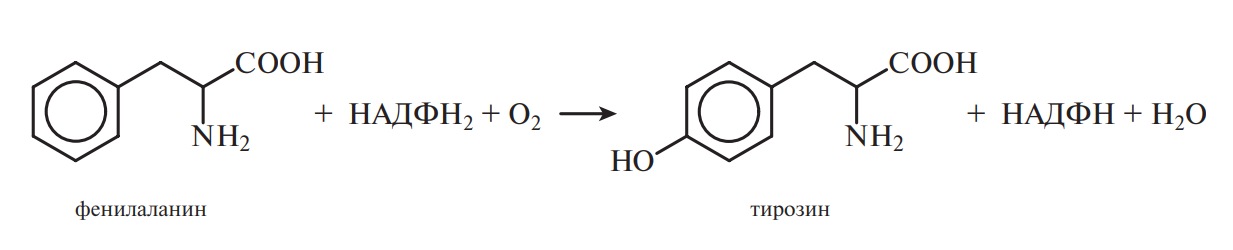
При наследственном заболевании фенилкетонурией у человека происходит мутация гена, который кодирует синтез одного из компонентов фермента, содержащего в качестве переносчика водорода соединение биоптерин. Наследственная аномалия, сопровождающаяся тяжелой умственной отсталостью, характеризуется превращением фенилаланина не по указанному выше пути, а по типу переаминирования с избыточным накоплением фенилпировиноградной кислоты в моче:
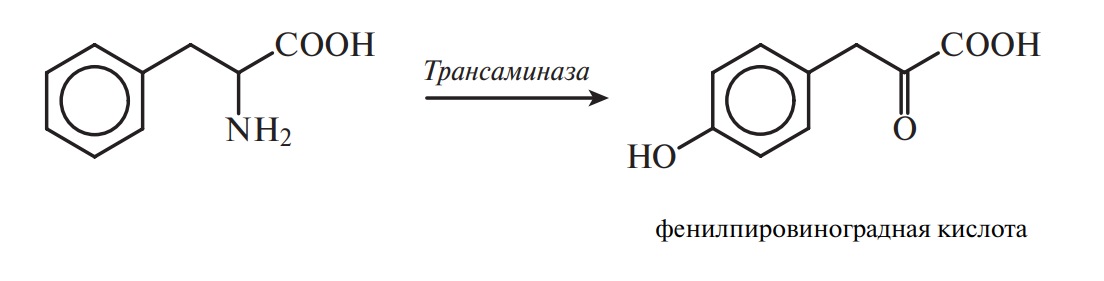
Снизить степень умственной отсталости, особенно у детей в раннем возрасте, можно с помощью понижения содержания фенилаланина в пище, чтобы избыток последнего не оказывал токсического действия на клетки головного мозга. Известен и ряд других врожденных заболеваний, связанных с нарушением обмена аминокислот. Так, алкаптонурия возникает в результате недостатка оксидазы гомогентизиновой кислоты — продукта обмена тирозина, гиперпролинемия — из-за недостатка фермента пролиноксидазы, а цитруллинемия обусловлена нарушением цикла образования мочевины, так как в организме не синтезируется аргининсукцинатсинтетаза.
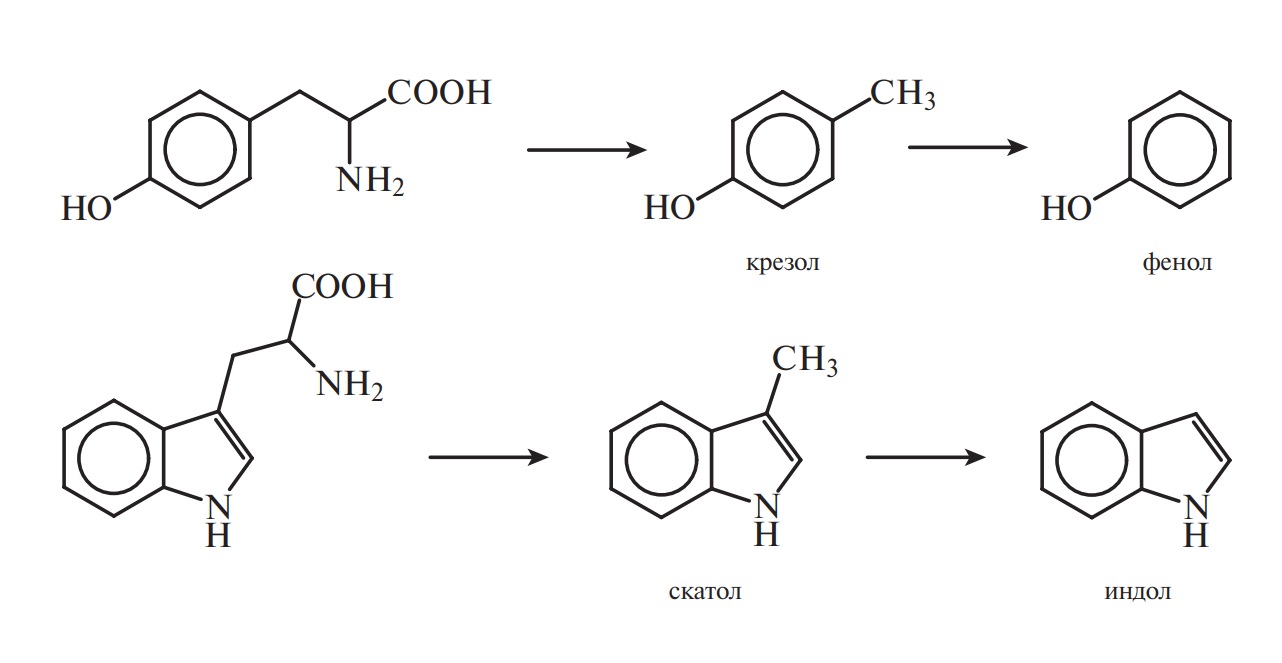
Незаменимая аминокислота триптофан служит предшественником никотиновой кислоты, НАД и НАДФ, серотонина и индолилуксусной кислоты — гормона роста растений. Серотонин, обладая сосудосуживающим действием, синтезируется в клетках кишечника и нервной ткани. Из организма он выводится в виде гидроксииндолилуксусной кислоты (ГИУК):
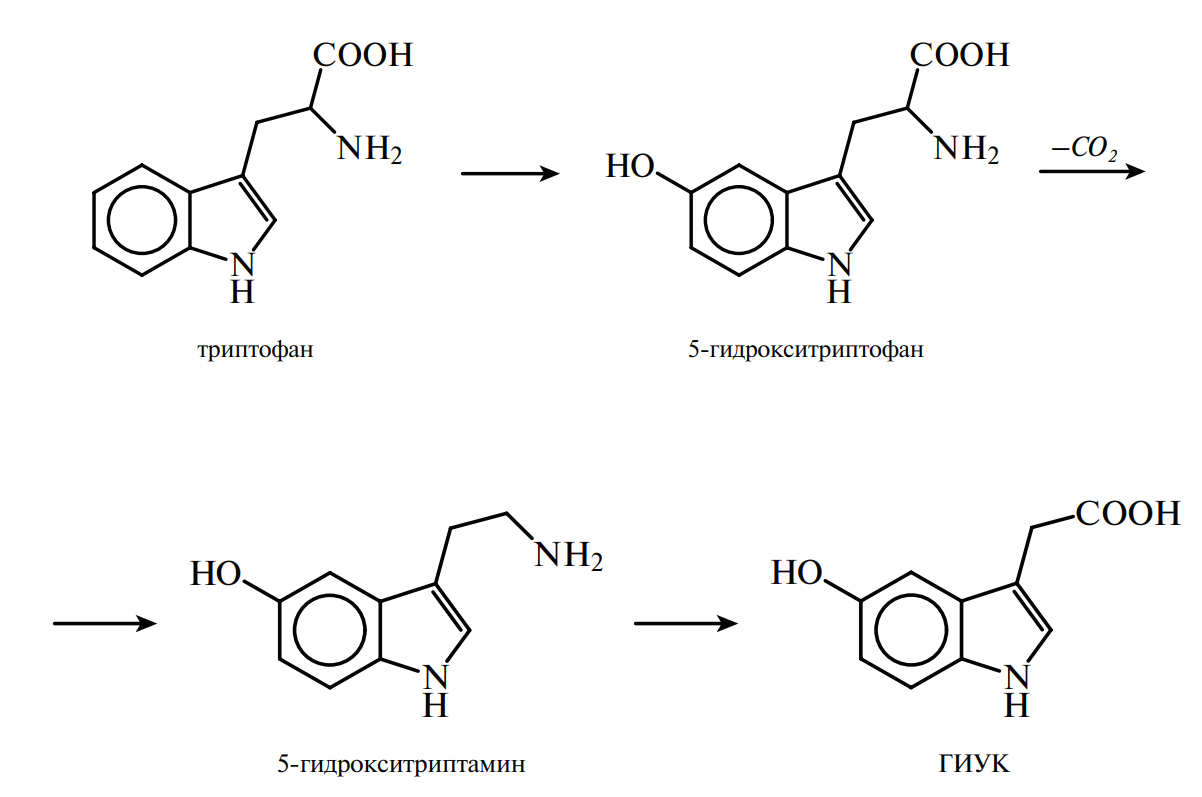
Из тирозина и триптофана, содержащихся в пище, при участии микробных ферментов в кишечнике образуются ядовитые продукты — крезол, фенол, скатол, индол, обезвреживание которых происходит в печени путем связывания с серной или глюкуроновой кислотой с образованием нетоксичных (парных) кислот, например фенолсерной кислоты.
В процессе декарбоксилирования аминокислот в организме образуются некоторые важные биогенные амины. Образование и роль этаноламина, серотонина и γ-аминомасляной кислоты рассмотрено выше. Здесь же отметим, что декарбоксилирование аспарагиновой кислоты приводит к синтезу β-аланина — составной части таких биологически активных соединений, как КоА и АПБ (ацилпереносящий белок), а декарбоксилирование лизина и орнитина с ферментами кишечной микрофлоры — к образованию ядовитых диаминов — кадаверина и путресцина.
Некоторые аминокислоты выполняют роль медиаторов — веществ, принимающих участие в передаче нервных импульсов от одной клетки к другой. При раздражении нервных волокон медиаторы реагируют со специфическим рецептором и обеспечивают соответствующую физиологическую функцию: регуляцию сна, бодрствование, сердечно-сосудистую деятельность, терморегуляцию тела. Медиаторами являются ацетилхолин, глутаминовая, аспарагиновая кислоты, глицин, ГАМК (γ-аминомасляная кислота), гистамин, серотонин, норадреналин.
Таким образом, приведенные сведения показывают, какую большую роль играют аминокислоты в синтезе важнейших физиологически активных соединений в организме и обеспечении некоторых свойств пищевого сырья и продуктов. Обобщенная схема представлена на рис. 6.
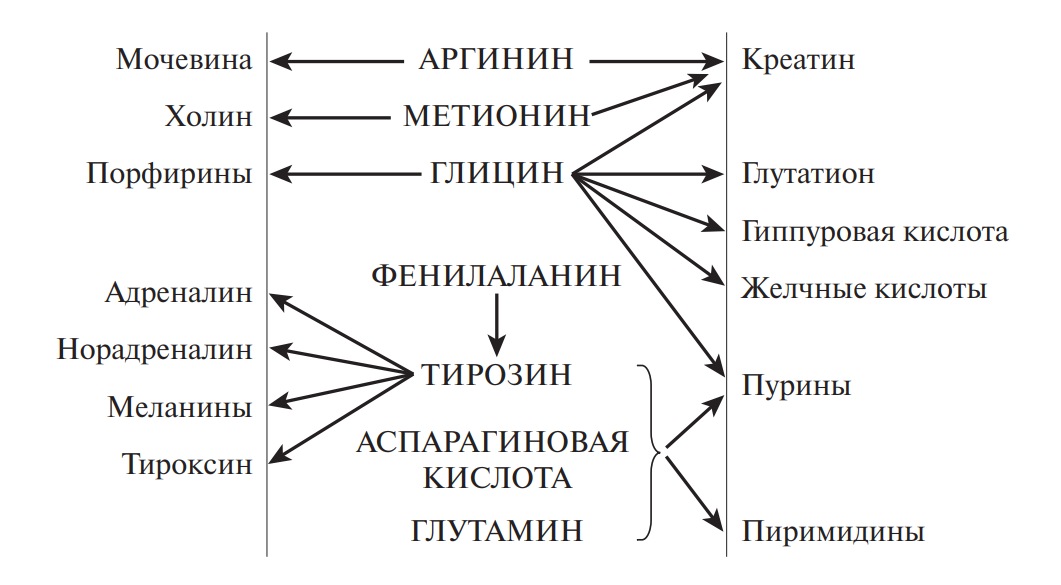
Рис. 6. Схема превращения аминокислот
4. Незаменимые аминокислоты. Пищевая и биологическая ценность белков
Все живые организмы различаются по способности синтезировать аминокислоты, необходимые для биосинтеза белков. В организме человека синтезируется только часть аминокислот, другие должны доставляться с пищей. Первые из них называются з аменимым и, вторые — незаменимыми (см. рис. 4). Заменимые аминокислоты способны заменять одна другую в рационе, так как они превращаются друг в друга или синтезируются из промежуточных продуктов углеводного или липидного обмена. Для незаменимых аминокислот такие пути обмена существуют только у растений и некоторых микроорганизмов, например E. сoli.
Жизнедеятельность человека обеспечивается ежедневным потреблением с пищей сбалансированной смеси, содержащей восемь незаменимых аминокислот и две частично заменимые. Незаменимые представлены аминокислотами с разветвленной цепью углерода — лейцином, изолейцином, валином, ароматическими — фенилаланином, триптофаном и алифатическими — треонином, лизином, метионином. Так как из метионина и фенилаланина в организме синтезируются соответственно цистеин и тирозин, то наличие в пище в достаточном количестве этих двух заменимых аминокислот сокращает потребность в их незаменимых предшественниках.
К частично заменимым аминокислотам относят аргинин и гистидин, так как синтезируются в организме они довольно медленно. Недостаточное потребление аргинина и гистидина с пищей взрослого человека в целом не отражается на развитии его организма, однако может возникнуть экзема или нарушиться синтез гемоглобина. В аргинине и гистидине особенно нуждается молодой организм.
Отсутствие в пище хотя бы одной незаменимой аминокислоты вызывает отрицательный азотистый баланс, нарушение деятельности центральной нервной системы, остановку роста и тяжелые клинические последствия типа авитаминоза. Нехватка одной незаменимой аминокислоты приводит к неполному усвоению других. Данная закономерность подчиняется закону Либиха, по которому развитие живых организмов определяется тем незаменимым веществом, которое присутствует в наименьшем количестве.
Зависимость функционирования организма от количества незаменимых аминокислот используется при определении биологической ценности белков химическими методами. Наиболее широко используется метод Х. Митчела и Р. Блока (Mitchell, Block, 1946), в соответствии с которым рассчитывается показатель аминокислотного скора (а. с.). Скор выражают в процентах или безразмерной величиной, представляющей собой отношение содержания незаменимой аминокислоты (а. к.) в исследуемом белке к ее количеству в эталонном белке. При расчете скора (в %) формула выглядит следующим образом:
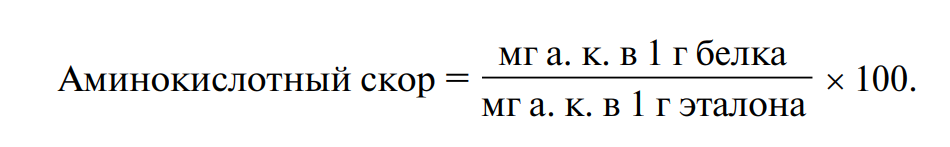
Аминокислотный состав эталонного белка сбалансирован и идеально соответствует потребностям организма человека в каждой незаменимой кислоте, поэтому его еще называют «идеальным». В 1973 г. в докладе ФАО и ВОЗ опубликованы данные по содержанию каждой аминокислоты в эталонном белке. В 1985 г. они были уточнены в связи с накоплением новых знаний об оптимальном рационе человека (табл. 1).
Аминокислота, скор которой имеет самое низкое значение, называется первой лимитирующей аминокислотой. Значение скора этой аминокислоты определяет биологическую ценность и степень усвоения белков. Наглядно показатель биологической ценности можно изобразить в виде самой низкой доски бочки Либиха на примере белков пшеницы (рис. 7). Полная емкость бочки соответствует «идеальному» белку, а высота доски лизина — биологической ценности пшеничного белка.
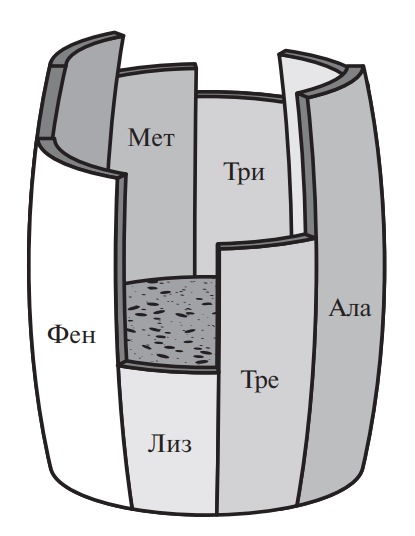
Рис. 7. Бочка Либиха
Таблица 1. Рекомендуемые (ФАО/ВОЗ, 1985) составы и суточная потребность взрослого человека в незаменимых аминокислотах
| Незаменимые аминокислоты | Суточная потребность, мг/кг | Рекомендовано,
мг/100 г белка* |
||
| Дети, лет | Взрослые | |||
| 2–5 | 10–12 | |||
| Изолейцин | 31 | 28 | 10 | 28 (40) |
| Лейцин | 66 | 44 | 14 | 66 (70) |
| Лизин | 58 | 44 | 14 | 58 (55) |
| Метионин + цистеин | 25 | 22 | 13 | 25 (35) |
| Фенилаланин + тирозин | 63 | 22 | 14 | 63 (60) |
| Треонин | 34 | 28 | 7 | 34 (40) |
| Триптофан | 11 | 9 | 3,5 | 11 (10) |
| Валин | 35 | 25 | 10 | 35 (50) |
* В скобках — ФАО/ВОЗ, 1973.
Другой метод определения биологической ценности белков заключается в определении индекса незаменимых аминокислот (ИНАК). Метод представляет собой модификацию метода химического скора (Oser, 1951) и позволяет учитывать количество всех незаменимых кислот. Индекс рассчитывают по формуле
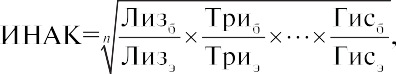
где n — число аминокислот; индексы б, э — содержание аминокислоты в изучаемом и эталонном белке соответственно.
Помимо химических методов, широко используют биологические методы с использованием микроорганизмов и животных. Основными показателями оценки являются рост животных, выраженный привесом за определенный период времени, расход белка и энергии на единицу привеса, коэффициенты перевариваемости и отложения азота в теле и доступность аминокислот. Показатель, измеряемый отношением привеса животных (в г) к количеству потребляемого белка (в г), разработан П. Осборном (Osborn, 1919) и носит название коэффициента эффективности белка (КЭБ). При определении показателя используют контрольную группу животных, в рацион которых включают стандартный белок казеин в количестве 10 %. Эффективность казеинового белка при кормлении крыс равняется 2,5. Каждый из методов имеет как преимущества, так и недостатки.
Животные и растительные белки заметно отличаются по биологической ценности. Аминокислотный состав животных белков близок к аминокислотному составу белков человека. Животные белки являются полноценными, тогда как растительные из-за относительно низкого содержания в них лизина, триптофана, треонина и других (по сравнению с мясом, молоком и яйцами) — неполноценные.
В табл. 2 приводится содержание незаменимых аминокислот в наиболее распространенных пищевых продуктах. С использованием этих данных можно ориентировочно составлять пищевой рацион, комбинируя белки различного происхождения для дополнения их по аминокислотному составу. Белки пшеницы, например, содержат недостаточное количество лизина (первая лимитирующая кислота) и треонина (вторая лимитирующая кислота), но эти аминокислоты в избытке присутствуют в казеине молока. С другой стороны, нехватка в казеине серосодержащих аминокислот компенсируется их содержанием в белках пшеницы.
Таблица 2. Биологическая ценность важнейших белоксодержащих продуктов питания и содержание в них незаменимых аминокислот (в мг/100 г)
| Пищевые продукты | Белок,
% |
Лимитирующие аминокислоты | Иле | Лей | Лиз | Мет | Цис | Фен | Тир | Три | Тре | Вал | |
| первая | вторая | ||||||||||||
| Молоко | 3,2 | Мет
97 |
— | 189 | 283 | 261 | 83 | 26 | 175 | 184 | 50 | 153 | 191 |
| Говядина | 21,6 | Вал
92 |
— | 939 | 1624 | 1742 | 588 | 310 | 904 | 800 | 273 | 875 | 1148 |
| Kуры | 18,2 | Иле
95 |
Вал
96 |
693 | 1412 | 1588 | 471 | 224 | 744 | 641 | 126 | 885 | 877 |
| Рыба (треска) | 16,0 | — | — | 700 | 1300 | 1500 | 500 | 200 | 800 | 600 | 210 | 900 | 900 |
| Яйцо (белок) | 11,1 | — | — | 628 | 917 | 683 | 413 | 277 | 673 | 397 | 169 | 483 | 735 |
| Kартофель | 2,0 | Мет
68 |
Лей
90 |
86 | 128 | 135 | 26 | 97 | 98 | 90 | 28 | 97 | 122 |
| Соя | 34,9 | Мет
87 |
— | 181 | 2670 | 2090 | 520 | 550 | 1610 | 1060 | 450 | 1390 | 2090 |
| Мука пшеничная
(высший сорт) |
10,3 | Лиз
43 |
Тре
75 |
430 | 806 | 250 | 153 | 200 | 500 | 250 | 100 | 311 | 471 |
| Мука ржаная (обойная) | 10,7 | Лиз
61 |
Тре
74 |
400 | 690 | 360 | 150 | 210 | 600 | 290 | 130 | 320 | 520 |
| Kрупа рисовая | 7,0 | Лиз
67 |
Тре
85 |
330 | 620 | 260 | 160 | 137 | 370 | 290 | 100 | 240 | 420 |
| Kрупа гречневая | 12,6 | Лиз
76 |
Тре
79 |
460 | 745 | 530 | 320 | 330 | 592 | 430 | 180 | 400 | 590 |
Важно помнить, что при избыточном потреблении животных белков в организм поступает повышенное количество насыщенных жирных кислот и холестерина; отсюда целесообразнее составлять диету, содержащую растительный белок, но из различных источников. Например, комплементарный состав белка обеспечивает смесь кукурузы с фасолью, при этом ликвидируется дефицит триптофана, лизина, метионина. Следует помнить, что сохранение нормального веса и работоспособности человека обеспечивается не только присутствием незаменимых аминокислот, но и содержанием общего азота. При его недостаточном количестве биологическая ценность белков понижается.
Наряду с аминокислотным составом биологическая ценность белков определяется степенью переваривания и степенью усвоения. Степень переваривания зависит от структурных особенностей белка, активности ферментов, глубины гидролиза в желудочно-кишечном тракте и вида их обработки в процессах приготовления пищи (тепловая, гидротермическая, в поле СВЧ и т. д.). Так, белки кожи и кератин волос из-за фибриллярной структуры вообще не перевариваются человеком, несмотря на близость их аминокислотного состава к составу белков тела. Тепловая обработка, разваривание, протирание, измельчение ускоряют переваривание белка, особенно растительного, тогда как нагревание при очень высоких температурах (свыше 100 °С) его затрудняет.
Животные белки имеют более высокую у свояемост ь, чем растительные. Из животных белков в кишечнике всасывается более 90 % аминокислот, а из растительных — только 60–80 %. В порядке убывания скорости усвоения белков в желудочно-кишечном тракте пищевые продукты располагаются следующим образом: рыба > молочные продукты > мясо > хлеб > крупы. Одной из причин более низкой усвояемости растительных белков является их взаимодействие с полисахаридами (клетчатка, гемицеллюлозы), которые затрудняют доступ пищеварительных ферментов к полипептидам.
При недостатке в пище углеводов и жиров требования к белку (как носителю пищевой ценности) особенно возрастают, так как наряду с биологической ролью он начинает выполнять и энергетическую роль. С другой стороны, при избыточном количестве белков (на фоне необходимого количества основных энергетических компонентов) возникает опасность синтеза липидов и ожирения организма.
5. Строение пептидов и белков. Физиологическая роль пептидов
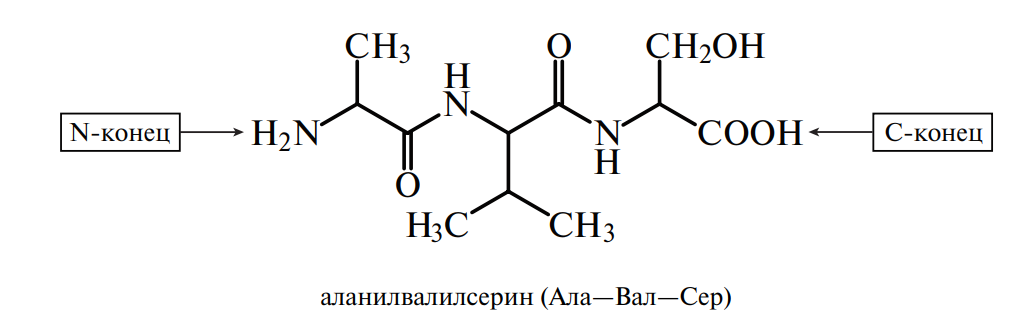
Пептиды. До середины ХХ в. считалось, что пептиды не являются самостоятельным классом органических соединений, а представляют собой продукты неполного гидролиза белков, которые образуются в процессе переваривания пищи или в технологических процессах производства и хранения пищевых изделий. И только после того как В. Дю Виньо (1953) определил последовательность остатков аминокислот двух гормонов задней доли гипофиза — окситоцина и вазопрессина — и воспроизвел их синтез химическим путем, появилась новая точка зрения на физиологическую роль и значение данной группы соединений. Сегодня обнаружено большое количество пептидов, которые обладают индивидуальной последовательностью аминокислот и не встречаются в гидролизатах природных белков. Пептиды имеют невысокую молекулярную массу, широкий набор аминокислотных остатков (в их состав входят, например, D-аминокислоты) и структурные особенности (циклические, разветвленные). Названия пептидов образуются из названий аминокислотных остатков путем последовательного их перечисления, начиная с NН2-концевого остатка, с добавлением суффикса «-ил», кроме С-концевой аминокислоты, название которой остается без изменений. Например:
В природе существуют два вида пептидов, один из которых синтезируется и выполняет физиологическую роль в процессе жизнедеятельности организма, другой образуется за счет химического или ферментативного гидролиза белков в организме или вне его. Пептиды, образующиеся в процессе гидролиза вне организма (in vitro), широко используются для анализа аминокислотной последовательности белков. С помощью пептидов расшифрована аминокислотная последовательность фермента лизицима, гормона поджелудочной железы инсулина (Сэнджер), яда кобры нейротоксина (Ю. Овчинников и др.), аспартатаминотрансферазы (А. Браунштейн и др.), пепсиногена, пепсина (В. Степанов и др.), лактогенного гормона быка (Н. Юдаев) и других биологически активных соединений. Ферментативное образование пептидов происходит в желудочно-кишечном тракте человека в процессе переваривания белков пищи. Оно начинается в желудке под действием пепсина, гастриксина и заканчивается в кишечнике при участии трипсина, химотрипсина, амино- и карбоксипептидаз.
Распад коротких пептидов завершается ди- и трипептидазами с образованием свободных аминокислот, которые расходуются на синтез белков и других активных соединений. Гидролиз белка в желудочно-кишечном тракте обеспечивает структуру радикалов концевых аминокислот, зависящую от места приложения фермента (свойство специфичности). Так, при разрыве белка пепсином пептиды в качестве N-концевых аминокислот содержат фенилаланин и тирозин, а в качестве С-концевых — глутаминовую кислоту, метионин, цистин и глицин. Пептиды, образующиеся из белка при участии трипсина, в качестве С-концевых аминокислот содержат аргинин и лизин, а при действии химотрипсина — ароматические аминокислоты и метионин.
Для многих природных пептидов установлена структура, разработаны методы синтеза и установлена их роль. На рис. 8 отображены физиологическое значение и функциональная роль наиболее распространенных групп пептидов, от которых зависят здоровье человека, органолептические и санитарно-гигиенические свойства пищевых продуктов.
Пептиды-буферы. В мышцах различных животных и человека обнаружены дипептиды — карнозин и ансерин, выполняющие буферные функции за счет входящего в их состав имидазольного кольца гистидина.
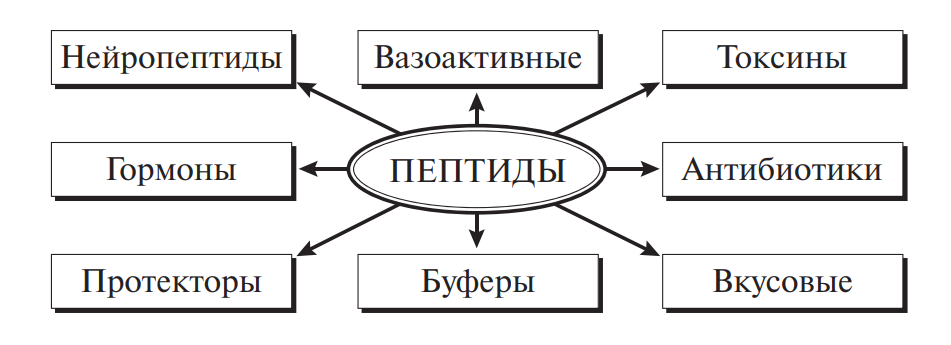
Рис. 8. Важнейшие группы пептидов
Отличительной особенностью этих пептидов является присутствие в них остатка β-аланина:
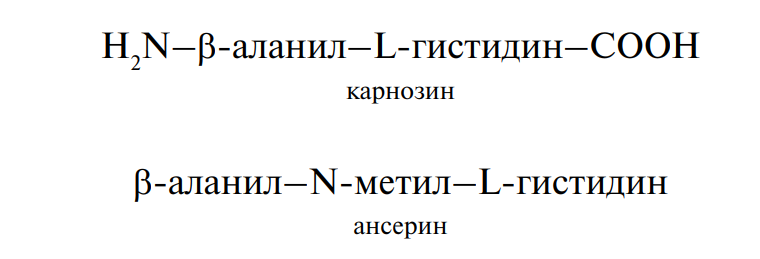
Синтез дипептидов-буферов осуществляется по следующей схеме без участия рибосом:

Карнозин и ансерин являются составной частью экстрактивных веществ мяса. Содержание их в последнем достигает 0,2–0,3 % от сырой массы продукта.
Пептиды-гормоны. Гормоны — вещества органической природы, вырабатываемые клетками желез внутренней секреции. Они поступают в кровь с оказанием регулирующего влияния на деятельность отдельных органов и организма в целом. Гормоны окситоцин и вазопрессин выделяются задней долей гипофиза (придаток мозга). Они содержат по 9 аминокислотных остатков, одну дисульфидную связь и на С-конце — амидную группу –СОNН2:
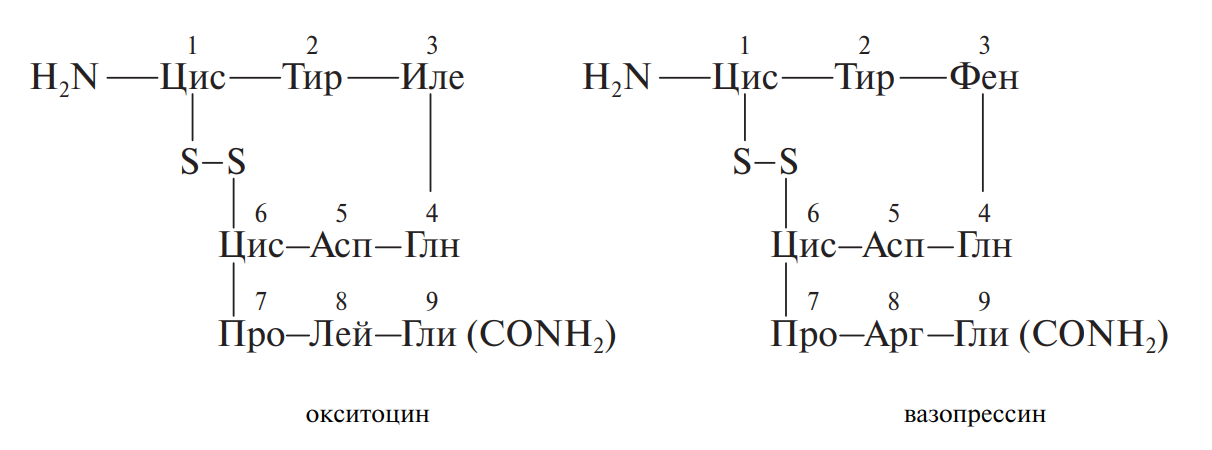
Регуляторная функция обоих гормонов заключается в стимуляции сокращения гладкой мускулатуры организма и секреции молока молочными железами. Различия в природе остатков аминокислот в положении 3 и 8 дополнительно наделяют вазопрессин способностью регулировать водный баланс, осмотическое давление в крови и стимулировать процессы запоминания.
Гормоны гипоталамуса, в котором эндокринный аппарат взаимодействует с высшими отделами ЦНС, являются низкомолекулярными пептидами. Так, тиролиберин представлен трипептидом, состоящим из пироглутаминовой (циклической) кислоты, гистидина и пролинамида (Пироглу–Гис–Про–NН2), люлиберин является декапептидом (Пироглу–Гис–Три–Сер–Тир–Гли–Лей–Арг–Про–Гли–NН2), а соматостатин — циклическим тетрадекапептидом:
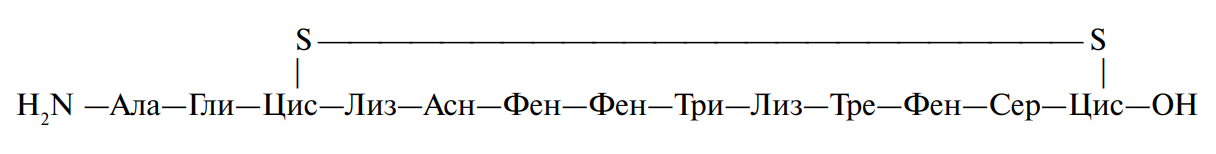
Гипоталамические гормоны участвуют в процессе высвобождения гормонов передней доли гипофиза. Тиролиберин, например, контролирует освобождение тиротропина — гормона, принимающего участие в регуляции деятельности щитовидной железы, соматостатин регулирует активность гормона роста (соматропина), а люлиберин участвует в регуляции выделения лютропина — гормона, влияющего на деятельность половых органов. Многие из гормонов (окситоцин, тиролиберин, пролактин — гормон передней доли гипофиза и гонадолиберин — гормон гипоталамуса) присутствуют в молоке жвачных животных и кормящих матерей.
Известен пептидный гормон меланотропин (МСГ), выделяемый в кровь промежуточной долей гипофиза. Одноцепочный пептид стимулирует образование пигмента, обусловливающего цвет глаз, кожи, волос. Различают две разновидности меланоцитостимулирующего гормона: α-МСГ, состоящий из 13 остатков аминокислот, и β-МСГ, в состав которого у человека входит 22 аминокислотных остатка. Панкреатический глюкагон, выделенный в 1948 г. в кристаллическом состоянии из поджелудочной железы человека, состоит из 29 остатков аминокислот. Он обладает двойным действием: ускоряет распад гликогена (гликогенолиз) и ингибирует синтез его из УДФ-глюкозы. Гормон активирует липазу, стимулируя процесс образования жирных кислот в печени.
Нейропептиды. В последние годы в отдельную группу выделяют более 50 пептидов, содержащихся в мозге человека и животных. Эти вещества определяют реакции поведения (боязнь, страх), влияют на процессы запоминания, обучения, регулируют сон, снимают боль. Нейропептиды, называемые эндорфинами и энкефалинами, являются производными β-липотропного гормона гипофиза, состоящего из 91 остатка аминокислот. β-Эндорфин представляет фрагмент гормона с 61-го по 91-й, γ-эндорфин — с 61-го по 77-й, а α-эндорфин — с 61-го по 76-й
остаток аминокислот. Энкефалины являются пентапептидами следующего строения:
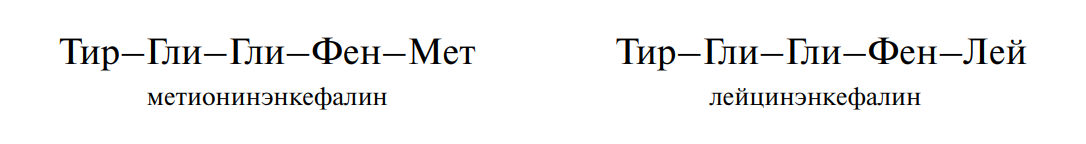
Во всем мире сегодня интенсивно проводятся работы по выделению и изучению нейропептидов, целью которых является получение искусственным путем биологически активных соединений для использования их в качестве лекарств.
Вазоактивные пептид ы. К группе пептидов, оказывающих влияние на тонус сосудов (вазоактивные), относятся брадикинин, каллидин и ангиотензин. Первый пептид содержит 9 остатков аминокислот, второй — 10, а третий — 8. Все они синтезируются из неактивных белковых предшественников в результате процесса посттрансляционной модификации. Например, ангиотензин, обладающий сосудосуживающими свойствами, образуется из белка сыворотки ангиотензиногена при последовательном действии протеолитических ферментов:
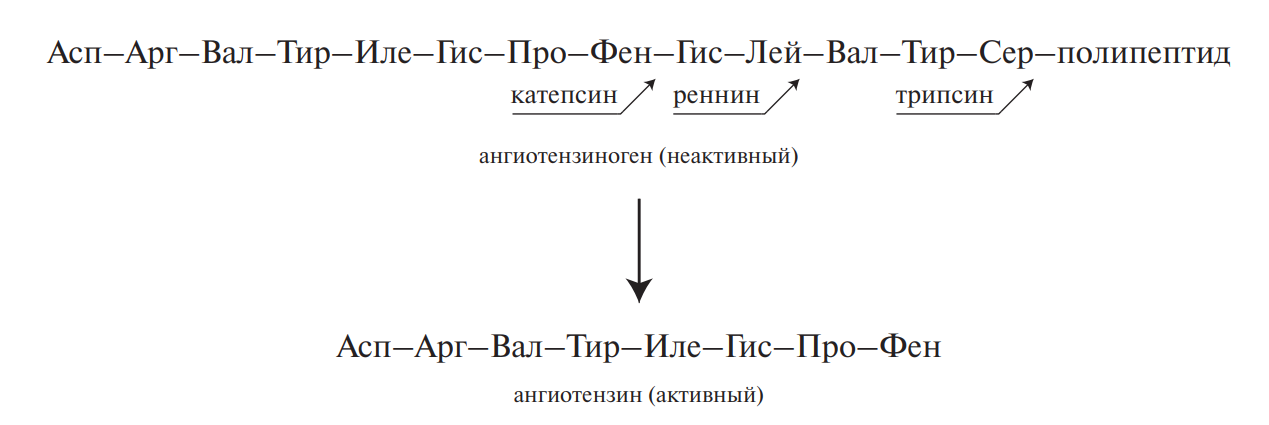
Пептидные токсины. Пептидную природу имеет ряд токсинов, вырабатываемых микроорганизмами, ядовитыми грибами, пчелами, змеями, морскими моллюсками и скорпионами. Идентифицировано 5 энтеротоксинов, продуцируемых бактериями Staphylococcus aureus (А, В, С, D и Е) и 7 нейротоксинов (от А до G), вырабатываемых Clostridium botulinum. Стафилококковые токсины, имея в своем составе 239–296 остатков аминокислот, отличаются по значению изоэлектрической точки, коэффициентам диффузии и седиментации. Токсины могут стать причиной пищевого отравления при употреблении молочных, мясных, рыбных, жидких яичных продуктов, а также салатов и кремовых начинок мучных кондитерских изделий при условии несоблюдения правил санитарно-гигиенической обработки и хранения последних. Ботулинические токсины относятся к наиболее сильнодействующим ядам и часто вызывают смертельные пищевые отравления при использовании овощей, рыбы, фруктов и приправ, не обработанных в соответствии с нормами. Молекулярная масса, например, токсина Е — 350 кД, токсина А — несколько больше. Эти токсины инактивируются при температуре выше 80 °С и в кислой среде.
Энтеротоксины могут вырабатываться и бактериями Salmonella и Clostridium perfringens, являясь при этом причиной расстройства работы кишечника, обморочных состояний и лихорадки (брюшной тиф). Продуцируются энтеротоксины чаще в продуктах животного происхождения (говядина, птица, сыр, рыба), чем растительного (фасоль, оливы). Наиболее хорошо изучен энтеротоксин C. perfringens с молекулярной массой 36 кД и изоэлектрической точкой 4,3. Токсин содержит 19 остатков аминокислот, среди которых преобладают аспарагиновая кислота, лейцин и глутаминовая кислота. Ухудшая транспорт электролитов и глюкозы, данный токсин вызывает гибель клеток кишечника.
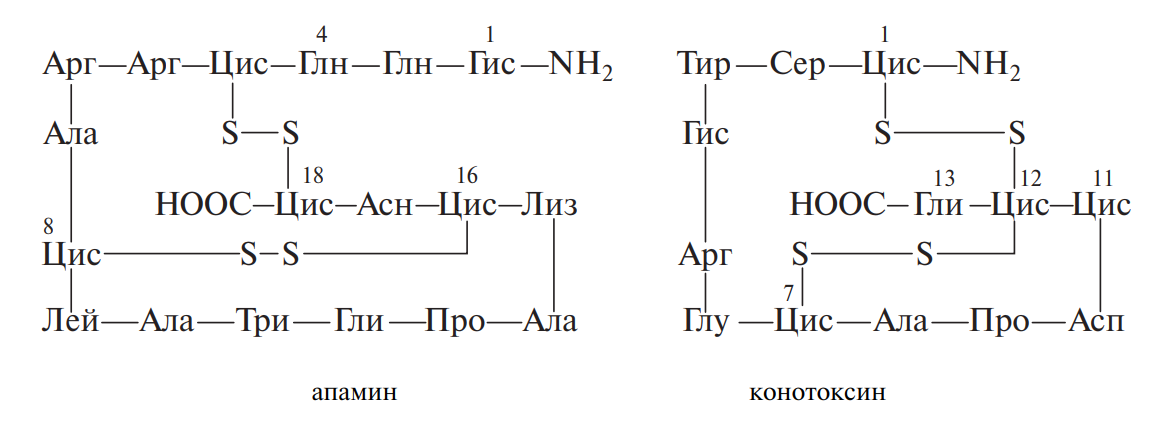
Ядовитый гриб бледная поганка содержит около 10 циклических пептидов с молекулярной массой около 1000. Типичным представителем их является особо ядовитый токсин α-аманитин. К токсичным компонентам яда пчел, оказывающим сильное влияние на ЦНС, относится апамин, состоящий из 18 аминокислотных остатков, а морских моллюсков — конотоксин, содержащий 13 остатков:
Пептиды-антибиотики. Представителями данной группы пептидов являются грамицидин S — циклический антибиотик, синтезируемый бактериями Bacillus brevis, и сурфактин — поверхностно-активный (содержащий сложноэфирную связь) антибиотик, синтезируемый бактериями Bacillus subtilis. Оба антибиотика эффективны при борьбе с инфекционными заболеваниями, вызываемыми стрептококками и пневмококками:
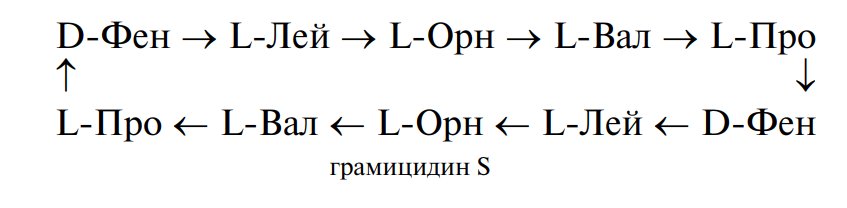
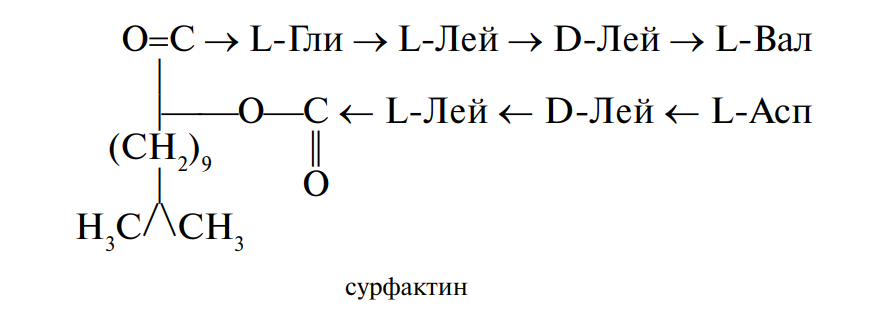
Грамицидин способен быть ионофором, то есть переносчиком ионов К+ и Na+ через мембраны клеток.
Структурной основой антибиотиков, выделяемых плесневыми грибами Penicillium, является дипептид, построенный из остатков D-валина и цистеина:
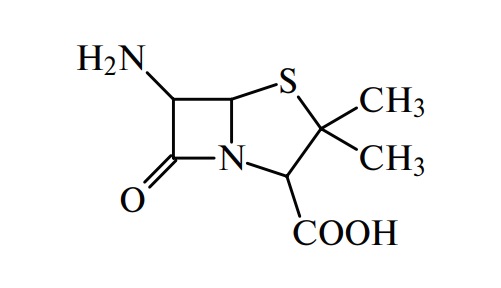
Антибиотики группы пенициллина эффективны при борьбе с инфекциями, вызываемыми стафилококками, стрептококками и другими микроорганизмами.
Вкусовые пептиды. Наиболее важными соединениями этой группы являются сладкие и горькие пептиды. В производстве мороженого, кремов в качестве подсластителей или усилителей вкуса используется аспартам, представляющий собой метиловый эфир L-α-аспартил-L-фенилаланина:
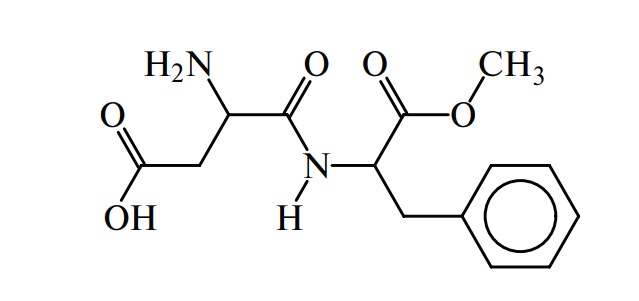
Аспартам слаще сахарозы; при длительном хранении и тепловой обработке сладость его уменьшается.
Пептиды горького вкуса образуются при распаде белков в сырах и молоке при участии протеаз молочнокислых бактерий. Они представляют собой низкомолекулярные гидрофобные соединения, содержащие от 2 до 8 остатков аминокислот полипептидных цепей α -казеина и β-казеина. Многие из горьких пептидов содержат N-концевую циклизованную глутаминовую кислоту. По мере гидролиза пептидов горький вкус таких соединений обычно исчезает.
Протекторные пептиды. Одним из наиболее распространенных соединений с протекторными свойствами является трипептид глутатион (γ-глутамилцистеинилглицин). Глутатион содержится во всех животных, растениях, бактериях, однако наибольшее его количество встречается в дрожжах и зародыше пшеницы. Вступая в окислительновосстановительные реакции, глутатион выполняет функцию протектора, предохраняющего свободные –SH-группы от окисления:
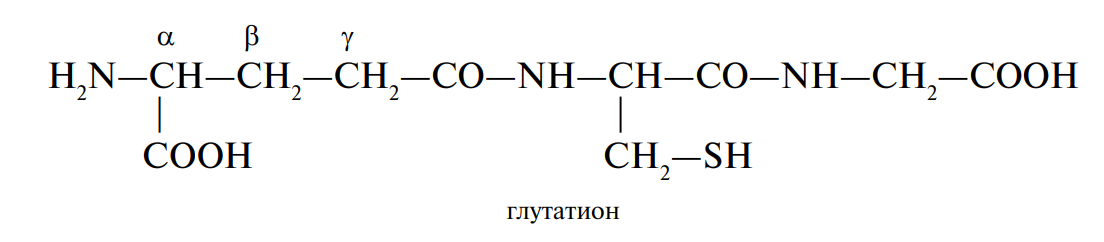
Глутатион принимает на себя действие окислителя, «защищая» тем самым белки или, например, аскорбиновую кислоту. При окислении глутатиона образуется межмолекулярная дисульфидная связь:
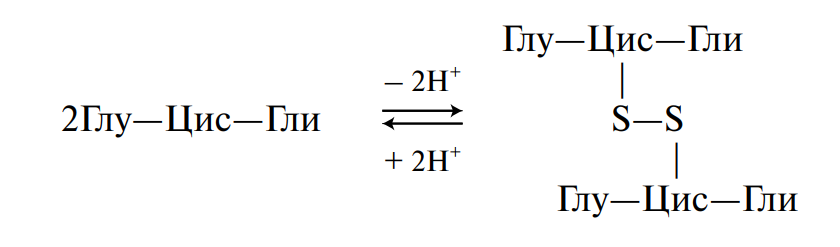
Глутатион принимает участие в транспорте аминокислот через мембраны клеток, обезвреживает соединения ртути, ароматические углеводороды, перекисные соединения, предотвращает заболевание костного мозга и развитие катаракты глаз.
Восстановленная форма глутатиона, входящая в состав хлебопекарных дрожжей, особенно долго хранившихся, или муки из проросшего зерна, понижает упругие свойства клейковины и ухудшает тем самым качество пшеничного хлеба. Дезагрегирующее действие восстановленного глутатиона на белки клейковины может осуществляться как без разрыва пептидных связей, так и с их разрывом. Дезагрегация белков без разрыва пептидных связей происходит при участии НАДФН2-содержащего фермента глутатионредуктазы:
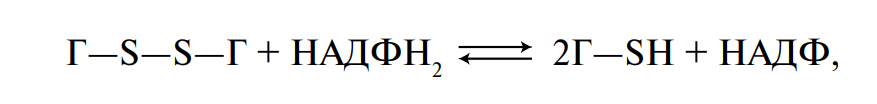
а с разрывом — в присутствии тиоловых протеиназ, активный центр которых содержит сульфгидрильные группы:
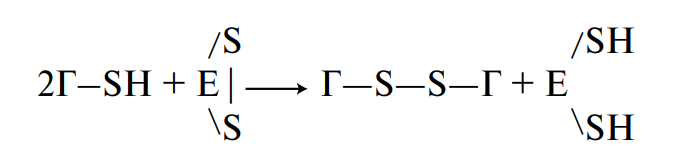
Разрыв пептидных связей в белках под действием активированных протеиназ приводит к ухудшению реологических свойств теста и качества хлеба в целом.
Белки. Пептиды, имеющие достаточно высокую молекулярную массу (более 5000 Да) и выполняющие ту или иную биологическую функцию, называются белками. Под первичной структурой белков понимают последовательность аминокислот в полипептидной цепи и положение дисульфидных связей, если они имеются. Последовательность аминокислотных остатков в цепи реализуется за счет пептидной связи. Пептидная связь имеет частично двойной характер, так как расстояние между –NH и –СО группами в ней занимает промежуточное (1,32 А° ) положение между расстояниями одинарной (1,49 А° ) и двойной (1,27 А° ) связей. Кроме того, группы R чередуются по обе стороны пептидной связи, следовательно, наблюдается трансизомерия. Расстояния между другими атомами и углы в структуре полипептидных цепей представлены на рис. 9.
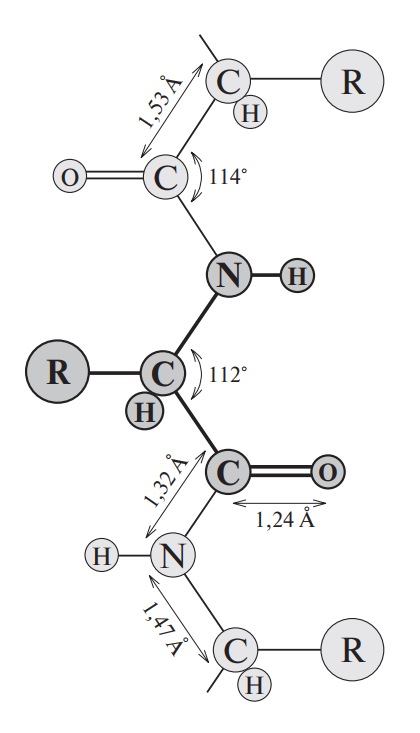
Рис. 9. Расстояние и углы между атомами в структуре полипептидной цепи
Многие белки состоят из нескольких полипептидных цепей, соединенных между собой дисульфидными связями. Образование дисульфидных мостиков –S–S– возможно и между двумя остатками цистеина, находящимися в одной полипептидной цепи. Примером могут служить основные белковые фракции клейковины: глиадин и глютенин пшеницы.
Определение последовательности аминокислот в белках представляет интерес по двум причинам. Во-первых, эти данные необходимы для выяснения молекулярной основы биологической активности и, во-вторых, для установления принципов, на основе которых формируются те пространственные структуры, от которых зависят физико-химические, питательные и функциональные свойства белков. Свойства определяют поведение белков в ходе технологических потоков и хранения, следовательно, усвояемость, переваривание и качество пищевых продуктов.
Для определения первичной структуры белка сначала разрывают дисульфидные связи, затем определяют аминокислотный состав, N-концевую и С-концевую аминокислоты и порядок соединения аминокислот друг с другом. Разрыв дисульфидных —S—S-связей осуществляют сильным окислителем (надмуравьиная кислота) или восстановителем, а аминокислотный состав определяют после гидролиза пептидных связей 6 н. раствором HCl при 110 °С в течение 24 ч в вакууме. Для анализа триптофана проводят щелочной гидролиз, так как в кислой среде данная аминокислота разрушается. Смеси аминокислот, полученные в результате гидролиза, фракционируют хроматографией на катионообменной смоле и идентифицируют.
Порядок соединения аминокислотных остатков друг с другом определяют химическими (метод Эдмана) и ферментативными методами. Ферментативные методы основаны на свойстве специфичности ферментов. Так, трипсин разрывает молекулу на уровне карбоксильных групп лизина и аргинина, химотрипсин — карбоксильных групп ароматических аминокислот:
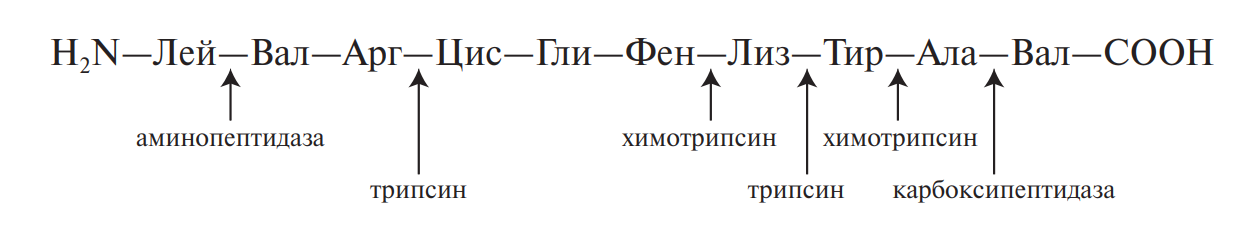
Для анализа последовательности аминокислотных остатков исходный материал делят на три части, одну из которых обрабатывают холодной HCl, другую — трипсином, третью — химотрипсином. Полученные смеси пептидов анализируют по аминокислотному составу и обрабатывают, наконец, экзопептидазами (амино- и карбоксипептидазы). Результаты суммируют с учетом того, что разрыв пептидов происходит в определенных местах цепи. Ниже иллюстрируется аминокислотная последовательность пептида из 25 первых аминокислот α2 — и γ1 -глиадинов пшеницы, расшифрованная таким образом для американского сорта Понка:

Полипептидная цепь белковой молекулы не лежит в одной плоскости. Полинг и Кори показали, что многие белки имеют конфигурацию α-спирали, которую легко можно представить в виде спирали, идущей по поверхности воображаемого цилиндра. Такая структура устойчива благодаря большому количеству водородных связей между –СО и –NН группами пептидных связей. Водородные связи возникают между ковалентно связанным атомом водорода, несущим небольшой положительный заряд, и соседним атомом, обладающим незначительным отрицательным зарядом (кислород, азот). Некоторые фибриллярные белки (β-керотин, фиброин шелка) образуют β-конформацию, представляющую собой как бы ряд листков, расположенных под углом друг к другу (рис. 10).
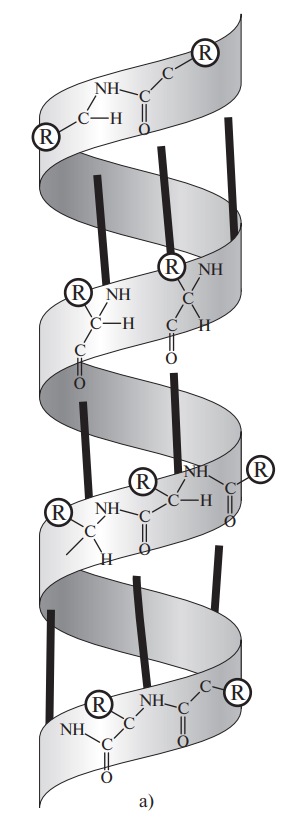
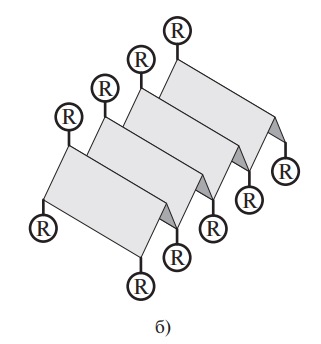
Рис. 10. Вторичная структура белков: а — α-спираль (жирные линии — водородные связи); б — β-конформация (R — боковые группы аминокислотных остатков)
Наряду с большим количеством водородных связей в стабилизации вторичной структуры белка принимают участие другие относительно слабые связи: электростатические и гидрофобные. Энергия этих связей мала по сравнению с энергией ковалентных пептидных и дисульфидных связей, однако благодаря своей многочисленности они обеспечивают устойчивость макромолекул и позволяют образовывать активные комплексы (фермент–субстрат, антиген–антитело, репрессор–ДНК). Природа таких связей приведена на рис. 11.
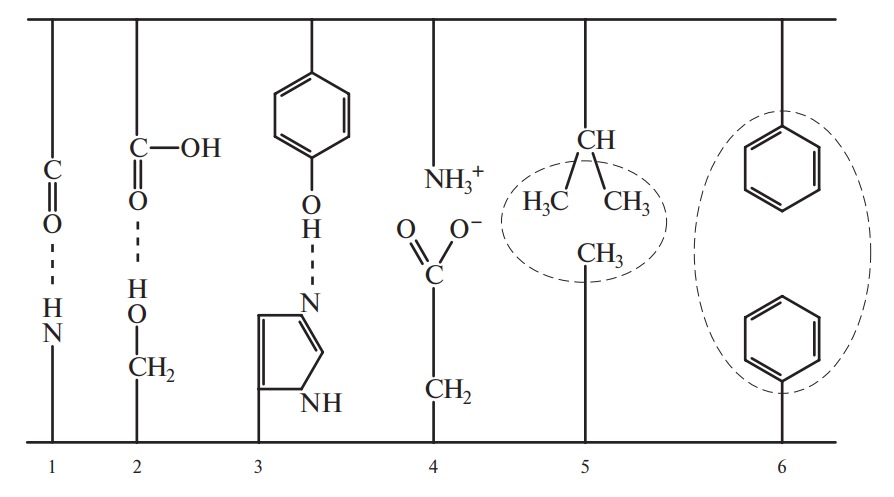
Рис. 11. Слабые связи: Водородные: 1 — между пептидными группами; 2 — между кислотами и спиртами (серин); 3 — между фенолом и имидазолом. Электростатические: 4 — между основаниями (аргинин, лизин) и кислотами (глутаминовая, аспарагиновая). Гидрофобные: 5 — при участии лейцина, изолейцина, валина, аланина; 6 — с участием фенилаланина
Между двумя противоположно заряженными полярными группами, например боковыми цепями аспарагиновой и глутаминовой кислот и положительно заряженным протонированным основанием (остатки аргинина, лизина, гистидина), осуществляются электростатические притяжения. Они более прочные, чем водородные связи. При участии СН2-, СН3-групп валина, лейцина, ароматического кольца фенилаланина возникают гидрофобные связи, которые представляют собой скопление взаимодействий, обусловленных выталкиванием воды из пространства, образующегося при близком расположении неполярных групп.
Регулярную вторичную структуру пептидных связей обеспечивают водородные связи, тогда как другие нековалентные взаимодействия участвуют в ней в меньшей степени. Большую роль такие взаимодействия играют в формировании третичной структуры, в которой важны изгибы, обусловленные присутствием пролина. В изгибах отсутствует спирализованная структура. Общим признаком пространственного расположения остатков аминокислот в третичной структуре белков является локализация гидрофобных групп внутри молекулы, гидрофильных — на ее поверхности. Впервые третичная структура установлена для миоглобина, затем — и для гемоглобина крови.
Многие белки обладают четвертичной структурой, которая представляет собой комбинацию субъединиц с одинаковой или различной первичной, вторичной и третичной структурой. Субъединицы соединены друг с другом с помощью слабых нековалентных связей. Действие мочевины, кислых, солевых растворов и детергентов часто приводит к диссоциации белка на субъединицы и потере биологической активности. Диссоциация может быть обратимой. Примером белков с четвертичной структурой могут служить ферменты лактатдегидрогеназа и глютаматдегидрогеназа, содержащие соответственно четыре и восемь субъединиц.
Особенности химического строения боковых цепей аминокислотных остатков и расположение их в пространстве определенным образом обеспечивают, при выполнении белками биологических функций, комплементарность (соответствие) контактируемых поверхностей или поверхностей белка с небелковыми соединениями по принципу «ключ к замку». Имеется ряд экспериментальных доказательств относительно механизма формирования структуры молекулы белка путем ассоциации α-спиралей и складчатых β-слоев (рис. 12). Этапы скручивания белка включают формирование двух временно создающихся коротких α- или β-спиралей, которые затем стабилизируются с образованием комплекса. Сформировавшиеся комплексы αα, ββ, αβ, называемые единицами скручивания, далее выступают в роли самостоятельных центров, способных к взаимодействию с другими элементами вторичной структуры. Задача заключается в том, чтобы как можно полнее расшифровать тот путь, который приводит к формированию функционально активной структуры белка в каждом конкретном случае.
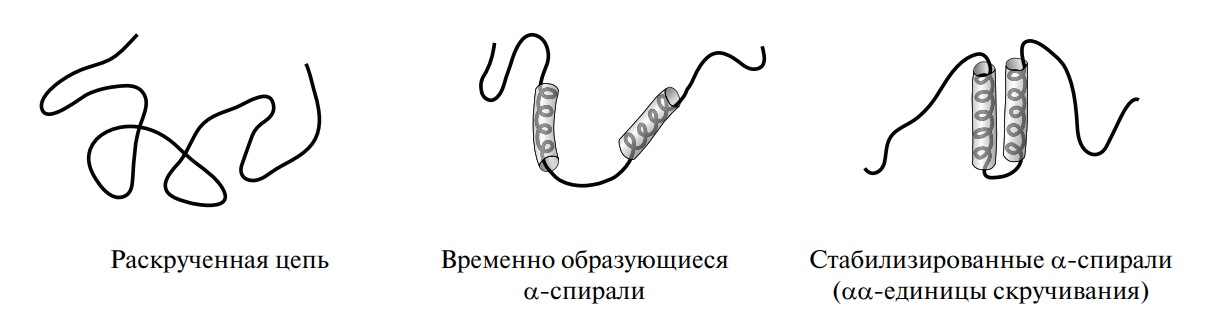
Рис. 12. Предполагаемые этапы скручивания белка
6. Белки пищевого сырья
Все зерновые культуры по химическому составу делятся на четыре группы: хлебные злаки (богатые крахмалом), бобовые (богатые белком), масличные (богатые маслом), эфиромасличные (богатые маслом и эфирными маслами). Типичными представителями первой группы культур являются пшеница, рожь, овес, ячмень, тритикале, рис. Семена бобовых культур представлены горохом, соей, фасолью, чечевицей, масличных — подсолнечником, рапсом, льном, хлопчатником, клещевиной.
Белки злаков
Зерновка всех хлебных злаков состоит из зародыша, эндосперма и оболочек (плодовая, семенная). Периферический слой эндосперма, расположенный под семенной оболочкой с крупными очерченными клетками, называется алейроновым слоем.
Белки неравномерно распределяются между морфологическими частями зерна. Основное их количество (65–75 %) приходится на эндосперм, меньшее — на алейроновый слой (до 15,5 %) и зародыш (до 22 %). В алейроновом слое и зародыше концентрация белка высокая. В зародыше пшеницы содержится 33,3 % белка, кукурузы — 26,5 %, овса — 19,4 %. Алейроновый слой пшеницы и кукурузы содержит более 19 % белка. В эндосперме белки распределены также неравномерно, концентрация их снижается по мере продвижения от субалейронового слоя к центру. Субалейроновым слоем называется периферическая зона зерновки, находящаяся под алейроновым слоем. Содержание белка в данной части зерна достигает у кукурузы 27,7 %, сорго — 29–30 %, ячменя — 21–24 %, риса — 29 %. Центральная часть эндосперма содержит мало белка (7–9 %). В общем же распределение белка по частям зерновки зависит от вида культуры, ее сорта и почвенно-климатических условий выращивания.
Белки зародыша и алейронового слоя представлены в основном альбуминами и глобулинами, выполняющими каталитическую функцию при прорастании зерна (ферменты), а белки эндосперма — альбуминами, глобулинами, проламинами и глютелинами. Бо´льшую часть белков эндосперма злаковых культур (до 80 %) составляют так называемые запасные белки: спирторастворимые проламины и щелочерастворимые глютелины. Альбумины и глобулины входят в состав мембран органелл зерна, образуют рибосомы, митохондрии, эндоплазматический ретикулум и являются составной частью сложных белков — нуклеопротеидов, липопротеидов, фосфопротеидов.
Запасные белки эндосперма злаков сосредоточены в белковых телах, имеющих более простое строение, чем алейроновые зерна (белковые тела алейронового слоя). Алейроновое зерно состоит из кристаллоида (гликопротеид), глобоида (калиевая, магниевая соль фитиновой кислоты) и основного белкового вещества — аморфной зоны.
У кукурузы и сорго белковые тела эндосперма состоят из матрицы и вдавленных в нее округлых белковых гранул. Матричные белки являются глютелинами, а белки гранул — проламинами. Матричный белок характеризуется однородной структурой, тогда как белковые гранулы имеют пластинчатую структуру с входящими в нее липопротеинами.
В эндосперме зрелого зерна пшеницы откладываются белковые образования в виде непрерывной белковой матрицы клиновидной формы и в виде выпуклых серповидных зон под мембраной, окружающей крахмальные зерна. С этими представлениями соотносится классификация Гесса (Hess, 1954), по которой белки муки делятся на промежуточные (цвикель) и прикрепленные (хафт). Промежуточные белки располагаются между крахмальными зернами и соответствуют белковой матрице, а прикрепленные представляют собой остатки мембран крахмальных зерен. У ржи и пшеницы прикрепленные белки характеризуются лучшим аминокислотным составом.
При размоле твердых и стекловидных мягких пшениц раскол компонентов происходит через крахмальное зерно и запасной белок, в результате чего крахмальные зерна разрушаются. При размоле зерна с мучнистым эндоспермом трещины образуются не в крахмальных зернах, а вокруг них, так как между белком и крахмалом существует относительно слабое взаимодействие.
Анализируя аминокислотный состав суммарных белков различных злаковых культур с точки зрения состава эталонного белка для питания людей (ФАО, 1973), следует отметить, что все они, за исключением овса, бедны лизином (2,2–3,8 %), а за исключением риса и сорго — и изолейцином. Для белков пшеницы, сорго, ячменя и ржи характерно относительно небольшое количество метионина (1,6–1,7 мг/100 г белка). Белки пшеницы к тому же содержат недостаточное количество треонина, а кукурузы — триптофана (2,6 и 0,6 % соответственно). Наиболее сбалансированными по аминокислотному составу являются овес, рожь и рис.
Аминокислотный состав суммарных белков злаковых культур определяется аминокислотным составом отдельных фракций, в основу классификации которых положено свойство растворимости (Т. Осборн, 1907). При последовательной обработке муки или размолотого зерна водой, 5–10 %-ным раствором хлорида натрия, 60–80 %-ным водным раствором спирта и 0,1–0,2 %-ным раствором гидроксида натрия экстрагируются белковые фракции, соответственно названные альбуминами, глобулинами, проламинами и глютелинами. В табл. 3 приводится процентное содержание белковых фракций в зерновых культурах.
Таблица 3. Содержание белковых фракций в зерне злаковых
| Kультура | Азот фракций (в % от белкового азота) | ||||
| Альбумины | Глобулины | Проламины | Глютелины | Склеропротеины | |
| Пшеница мягкая | 5,2 | 12,6 | 35,6 | 28,2 | 8,7 |
| Рожь | 24,5 | 13,9 | 31,1 | 23,3 | 7,2 |
| Ячмень | 6,4 | 7,5 | 41,6 | 26,6 | 17,9 |
| Kукуруза | 9,6 | 4,7 | 29,9 | 40,3 | 15,5 |
| Овес | 7,8 | 32,6 | 14,3 | 33,5 | 11,8 |
| Гречиха | 21,7 | 42,6 | 1,1 | 12,3 | 23,3 |
| Рис | 11,2 | 4,8 | 4,4 | 63,2 | 16,4 |
В состав белков входят и так называемые склеропротеины (нерастворимые белки), содержащиеся в оболочках и периферических слоях зерна. Особенностью белков данной фракции является прочное соединение с лигнино-полисахаридным комплексом. Склеропротеины выполняют структурную функцию и мало доступны для пищеварения. Наряду с белками в зерне содержится и небелковый азот (0,7–12,9 % от общего азота), включающий свободные аминокислоты (50–60 %), пептиды, нуклеотиды и др. Количество небелкового азота изменяется в зависимости от степени зрелости, выравненности и прорастания зерна.
Для а льбуминов отличительной особенностью является высокое содержание лизина (3,9–8,2 %), треонина (2,4–7,7 %), метионина (1,7– 3,3 %), изолейцина (3,1–6,0 %) и триптофана (6,7–16,9 %). Наиболее высоким содержанием лизина отличаются альбумины овса, риса и проса (6,5– 8,2 %), более низким — альбумины пшеницы, ячменя и ржи (3,9–4,5 %). Высокое количество треонина (4,7–7,7 %) характерно для альбуминов ячменя, ржи, овса, а низкое (2,4 %) — для альбуминов пшеницы.
Глобулиновая фракция злаковых культур беднее, чем альбуминовая, по содержанию лизина (2,8–6,0 %), триптофана (0,5–1,3 %) и метионина (1,1–2,7 %). Обе фракции отличаются высоким содержанием глутаминовой, аспарагиновой кислот, но низким — пролина.
Характерной особенностью п роламинов является высокое содержание остатков глутаминовой кислоты (13,7–43,3 %), пролина (6,3– 19,3 %) и малое количество иогенных групп, так как дикарбоновые кислоты почти полностью амидированы. Проламины отличаются низким содержанием лизина. Очень мало его в зеине кукурузы (0,2 %), глиадине пшеницы и секалине ржи (0,6–0,7 %). Высокий процент лизина (3,3 %) наблюдается в авенине овса. Небольшое количество лизина в проламинах и относительно большое содержание данной фракции в суммарном белке отражается на общей несбалансированности зерна большинства злаковых культур.
Проламины бедны к тому же треонином, триптофаном, аргинином, гистидином. Зеин кукурузы, оризин риса и кафирин сорго отличаются высоким уровнем лейцина (16,9–18,6 %). По содержанию цистина и метионина среди отдельных злаков также наблюдаются различия. Так, глиадин пшеницы в среднем содержит 1,2 % метионина и 1,9 % цистина, а авенин овса — 3,7 и 4,2 % соответственно.
Глютелины по аминокислотному составу занимают промежуточное положение между проламинами и глобулинами. Содержание лизина, аргинина, гистидина в них больше, чем в проламинах. Так, содержание лизина в глютенине пшеницы составляет 2,6 %, ржи — 2,3 %, ячменя — 4,0 %, а овса — 5,0 %. По содержанию лизина и цистеина между сортами зерна наблюдаются некоторые различия. Например, глютенин пшеницы слабого сорта Акмолинка 1 содержит меньше цистеина (5,18 %), чем глютенин пшеницы сильного сорта Саратовская 29 (7,34 %). Глютелины ячменя, риса и овса отличаются от глютенина пшеницы более высоким уровнем лизина. Если учесть, что у риса 80 % всего белка приходится на глютелины (оризенин), то понятно, почему обеспечивается удовлетворительное содержание лизина (2,6–4,0 %) в составе его белка рисового зерна.
Преобладающими фракциями овса являются глобулины и глютелины, содержащие 5,0–5,5 % лизина, что также обеспечивает хорошую сбалансированность данной культуры по лизину.
Белковые фракции зерновых культур представляют собой гетерогенную смесь отдельных компонентов, сходных по ряду физико-химических свойств. В то же время компоненты отличаются по электрофоретической подвижности, молекулярной массе, аминокислотному составу и способности взаимодействовать друг с другом при помощи различных типов связей.
В альбуминах мягкой пшеницы электрофорезом в ПААГ и крахмальном геле обнаружено 14–21 субъединиц, преобладающими среди которых по количеству являются субъединицы с молекулярной массой около 11 и 20 кД. Эти компоненты различаются по содержанию лизина, аланина, триптофана и гистидина. В твердой пшенице они отсутствуют.
В эндосперме мягкой пшеницы обнаружены доминирующие α-глобулины с молекулярной массой 24 кД, в зародыше — γ-глобулины с молекулярной массой 210 кД. К глобулинам относят и специфические белки, выделенные в кристаллической форме из бензинового экстракта муки (пуротионин пшеницы, гордотионин ячменя). В зерне они содержатся в виде липопротеинового комплекса, имеют молекулярную массу около 7 кД. Положительного влияния этих белков на хлебопекарные свойства муки не установлено.
С помощью ионообменной хроматографии, гельхроматографии, электрофореза и других методов глиадин пшеницы разделен на большое число индивидуальных компонентов. Его электрофоретические компоненты условно объединяют в порядке уменьшения электрофоретической подвижности в кислой среде в четыре группы: α-, β-, γ- и ω-глиадины, каждая из которых состоит из нескольких компонентов. Общее число белковых компонентов в пшенице может достигать 40–50.
При строго определенных условиях электрофореза в ПААГ или крахмальном геле электрофоретический спектр рассматривается как генотипический признак вида и сорта пшеницы (рис. 13). Эталонный спектр содержит 30 позиций, которые распределяются по фракциям следующим образом:
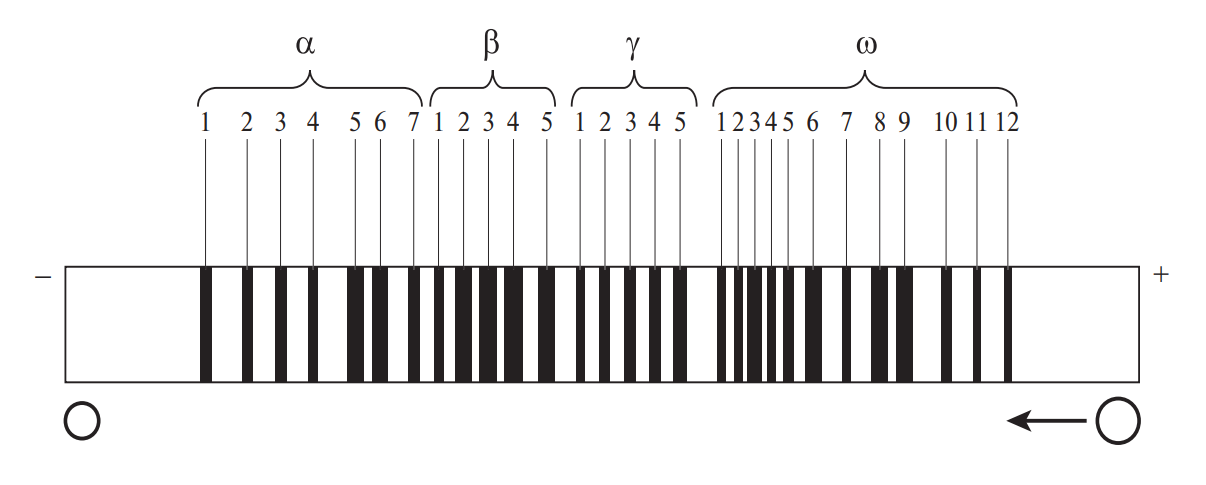
Рис. 13. Эталонный электрофоретический спектр глиадина пшеницы [В. Конарев, 1980]
В соответствии с этим эталоном глиадин сорта Лютесценс 230, например, записывается так:
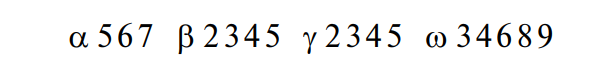
Большинство глиадиновых белков построено из одной полипептидной цепи (молекулярной массой 30–45 кД) с внутримолекулярными дисульфидными связями (рис. 14).
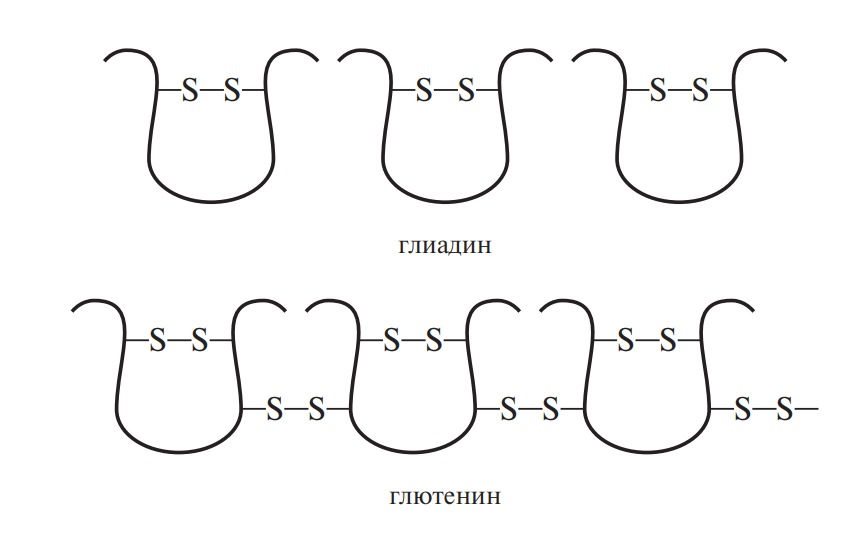
Рис. 14. Дисульфидные связи в глиадине и глютенине
В меньшем количестве в состав глиадина входят белки с молекулярной массой 22; 25,6; 48,8; 57,3 и 64–80 кД, а также димеры, построенные из одноцепочечных молекул главного типа (36,5 и 44,2 кД). От других компонентов в большей степени отличаются ω-глиадины, имеющие слабый заряд, высокое содержание глутамина, глутаминовой кислоты, пролина, гидрофобных остатков аминокислот и не содержащие цистина и метионина и внутримолекулярных дисульфидных связей. В питательном отношении ω-глиадины являются ценными источниками NH2-групп и пролина, необходимых для биосинтеза аминокислот и азотистых оснований.
В состав глиадина входят также низкомолекулярные белки (5–10 %) типа альбуминов, глобулинов (11–12 кД) и высокомолекулярная фракция («низкомолекулярный глютенин») с молекулярной массой 104– 125 кД (6 %).
Проламины других злаков также образуют индивидуальные электрофоретические спектры, поэтому, как и у пшеницы, они используются в роли белковых маркеров для определения видовой и сортовой принадлежности при выведении новых сортов, основываясь на том, что ценные хозяйственные признаки зерна (урожайность, засухоустойчивость, неспособность к полеганию и др.) могут зависеть от присутствия конкретных компонентов.
Глютенин пшеницы является более гетерогенной белковой фракцией по сравнению с глиадином. Он состоит из многих компонентов с молекулярной массой от 50 до 3000 кД и без разрыва дисульфидных связей не способен мигрировать в гель при электрофорезе. Восстановленный глютенин разделяется при электрофоретическом анализе не менее чем на 15 компонентов, состоящих из одной полипептидной цепи с молекулярными массами от 11,6 до 133 кД. Некоторые из них идентичны пептидам глиадина (36–44,6 кД), другие — пептидам альбуминов, глобулинов (11,6 кД), а третьи представляют собой специфические высокомолекулярные субъединицы (102, 124, 133 кД). Эти данные позволяют утверждать, что глютенин — это белок, построенный из многих полипептидных цепей, соединенных между собой дисульфидными связями. Расчеты показывают, что на каждую полипептидную цепь глютенина приходится две-три дисульфидные связи с соседними цепями (Эварт, 1968) (межцепочечные дисульфидные связи).
Изучению запасных белков отводится важная роль, однако их структура остается до конца не выясненной. Главной трудностью при этом является способность белков к агрегации, которую трудно преодолеть известными в настоящее время методами. До сих пор изучаются значения молекулярных масс компонентов и целых белковых фракций. Так, по последним данным наших ученых, глютенин состоит из небольшого количества субъединиц с молекулярной массой всего 100–300 кД, тогда как на долю белков со сверхвысокой молекулярной массой и одноцепочечных молекул приходится не более 20 %.
Предложено несколько гипотез строения глютенина и клейковины, однако ни одна из них не дает полного ответа на вопросы его взаимосвязи с природой вязкоэластичных свойств пшеничного теста. До конца не выяснен вопрос, чем отличаются глютелины зерновых культур, способных и не способных к формированию клейковинного комплекса. По представлениям Эверта, это различие обусловлено неодинаковым способом соединения отдельных полипептидных цепей через дисульфидные мостики при образовании полимерных молекул глютелинов. Каждая полипептидная цепь, соединяясь с другими, может увеличиваться в длину, образуя структуру линейного типа. Если же полипептидные цепи соединяются большим количеством поперечных дисульфидных мостиков, то возникает разветвленная трехмерная структура, обладающая относительно высокой компактностью. Глютелины зерновых культур, образующих клейковину, обладают линейной структурой, в отличие от глютелинов культур, не способных формировать ее (овес, кукуруза).
Реологические свойства клейковины и теста получают более полное обоснование, если принять линейную структуру глютенина, тогда и вязкость теста из пшеницы, ржи и ячменя можно объяснить сильным раскручиванием достаточно гибких цепей и постоянным перемещением их относительно друг друга. Свойство эластичности возникает вследствие тенденции растянутых, незакрученных полипептидных цепей возвратиться к их прежней конформации. Причиной же отсутствия вязкоэластичных свойств овсяного и кукурузного теста является ветвящийся способ соединения полипептидных цепей, характеризующийся трехмерной разветвленной структурой.
Во всем мире интенсивно проводятся исследования, посвященные зависимости хлебопекарных качеств пшеницы от полипептидного состава глютениновой фракции в связи с различиями сортов и классов на генетическом уровне. Установлено, что наиболее выраженное влияние на реологические свойства клейковины и качество хлеба оказывает присутствие высокомолекулярных субъединиц глютенина (100 кД) или соотношение высоко- и низкомолекулярных субъединиц. Всего обнаружено около 25 субъединиц с высокой молекулярной массой, 3–5 из них присутствует в каждом сорте. Каждой субъединице присвоен номер в зависимости от подвижности в ПААГ с ДДС-Na, и выясняется конкретная роль ее в обеспечении качества зерна. Например, 98 % американских сортов пшеницы, характеризующихся высокой «силой» и хорошей эластичностью теста, содержат субъединицы 5+10, синтез которых кодируется хромосомой 1D, тогда как у английских пшениц с низким качеством они встречаются только у 19 % образцов. Такая же картина наблюдается и в отношении высокомолекулярных субъединиц 7+8 и 7+9, кодируемых хромосомой В1.
Реологические свойства клейковины и качество пшеничного хлеба зависят не только от присутствия высокомолекулярных субъединиц (60 %), но и от наличия хромосомы 1ВL/1RS (7 %), полиморфизма низкомолекулярного глютенина, глиадина (α-, β-, γ-, ω-), количества белка и активности α-амилазы (31 %). Глютенин придает клейковине упругие свойства, а глиадин обусловливает растяжимость и связность, то есть ни глютенин, ни глиадин в отдельности не обладают характерными реологическими свойствами клейковины, только взаимодействие этих фракций в едином комплексе создает клейковинный белок со всеми присущими ему особенностями. Предполагают, что «полипептидные цепи глиадина в разных местах и разными связями соединяются с полимеризованными молекулами глютениновой фракции, объединяя их в сложную трехмерную сетку переплетающихся полипептидных цепей» (А. Вакар, 1975).
В структуре такой сетки значительную роль, помимо ковалентных дисульфидных связей, играют нековалентные взаимодействия: водородные, электростатические (ионные) связи и гидрофобные взаимодействия. Всем им отводится важная роль при объяснении различий в реологических свойствах крепкой и слабой клейковины (растяжимость, связность, упругость, эластичность).
Аминокислотный состав клейковинного белка и соотношение глиадиновой и глютениновой фракций не являются показателями его качества, тогда как растворимость, содержание водородных, дисульфидных связей и вискозиметрические характеристики соотносятся с различиями реологических характеристик клейковины. Крепкая клейковина отличается от слабой меньшей растворимостью в разных растворителях, большим количеством водородных и дисульфидных связей, меньшими значениями характеристической вязкости, удельного гидродинамического объема и осевого отношения частиц. Частицы крепкой клейковины имеют уплотненную структуру, слабой — разрыхленную.
Более высокая скорость агрегации белков клейковины хорошего качества при действии на них солей свидетельствует о большей роли гидрофобных взаимодействий в структуре крепкой клейковины по сравнению со слабой. Установлен больший вклад этих видов взаимодействий в агрегацию глютенина и его фракций. Для упругой, эластичной клейковины на долю белков глютенина, перешедшего в раствор за счет разрыва гидрофобных связей, приходится 25,4 %, ионных связей — 17,3 %, водородных — 56,3 %, в то время как для неупругой и растяжимой клейковины распределение белка по растворимости следующее: 7,1; 12,8 и 80,1 % соответственно. Излишняя «гидрофобизация» поверхности белковых молекул (действие жирных кислот, тепловая денатурация и т. д.) приводит к ухудшению связности, снижению гидратации и растворимости. Таким образом, разная степень упругости, растяжимости и связности определяется различным соотношением сил ковалентного и нековалентного характера (гидрофобные, ионные, водородные связи) как внутри фракций клейковины, так и на уровне взаимодействия их друг с другом.
Признавая за глиадином и глютенином главенствующую роль в обеспечении качества клейковины, необходимо учитывать роль и небелковых соединений в формировании ее структуры. Высокая реакционная способность химических группировок молекул белка делает возможным взаимодействие их с липидами, углеводами и образование соответственно липопротеиновых и гликопротеиновых комплексов, оказывающих влияние на структуру и свойства клейковины. Общепризнана гипотеза, по которой фосфолипиды являются составной частью липопротеина, выполняющего роль слоистой структуры между белковыми пластинками и обеспечивающего деформацию скольжения (Гросскрейтц, 1960). В целом же особенности взаимодействия белков с другими веществами зерна остаются до конца не изученными.
С клейковинным комплексом пшеницы находятся во взаимодействии протеазы, их белковые ингибиторы, амилазы и липоксигеназа (табл. 4). Протеазы извлекаются щелочным раствором соды, β-амилаза — водным раствором спирта, а липоксигеназа и β-амилаза — раствором глутатиона. В покоящемся зерне ферменты не проявляют своей активности, тогда как при прорастании они участвуют в распаде и превращениях запасных питательных веществ. Не менее важная роль отводится ферментам и при тестоведении. Протеазы, частично дезактивируя белки, ослабляют клейковину, а липоксигеназа, при участии которой продукты окисления жирных кислот окисляют –SH-группы белка, укрепляет ее. Высвобождение липоксигеназы из клейковины происходит в присутствии восстановленного глутатиона. С другой стороны, это же соединение, принимая участие в тиоловом обмене клейковины, уменьшает количество S–S-связей и ослабляет ее. Таким образом, ферментные системы в комплексе с клейковинными белками выступают в роли регулятора качества пшеничного хлеба.
Среди злаковых культур особого внимания заслуживает белковый комплекс первой искусственно созданной зерновой культуры, полученной при скрещивании пшеницы (Triticum) и ржи (Secale) — тритикале. С точки зрения питательности тритикале — ценная культура, так как ее отличает относительно высокий уровень белка (11,7–22,5 %) и улучшенный аминокислотный состав по сравнению с пшеницей. Аминокислоты в тритикале содержатся, как правило, в количествах, промежуточных между родительскими формами (табл. 5). Более высокое содержание лизина, метионина и других аминокислот существенно для пищевой ценности. В данной культуре геномы ржи и пшеницы не взаимодействуют между собой с образованием «новых» белков, поэтому их электрофореграммы являются идентичными электрофореграммам смесей белков родительских форм.
По сравнению с пшеницей тритикале содержит больше водорастворимых и солерастворимых белков, но меньше — спирторастворимых и значительно меньше — белков нерастворимого остатка, поэтому в хлебопечении она может использоваться только в смеси с пшеничной мукой или с улучшителями.
Таблица 4. Ферментативная активность белков клейковины (М. Попов, 1998)
| Растворитель | Растворенный
белок, % |
Активность ферментов, ед/г клейковины | ||
| Протеазы
A280/г |
Липоксигеназа
A234/г |
-Амилаза A595/г | ||
| Сода 0,35 %-ная | 23,3 | 5,94 | 0 | 0 |
| Спирт 70 %-ный | 49,1 | 0 | 0 | 1560 |
| Глутатион 0,75 %-ный | 92,7 | 0 | 780 | 9835 |
Таблица 5. Аминокислотный состав белков муки (в г на 100 г белка)
| Аминокислота | Яровая рожь | Тритикале | Твердая пшеница |
| Лизин | 3,49 | 2,80 | 2,29 |
| Гистидин | 2,14 | 2,34 | 2,37 |
| Аргинин | 4,55 | 4,77 | 3,64 |
| Аспарагиновая кислота | 6,82 | 5,67 | 4,62 |
| Треонин | 3,26 | 3,05 | 2,82 |
| Серин | 4,11 | 4,37 | 4,37 |
| Глутаминовая кислота | 30,51 | 32,91 | 35,78 |
| Пролин | 15,29 | 14,18 | 13,92 |
| Глицин | 3,82 | 3,87 | 3,52 |
| Аланин | 4,06 | 3,55 | 3,27 |
| Цистеин | 2,65 | 3,22 | 2,66 |
| Валин | 5,22 | 4,93 | 4,77 |
| Метионин | 2,15 | 2,25 | 2,14 |
| Изолейцин | 4,21 | 4,37 | 4,51 |
| Лейцин | 6,65 | 7,55 | 7,46 |
| Тирозин | 2,16 | 2,81 | 2,67 |
| Фенилаланин | 5,16 | 4,98 | 5,48 |
| Аммиак | 3,40 | 3,25 | 3,91 |
Белки бобовых культур
Основную часть семядолей бобовых культур (соя, горох, фасоль, вика) составляют запасные белки, являющиеся глобулинами. Кроме того, в семенах содержится небольшое количество альбуминов, которые не являются запасными белками. В качестве самостоятельной группы в семядолях не обнаружены глютелины. Извлекаемые щелочью белки также представляют собой глобулины, но они находятся во взаимодействии с полисахаридами, поэтому хуже растворяются. Общее содержание белка в бобовых культурах высокое и составляет 20–40 % от общей массы.
Из суммарного солевого белкового экстракта осаждением сернокислым аммонием выделяют два основных глобулиновых компонента, получивших названия вицилин и легумин. С учетом значений констант седиментации (см. п. 10) у сои, вики, гороха и других культур их называют 7S и 11S белками соответственно. Оба эти вида белков обладают сложной четвертичной структурой, которая определяет их функции и свойства. Диссоциация 11S белков семян на субъединицы обнаружена еще в 1930-е гг. Сведбергом и Педерсеном, но более детально она изучена позднее. Установлено, что 11S белки семян бобовых диссоциируют сначала на 7S субъединицы, затем на субъединицы с коэффициентом седиментации 2–3S.
Диссоциация 11S белков протекает ступенчато по схеме:
Результаты, полученные методом седиментационного равновесия, свидетельствуют о том, что каждая из 2S субъединиц, образующихся под влиянием сильных диссоциирующих агентов, таких как мочевина, состоит из одной полипептидной цепи с молекулярной массой 30 кД (табл. 6), а общее количество полипептидных цепей в молекуле 11S белка равно 12.
Таблица 6. Молекулярные массы субъединиц 11S белков сои и вики
| Ступень диссоциации | Условия диссоциации | Белок сои | Легумин вики | ||
| S20, w | Молекулярная масса, Да | S20, w | Молекулярная масса, Да | ||
| 11S | рН 7,0 | 12,2 | 363 000 | 12,9 | 362 000 |
| 7S | рН 4,0 | — | 180 000 | 8,0 | 190 000 |
| 3S | рН 2,7 | 3,5 | 63 000 | 3,3 | 60 000 |
| 2S | 4М мочевина | — | 31 000 | 1,7 | 30 000 |
| 2S | 4М гуанидингидрохлорид | — | — | — | 30 000 |
На основании данных хроматографического разделения белков на ДЭАЭ-целлюлозе, электрофореза в ПААГ, седиментационного, аминокислотного анализов и определения N-концевых аминокислот для белков большинства бобовых культур более детально конкретизирована вышеописанная схема диссоциации легумина. Для белков, например, в и к и она выглядит следующим образом:
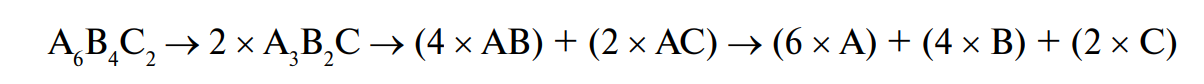
Каждая молекула 11S белков вики состоит из шести основных (А) и шести кислых 2S субъединиц двух видов — В и С. Некоторые свойства этих субъединиц приводятся ниже:

11S белок сои отличается от легумина вики наличием трех, а не двух типов кислых субъединиц. Так же как и у легумина вики, N-концевой аминокислотой является глицин, а ее молекулярная масса равна 22,3–24,4 кД. Кислые субъединицы имеют ту же молекулярную массу, что и субъединицы В легумина вики. 11S белок сои может содержать несколько типов и основных субъединиц, однако точно известно, что молекула 11S белка сои также состоит из шести основных и шести кислых субъединиц.
Особенности модели четвертичной структуры 11S белков бобовых аналогичны особенностям этой же структуры 11S белков семнадцати других семейств, относящихся к филогенетически удаленным группам (капуста, тыквенные, гречиха, рапс). Так же как и легумин вики, эдестин к онопл и, например, диссоциирует на шесть 3S субъединиц, каждая из которых состоит из одной основной субъединицы с N-концевым глицином и молекулярной массой 23 кД и одной кислой субъединицы. Аминокислотный состав этих субъединиц сходен (табл. 7). Эти данные позволяют считать, что 11S белки обладают сходной четвертичной структурой и что их соответствующие субъединицы гомологичны.
Таблица 7. Аминокислотный состав полипептидных цепей легумина вики и эдестина конопли (в г на 100 г белка)
| Аминокислота | Основные | цепи | Kислые | цепи | |||
| Эдестин | Легумин | Эдитин | В-цепь легумина | С-цепь легумина | |||
| Аспарагиновая | 12,2 | 12,1 | 11,9 | 12,3 | 8,4 | ||
| Треонин | 3,8 | 3,7 | 3,0 | 2,1 | 2,5 | ||
| Серин | 4,5 | 4,7 | 5,1 | 4,1 | 5,2 | ||
| Глутаминовая | 13,0 | 10,2 | 21,6 | 19,8 | 23,7 | ||
| Пролин | 3,2 | 4,1 | 3,0 | 3,8 | 5,4 | ||
| Глицин | 3,1 | 2,9 | 4,2 | 3,6 | 3,0 | ||
| Аланин | 5,5 | 5,9 | 3,3 | 3,1 | 1,9 | ||
| Валин | 7,0 | 7,2 | 5,1 | 2,8 | 2,7 | ||
| Метионин | 2,9 | 0,5 | 1,5 | 1,0 | 0,1 | ||
| Изолейцин | 4,5 | 3,7 | 4,9 | 4,6 | 4,2 | ||
| Лейцин | 7,9 | 9,5 | 6,2 | 5,5 | 5,9 | ||
| Тирозин | 4,4 | 4,2 | 4,0 | 4,0 | 2,2 | ||
| Фенилаланин | 6,1 | 4,3 | 4,5 | 4,5 | 3,4 | ||
| Лизин | 3,5 | 4,4 | 1,9 | 3,8 | 4,1 | ||
| Гистидин | 2,0 | 1,8 | 2,6 | 2,7 | 3,3 | ||
| Аргинин | 13,3 | 10,8 | 15,3 | 12,2 | 9,4 | ||
| Цистеин | 0,9 | 0,8 | 1,1 | 0,9 | 0,8 | ||
| Триптофан | 1,4 | 1,6 | 0,9 | 1,8 | 2,0 | ||
Запасные 7S белки изучены значительно меньше, чем 11S белки. Известно, что у вики, гороха, сои и арахиса они также диссоциируют на субъединицы. Так, у 7S белков вики и сои конечными продуктами диссоциации являются 2S субъединицы, промежуточными — 4S субъединицы. Для указанных видов субъединиц получены значения молекулярных масс соответственно 31–33 кД и 84 кД. Учитывая молекулярные массы 7S белка вики (186–193 кД) и сои (180–193 кД), приходят к выводу, что молекулы 7S белков состоят из шести 2S субъединиц, а 4S субъединицы являются «полумолекулами» 7S субъединиц. Таким образом, обнаруживается сходство четвертичных структур 7S и 11S белков глобулиновой фракции бобовых. 2S субъединицы 7S белков между собой не идентичны.
В последние годы накапливается все больше сведений о существенном значении четвертичной структуры в регулировании процесса гидролиза запасных белков при прорастании. Еще классическими работами Д. Прянишникова (1939) показано, что такие белки при прорастании семян распадаются на низкомолекулярные соединения. Позже было высказано предположение, что гидролиз запасных белков предшествует их диссоциации на субъединицы (В. Кретович, 1960). Предположение экспериментально подтверждено, и, более того, сейчас известно, что диссоциация белков сопровождается предварительным дезамидированием остатков аминокислот, накоплением мочевины и протеканием ряда других процессов, облегчающих эту диссоциацию.
Белковый комплекс суммарных глобулинов различных видов бобовых характеризуется отличиями в растворимости, хроматографическом, электрофоретическом и аминокислотном составах. Эти данные используются в селекционно-генетических работах для выведения новых сортов растений с заданным количеством незаменимых аминокислот.
Среди бобовых культур в качестве источника пищевого биологически ценного белка наибольшее значение имеют семена сои. С их использованием организовано производство соевой муки (обезжиренная, полужирная, необезжиренная), концентратов и изолятов. Данные об аминокислотном составе и количестве суммарного белка в продуктах из бобов сои приведены в табл. 8.
Наряду с белками, обладающими питательной ценностью, в состав бобовых культур входят антиалиментарные соединения, имеющие также белковую природу. Они понижают питательную ценность белковых продуктов и пищевых изделий. К таким соединениям относятся ингибиторы протеаз желудочно-кишечного тракта и лектины.
В семенах сои содержится не менее пяти ингибиторов трипсина в количестве 5–10 % от общего содержания белка. Наиболее хорошо изучены ингибитор Кунитца, на долю которого приходится 90 % общей активности ингибиторов, и Баумана–Бирк. Ингибиторы представляют собой белковые молекулы с молекулярными массами 21,5 и 8 кД соответственно. Для них расшифрована первичная структура. Так, самый высокомолекулярный — ингибитор Кунитца — имеет в своем составе 181 остаток аминокислот и две дисульфидные связи. Расщепление одной из них не влияет на активность ингибитора, тогда как одновременное восстановление двух связей приводит к получению неактивного продукта.
Таблица 8. Аминокислотный состав и количество суммарного белка в продуктах из бобов сои
| Характеристика | Соевые бобы | Обезжиренная соевая мука | Kонцентраты сои | Изоляты сои |
| Содержание белка, % на с. в. | 39,6 | 57,0 | 68,0 | 91,0 |
| Содержание аминокислот,
г на 100 г белка: |
||||
| лизин | 6,5 | 6,3 | 6,3 | 6,0 |
| метионин + цистеин | 1,3 | 2,9 | 2,8 | 2,2 |
| треонин | 4,6 | 4,0 | 4,3 | 3,5 |
| лейцин | 8,5 | 7,7 | 7,9 | 7,8 |
| изолейцин | 5,2 | 4,4 | 4,6 | 4,5 |
| фенилаланин + тирозин | 5,2 | 8,6 | 8,9 | 8,7 |
| валин | 5,6 | 4,8 | 4,8 | 4,6 |
| триптофан | 0,8 | 1,4 | 1,5 | 1,2 |
Понижение активности ферментов белковыми ингибиторами связано с образованием устойчивых белок-белковых комплексов, содержащих молекулу ингибитора и одну или несколько молекул фермента. Имеются доказательства о существовании в белках-ингибиторах «активного» участка, вступающего во взаимодействие с активным центром фермента. В состав всех ингибиторов трипсина входят расположенные в пространстве особым образом остатки лизина или аргинина.
Белковые ингибиторы различаются по специфичности, выражающейся в неодинаковой способности подавлять активность различных ферментов. Так, ингибитор Кунитца из сои подавляет активность трипсина и фермента крови плазмина, но слабо ингибирует химотрипсин, а ингибитор Баумана–Бирк снижает активность не только трипсина, но и химотрипсина. Являясь «двухцентровым» ингибитором, ингибитор Баумана–Бирк одновременно вступает в реакцию с двумя молекулами различных ферментов и не может связывать две молекулы одного фермента.
В технологических процессах производства белковых продуктов из сои предусматривается инактивация ингибиторов протеиназ обработкой паром, микроволновым нагревом, вымачиванием с последующим кипячением и другими способами. Инактивация ингибиторов трипсина на 80–90 % по сравнению с их активностью в исходном сырье уже позволяет отнести белковые продукты к пищевым безопасным ингредиентам.
Лектины (от лат. legere выбирать) — это гликопротеины растительного происхождения, связывающие один или несколько специфических сахаров. Свое название они получили от избирательной способности вызывать агглютинацию (агрегацию, склеивание) эритроцитов крови, клеток, бактерий. Агглютинация происходит путем взаимодействия лектинов с углеводными компонентами поверхности клеток. Так, лектин соевых белков, например, специфичен к остаткам галактозы и N-ацетилгалактозамина, а агглютинин зародышей пшеницы — к остаткам N-ацетилглюкозамина и N-ацетилнейраминовой кислоты. На долю лектинов в бобовых культурах приходится от 2 до 10 % общего белка. В очищенном виде лектины широко используются для определения группы крови, очистки гликопротеинов и в качестве средств для изучения поверхностей здоровых и больных клеток, лишенных некоторых ферментов синтеза олигосахаридов. Как связывающие специфические сахара, лектины используются в качестве зондов для «узнавания» сахаров на мембранах клеточной поверхности здоровых и раковых клеток. Агглютинация раковых клеток требует меньше лектинов, чем здоровых.
Отсутствие высокой активности лектинов, как и ингибиторов ферментов, в белковых продуктах из бобовых является одним из санитарно-гигиенических требований, предусматриваемых сертификацией для использования их в хлебопечении, кондитерской и других отраслях промышленности в целях повышения пищевой ценности изделий. Снижение активности лектинов достигается применением более мягких условий, чем снижение активности ингибиторов ферментов — нагреванием при 80 °С.
Некоторые виды белковых продуктов из сои (энзиматически активная соевая мука) содержат ферменты: липоксигеназу, β-амилазу. Липоксигеназа принимает участие в процессах отбеливания пшеничной муки и стабилизации теста хлебобулочных изделий, а β-амилаза, являясь более термостабильной, чем пшеничная, долго сохраняет активность на ранних стадиях приготовления хлеба, позволяя интенсифицировать процесс газообразования в тесте и улучшать качество хлеба.
Белки масличных культур
У масличных семян основной запасающей тканью для белков и липидов является паренхима семядолей (подсолнечник, хлопчатник, рапс), эндосперм (клещевина, кориандр) или одновременно паренхима семядолей и эндосперм (хлопчатник, лен). Запасные белки сосредоточены в простых алейроновых зернах (семена хлопчатника, рапса, горчицы) и сложных (подсолнечник, клещевина).
Простые алейроновые зерна не содержат посторонних соединений, тогда как сложные включают белковую и небелковую части. Сложные алейроновые зерна подразделяются на два типа: зерна, содержащие глобоиды — К-, Mg-, Ca-соли инозитфосфорной кислоты, и зерна, в состав которых входят глобоиды и кристаллоиды. Кристаллоиды расположены в центре алейроновых зерен и окружены аморфной белковой зоной. Алейроновое зерно имеет вакуольную природу, вокруг него сосредоточены липиды, находящиеся в клетке, покрытой клеточной оболочкой (рис. 15). На долю белка в составе сухой массы алейроновых зерен приходится 60–80 % общего белка семени.
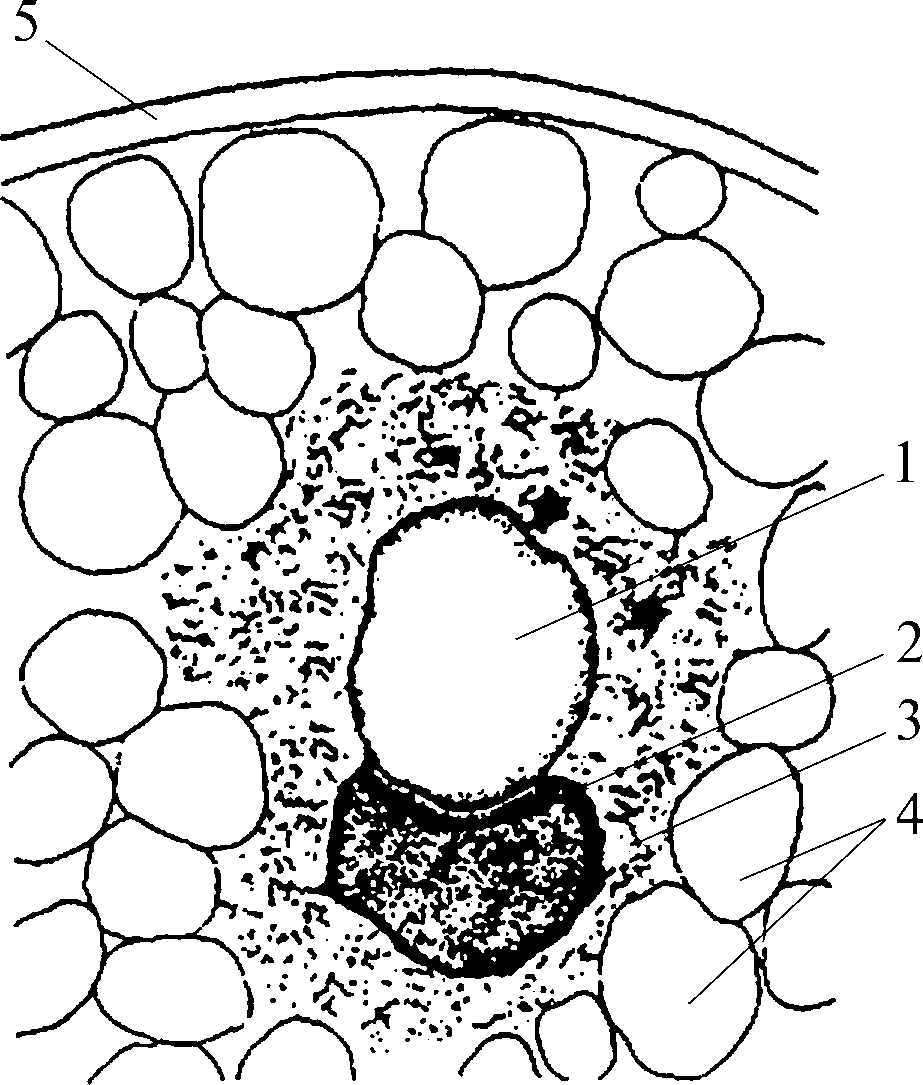
Рис. 15. Схема строения сложного алейронового зерна клетки масличного растения: 1 — глобоид; 2 — белковый кристаллоид; 3 — аморфная белковая зона; 4 — липидные капли; 5 — клеточная оболочка
Содержание белков в семенах масличных культур составляет 14–37 % на сухое вещество. В семенах подсолнечника белок содержится в количестве 15 %, в ядре — 16–19 %, семенах арахиса — 20–37 %, конопли — 20–22 %, рапсе — 25–26 %, в ядрах клещевины — 18–20 %, в ядрах хлопчатника — 34–37 %. В белках семян масличных культур содержится 10–30 % альбуминов и до 90 % глобулинов. Белки алейроновых зерен (алейрины) представлены в основном глобулинами (80–97 %) и незначительным количеством альбуминов и глютелинов (1–2 %). Проламины в алейроновых зернах практически отсутствуют. Кристаллоид масличных культур (конопли — эдестин, клещевины, хлопчатника, мака) представляет собой также глобулины с молекулярной массой от 15 до 300 кД и выше. В небольших количествах в нем присутствуют минорные компоненты с молекулярной массой около 600 кД. Глобулины, как и альбумины, являются смесью индивидуальных белков. В табл. 9 приведены состав и молекулярные характеристики фракций глобулинов. 7S фракция глобулинов масличных семян, как и у бобовых, называется вицилином, 11S — легумином. Все фракции отличаются друг от друга по аминокислотному составу и соотношению кислых и основных субъединиц.
Аморфная зона алейроновых зерен является более гетерогенной по компонентному составу, чем кристаллоид. В составе этой зоны найдены гликопротеиды и белки с сильно выраженными основными свойствами, способные к образованию ионного комплекса с фитиновой кислотой. Физиологическая роль фитин-белковых комплексов и гликопротеидов на сегодняшний день до конца не ясна. Предполагают, что оба вида белковых образований легко мобилизуются в начале прорастания семян. Токсичный белок клещевины рицин также располагается в аморфной зоне алейроновых зерен.
Таблица 9. Характеристика белковых компонентов масличных культур
| Kультура | Kоэффициент седиментации S20, w | Молекулярная масса белка, кД | Содержание белка, % |
| Подсолнечник | 15 | 600 | 11 |
| 2 | 20—50 | 22 | |
| 11 | 340 | 54 | |
| Рапс | 2 | 50—75 | 40 |
| 12 | 150—350 | 40 | |
| Хлопчатник | 2 | 15—50 | 25 |
| 7 | 140 | 45 | |
| 12 | 180—200 | 20 | |
| Арахис | 2 | 20—50 | 5—8 |
| 8 | 142—190 | 30 | |
| 13 | 330 | 35 |
Белки кристаллоида являются долговременной формой запаса, при прорастании семян они распадаются позже, чем белки аморфной зоны. В простых алейроновых зернах основные запасные белки также являются глобулинами, о чем свидетельствует их незначительная электрофоретическая гетерогенность и низкая ферментативная активность. Выяснение вопроса ферментативной активности семян имеет большое значение для понимания физиологической роли алейроновых зерен, чтобы ответить, являются ли они инертными хранилищами белка или представляют собой структуры лизосомного типа*.
* Лизосомы — мелкие округлые тельца, содержащие ферменты и участвующие во внутриклеточных процессах переваривания белков, липидов и нуклеиновых кислот.
В алейроновых зернах семян арахиса, клещевины и других культур присутствуют фосфатазы, протеиназы, амилазы, липазы, при этом в сложных алейроновых зернах ферменты локализованы в аморфной зоне. Эти данные, в соответствии с представлениями В. Л. Кретовича, свидетельствуют об отсутствии метаболической инертности запасных белков. Проверка данного положения требует дальнейших исследований.
С вопросом возникновения и формирования алейроновых зерен тесно связан механизм отложения в запас белков в клетках семени. Полагают, что на первом этапе образования алейроновых зерен в вакуолях эндосперма появляются характерные структуры (полисомподобные частицы), на втором — образуется глобоид с отложением фитина внутри и «обрастанием» белком снаружи, на третьем — формируется кристаллоид. Таким образом, белки алейроновых зерен масличных культур представляют собой сложную гетерогенную систему, которая включает в себя как собственно запасные белки, так и некоторые гидролитические ферменты, участвующие, по-видимому, в гидролизе запасного белка и фитина при прорастании семян. Механизм отложения про запас белков при образовании алейроновых зерен разных типов различен, но в любом случае в процессе участвуют структурные элементы самих алейроновых зерен.
В настоящее время существует реальная возможность получения из масличного сырья концентрированных форм белка и создание на их основе новых форм белковой пищи. Целесообразность решения данной проблемы обусловлена высокой массовой долей белка и ценным аминокислотным составом сырья. Отличительной особенностью белков является высокое количество триптофана, тирозина, фенилаланина, а для белков рапса, подсолнечника, льна — дополнительно и серосодержащих аминокислот и треонина (табл. 10). Белки данных культур наиболее ценные в биологическом отношении.
Таблица 10. Состав незаменимых аминокислот важнейших масличных семян (в мг на 1 г белка)
| Незаменимые аминокислоты | Подсолнечник | Арахис | Рапс (высокоэруковый) | Кунжут | Хлопчатник | Лен |
| Валин | 52 | 50 | 52 | 46 | 45 | 52 |
| Изолейцин | 37 | 36 | 40 | 40 | 35 | 40 |
| Лейцин | 67 | 70 | 74 | 69 | 57 | 70 |
| Лизин | 38 | 37 | 60 | 28 | 41 | 25 |
| Треонин | 47 | 30 | 42 | 40 | 39 | 51 |
| Метионин + цистеин | 42 | 25 | 51 | 45 | 25 | 42 |
| Фенилаланин + тирозин | 80 | 95 | 86 | 83 | 83 | 46 |
| Триптофан | 17 | 11 | 18 | 15 | 10 | — |
Большой практический интерес представляют изменения белковых веществ масличных культур при подготовке семян к переработке и извлечению масел на масложировых предприятиях (сушка, хранение, обрушивание, влаготепловая обработка, прессование, экстракция) и при получении белковых концентратов и изолятов. Наиболее глубоко эти процессы изучены для подсолнечника. Уже на первых этапах сушки начинаются денатурационные изменения белков, которые приводят к снижению их биологической и пищевой ценности. При повышении температуры до 60–90 °С резко снижается вязкость и степень гидролиза суммарного белка протеазами, так как изменившаяся структура под действием тепла делает недоступными пептидные связи, на которые направлено действие этих ферментов.
Изменения структуры белковых молекул при влажно-тепловой обработке, измельчении семян, просеивании и экстракции вызывают изменения во фракционном составе белков. Количество альбуминов в шроте снижается в два раза, соответственно увеличивается доля глютелинов. Повышение температуры снижает содержание лизина, метионина в глютелиновой фракции белка на 15–30 % в зависимости от вида сырья и технологических режимов, включая приемы, направленные на исключение присутствия нежелательных компонентов в шроте (госсипол хлопчатника, хлорогеновая, кофейная кислоты подсолнечника). Денатурационные изменения в процессе влаготепловой обработки на этапах подготовки семян при извлечении масел приводят к уменьшению количества электрофоретических компонентов с высокой подвижностью и низкой молекулярной массой.
В масличных семенах и шротах содержатся антипитательные вещества белковой природы, которые понижают пищевую ценность концентратов, изолятов или кормовую ценность, если сырье используется в качестве корма для животных. К ним относятся ингибиторы трипсина арахиса, рицин клещевины, протеазы, уреаза и липоксигеназа. Рицин, как и соин, вызывает гемагглютинацию крови; содержание его в семенах зависит от сорта клещевины. Инактивация токсичных компонентов белковой природы достигается применением влаготепловой обработки.
Белки масличных культур в процессе переработки сырья при повышенных температурах в нейтральных и слабощелочных средах способны к взаимодействию с другими компонентами, например с полифенольными соединениями. В процессах экстракции белка при получении концентратов и изолятов хлорогеновая и кофейная кислоты подсолнечника и госсипол хлопчатника окисляются в орто-фенолы, которые, полимеризуясь, образуют коричневые пигменты.
Полифенольные соединения взаимодействуют с белком при помощи водородных и ковалентных связей при участии остатков лизина, триптофана и серосодержащих аминокислот. В результате белковые продукты окрашиваются в зеленовато-коричневый цвет, их биологическая ценность снижается, функциональные и органолептические свойства изменяются.
Белки картофеля, овощей и плодов
Относительно низкое содержание азотистых веществ в картофеле (около 2 %), овощах (1,0–2,0 %) и плодах (0,4–1,0 %) свидетельствует о том, что данные виды пищевого растительного сырья не играют значительной роли в обеспечении белком продуктов питания (табл. 11). Исключение составляет картофель, который, несмотря на невысокое содержание белка, как источник азотистых соединений, имеет более существенное значение. Если учесть, что потребление картофеля в среднем составляет 330 г в день, то с данным видом продукта удовлетворяется 6–8 % общей суточной потребности человека в белке.
Таблица 11. Содержание белка в овощах и плодах (в% на сухую массу)
| Kапуста белокочанная | Морковь | Лук | Баклажаны | Свекла | Огурцы | Арбуз | Абрикос | Яблоки |
| 1,8 | 1,3 | 1,4 | 1,2 | 1,5 | 0,8 | 0,7 | 0,9 | 0,4 |
Количество белкового азота в клубнях картофеля в 1,5–2,5 раза больше, чем небелкового, тогда как в овощах и плодах, наоборот — менее 50 % (например, в капусте 40 %, винограде 7 %). Небелковый азот картофеля представлен аминным (67–130 мг%) и нитратным азотом с аммиаком, которые от общего азота в клубнях составляют 18–31 и 10–15 % соответственно. Сорта картофеля в большей степени отличаются по содержанию небелкового азота, чем белкового, и прежде всего по количеству свободных аминокислот. Среди них преобладают аланин, лизин, гистидин, глутаминовая кислота и фенилаланин.
Белки картофеля являются биологически ценными белками, так как содержат все незаменимые аминокислоты. По отношению к белкам куриного яйца биологическая ценность белков картофеля равна 85 %, по отношению к идеальному белку — 70 %. Первыми лимитирующими аминокислотами белков картофеля являются метионин и цистеин, второй — лейцин.
Белки картофеля отличаются по растворимости и электрофоретическому компонентному составу. Бо´льшая часть белков картофеля (70 %) представлена глобулинами, меньшая (30 %) — альбуминами. Различия в электрофоретической гомогенности суммарных белков являются признаком сорта и используются в селекционной практике при выведении новых сортов картофеля с высокой урожайностью, устойчивостью к болезням и вредителям.
Среди овощных культур большим содержанием белка отличаются зеленый горошек (28,3–31,9 %) и сахарная кукуруза (10,4–14,9 % в расчете на сухой вес).
Основную долю в зеленом горошке составляют глобулины (вицилин, легулин) и альбумины, в кукурузе — спирторастворимый зеин. У зеленого горошка содержание альбуминов в 2–3 раза выше, чем в зрелом горохе гладкозерных сортов.
В процессе созревания горошка накопление белков сопровождается интенсивным снижением экстрактивного азота.
В молочно-восковой стадии спелости в горошке содержится в 2,5– 3 раза меньше глютелинов, чем при полной зрелости, количество более подвижного вицилина преобладает над легулином. К концу созревания, наоборот, количество вицилина снижается, а легулина увеличивается.
По сравнению с зерновой кукурузой овощная кукуруза содержит значительно больше альбуминов, глобулинов и меньше щелочерастворимых белков. Содержание зеина составляет 21,1–37,2 % от общего белка, что значительно меньше, чем в кукурузе других ботанических групп (41–58 %).
Особенность фракционного состава зеленого горошка и кукурузы благоприятно отражается на их аминокислотном составе. Значительную долю аминокислот горошка составляют лейцин с изолейцином (15,4 % от общего количества), фенилаланин (7,1 %), валин с метионином (5,2 %), аргинин (10,5 %) и треонин (5,2 %).
Для белков сахарной кукурузы также характерно высокое содержание лейцина и изолейцина — 15,1 %, аргинина 12,4 %, глутаминовой кислоты 17,3 %, аланина, глицина, серина 9,0 %, гистидина 4,2 %, лизина 1,1 %. Высокое содержание в зеленом горошке и сахарной кукурузе лизина и аргинина объясняется повышенным количеством альбуминов, а в зерновой кукурузе — и пониженным содержанием неполноценного зеина.
При различных температурных воздействиях белки обеих культур ведут себя по-разному. Нагрев зеленого горошка в течение 1 мин в воде при 98–100 °С уменьшает растворимость глобулинов на 80 %, альбуминов — на 24 % и увеличивает количество щелочерастворимой фракции на 61 %. Замораживание при температуре –30…–196 °С не оказывает существенного влияния на растворимость и компонентный состав белков. В процессе длительного хранения замороженного, но предварительно прогретого горошка изменяется фракционный состав и происходит денатурация белков.
Состав азотистых веществ и изменение его при хранении и переработке представляет определенный интерес у перца и баклажан. Зрелые баклажаны обладают бол´ ьшим содержанием белковых веществ, чем перец (1,55 и 0,76 % соответственно), и более высоким уровнем отношения белковый : небелковый азот — 0,94 : 0,89. Более высокая способность баклажан к биосинтезу азотистых соединений подтверждается более высоким содержанием у них ДНК, РНК, фосфора и серы (в мг/г сухого вещества):
Баклажаны более устойчивы к увяданию по сравнению с перцем, что связывают с бо´льшим накоплением в них белковых веществ.
Азотистые вещества картофеля, овощей и плодов имеют существенное значение для формирования их питательных и органолептических свойств (вкус, аромат, цвет, консистенция), стойкости при хранении и сохранности витаминов. Так, свободные аминокислоты принимают участие в реакциях, связанных с образованием аромата (реакции Майяра), нитраты в избыточных количествах ухудшают стойкость при хранении, а действие, например, пектолитических ферментов к концу созревания плодов обусловливает их размягчение. Некоторые азотистые соединения выполняют роль ингибиторов протеаз и амилаз.
Ферменты, являясь белками, оказывают значительное влияние на потребительские свойства пищевых продуктов и полуфабрикатов. В процессах созревания и дыхания при хранении и переработке сочного сырья большую роль играют оксидоредуктазы и гидролазы (см. гл. 8). Сохранность овощей и плодов в процессе хранения прежде всего зависит от активности анаэробных дегидрогеназ (алкогольдегидрогеназа, дегидрогеназа яблочной, янтарной, лимонной кислот) и кислородактивирующих оксидоредуктаз.
Способы хранения плодов и овощей предусматривают подавление активности указанных ферментов путем исключения доступа кислорода, понижения температуры и другими приемами. Нежелательным процессом при хранении являются реакции окисления ненасыщенных жирных кислот, L-молочной кислоты, аскорбиновой кислоты, лизина, фенолов, которые протекают с участием соответственно липоксигеназы, лактатоксидазы, аскорбатоксидазы, лизинооксигеназы, о-дифенолоксидазы. Гидропероксиды, образующиеся в результате действия, например, липоксигеназы самостоятельно осуществляют окисление фенолов, а образующиеся при этом хиноны участвуют в процессах распада аскорбиновой кислоты, аминокислот, взаимодействуют с белками и углеводами и вызывают тем самым ухудшение органолептических (потемнение, вкус, запах), технологических (набухание, размягчение) свойств, а также потерю пищевой и биологической ценности (деструкция незаменимых аминокислот, жирных кислот, витаминов, снижение усвояемости, перевариваемости). Из гидролаз в овощах, плодах и картофеле обнаружены β-глюкозидаза, β-фруктофуранозидаза, полигалактуроназа, пектинлиаза, пектатлиаза,
протеолитические и другие ферменты. Инактивация ферментов в результате тепловой обработки при консервировании, сушке и получении натуральных соков из плодов, овощей и ягод предотвращает порчу, сохраняет цвет, вкус и аромат сочного сырья.
В клубнях картофеля, семенах японской редиски, корнях турнепса, зеленом горошке, томатах содержатся белки-ингибиторы животных протеиназ, в первую очередь трипсина и химотрипсина. По содержанию ингибиторов сочное растительное сырье занимает третье место после бобовых и злаковых. Наиболее хорошо изучены ингибиторы ферментов клубней картофеля. Ингибитор химотрипсина картофеля относится к «аргининовому» типу, то есть в участке, который вступает во взаимодействие с активным центром фермента, содержится аргинин. Помимо ингибиторов трипсина и химотрипсина, в картофеле обнаружены полипептиды, действующие как ингибиторы карбоксипептидаз А и Б.
Белки мяса и молока
Мясо, молоко, мясные и молочные продукты содержат необходимые организму белки, которые сбалансированы и хорошо усваиваются.
Содержание белка в мясных продуктах колеблется от 11 до 22 %. Различают белки мышечной, соединительной и хрящевой тканей. Белки мышечной ткани мяса животных полноценные; по сбалансированности белки соединительной ткани и хрящей являются неполноценными. В организме человека и животных белки мышц выполняют сократительную функцию, белки соединительной ткани и хрящей — структурную. Функции всех этих видов белков основаны на их фибриллярной природе.
Главными мышечными белками являются миозин и актин, молекулярная функция которых заключается в обеспечении механизма мышечного сокращения и расслабления при участии АТФ. Миозин по массе составляет 55 % мышечного белка и представляет собой гексамер с молекулярной массой 460 кД. Гексамер включает фибриллярную часть (две переплетенные α-спирали с молекулярной массой 200 кД, заканчивающиеся глобулярными «головками»), тяжелые цепи и две пары легких цепей (молекулярная масса 15–27 кД). Миозин обладает АТФ-гидролизующей активностью и способностью связываться с нерастворимым F-актином. Актин — это мономерный глобулярный белок с молекулярной массой 43 кД (G-актин), на долю которого приходится 25 % общей массы мышечного белка. В присутствии магния G-актин подвергается нековалентной полимеризации с образованием двойной спиральной цепочки, получившей название F-актина. Мышечное сокращение заключается в повторяющихся присоединениях и отделениях глобулярной «головки» миозина от нити F-актина. Гидролиз АТФ запускает цикл ассоциации и диссоциации актина и миозина в пяти реакциях данного процесса (рис. 16).
Сущность же процесса расслабления мышцы заключается в отделении миозиновой (АТФ) головки от F-актина.
В мышечных клетках содержится глобулярный водорастворимый хромопротеид миоглобин, имеющий в качестве простетической группы гем-циклический тетрапиррол, присутствием которого объясняется красный цвет этого белка. Тетрапирролы состоят из остатков четырех молекул пиррола, связанных четырьмя α-метиновыми мостиками с образованием плоской кольцевой структуры. В центре плоского кольца находится один атом железа в ферро-состоянии (Fe2+), окисление которого приводит к потере биологической активности миоглобина.
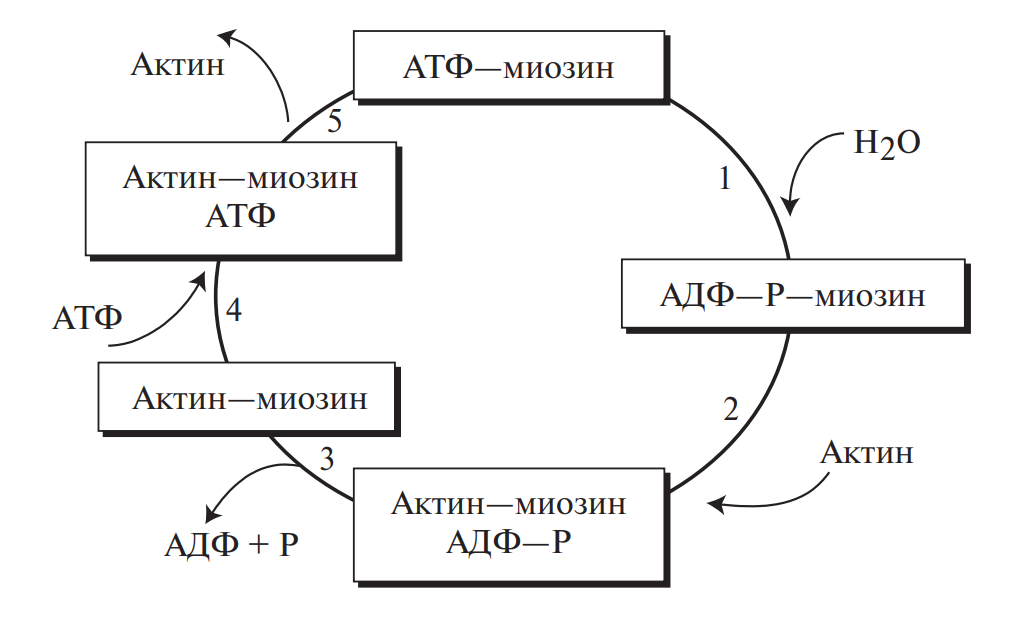
Рис. 16. Цикл мышечного сокращения
Биологическая функция миоглобина заключается не в транспортировании кислорода, как у гемоглобина, а в его запасании. В условиях кислородного голодания (например, при физической нагрузке) кислород высвобождается из комплекса с миоглобином и поступает в митохондрии мышечных клеток, где осуществляется синтез АТФ в процессе окислительного фосфорилирования.
На примере миоглобина хорошо изучена взаимосвязь функции глобулярного белка и его структуры. Миоглобин состоит из одной полипептидной цепи с молекулярной массой 17 кД, включающей 153 остатка аминокислот. Примерно 75 % остатков образуют восемь правых α-спиралей, уложенных в компактную сферическую молекулу. В местах изгиба полипептидной цепи расположены остатки пролина, серина, треонина, которые не способны к образованию α-спирали. На поверхности молекулы находятся полярные остатки, а внутри — неполярные, если не считать двух остатков гистидина, принимающих участие в связывании кислорода. Присоединение кислорода к миоглобину сопровождается смещением атома железа, а вместе с ним гистидина и других остатков аминокислот, ковалентно связанных, в направлении плоскости гемового кольца; в результате данная область белковой молекулы принимает новую конформацию.
Миоглобин (Mb), не связанный с кислородом, называют дезоксимиоглобином, оксигемированный Mb называют оксимиоглобином (MbO2).
Окраска мясопродуктов зависит от содержания миоглобина, состояния гема и белковой части макроглобулы. Окисление Fe2+ в миоглобине до Fe3+ приводит к изменению окраски пигмента от ярко-красного до темно-коричневого, так как образующийся метмиоглобин (MetMb) теряет способность связывать молекулярный кислород. Тепловая денатурация глобина также приводит к потере способности гемового пигмента связывать кислород и ухудшает цвет изделий.
Кислород миоглобина может замещаться такими лигандами, как оксид азота, оксид углерода и другие, поэтому данное свойство белка мышечной ткани мяса используется для получения интенсивной окраски мясопродуктов с применением нитритов. NO, вступая в реакцию с миоглобином, образует нитрозомиоглобин, который при нагревании переходит в устойчивый пигмент красного цвета нитрозомиохромоген:
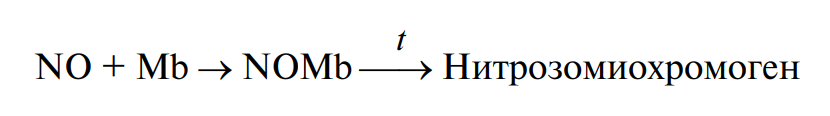
Миоглобин и его производные имеют разные спектральные характеристики, поэтому для их идентификации при оценке качества мяса применяют спектрофотометрические методы анализа.
Наиболее распространенным белком в животном мире является коллаген — главная макромолекула кожи, сухожилий, кровеносных сосудов, костей, роговицы глаза и хрящей. Он обеспечивает внеклеточную структуру в соединительной животной ткани, существуя не менее чем в пяти различных типах. Главной особенностью коллагеновых молекул является трехспиральная структура, каждая α-цепь (субъединица) которой представляет левозакрученную спираль. В спирали на каждый виток приходится по три аминокислотных остатка. Три левые α-спирали закручиваются в правые суперспирали, которые объединяются в фибриллы.
Еще одной характерной особенностью молекулы коллагена является наличие в ее составе в качестве третьего остатка тройной спирали α-цепи глицина. Повторяющуюся структуру можно представить как Гли–X–Y, где Х, Y — другие аминокислоты. Около 100 X- и 100 Y-положений в коллагене занято пролином и 4-гидроксипролином соответственно (см. п. 3). В некоторых Х-положениях содержится 3-гидроксипролин, а в Y-положениях — 5-гидроксилизин. Остатки «жестких» аминокислот увеличивают стабильность тройной спирали. По количеству оксипролина определяют степень развариваемости коллагена при оценке качества мяса.
Коллаген — внеклеточный белок, но он синтезируется внутри клетки в виде молекул-предшественников, проходя через эндоплазматический ретикулум и комплекс Гольджи. В результате процесса посттрансляционной модификации тройная спираль коллагена стабилизируется меж- и внутрицепочечными дисульфидными связями, О-гликозидными связями между остатками сахаридов и гидроксилизина, а также перекрестным связыванием цепей и спиральных молекул фибрилл через Шиффовы основания (см. гл. 3) и альдольную конденсацию.
Близкий по свойствам к коллагену, в эластичных фибриллах соединительной ткани обнаружен белок эластин, содержащийся в связках и стенках кровеносных сосудов. Этот белок богат глицином, аланином и лизином, но беден пролином. Отличительной особенностью эластина является наличие в его структуре поперечных связей необычного характера. Альдегидные группы, возникшие в результате окисления аминогрупп боковых цепей остатков лизина и оксилизина, взаимодействуют с аминогруппой лизина в реакциях альдольной конденсации, дегидратации и окисления, образуя десмозин и изодесмозин. Все четыре аминогруппы и карбоксильные группы участвуют в образовании пептидных связей.
Мясо, содержащее много соединительной ткани, и после тепловой обработки остается жестким; усвояемость коллагена и эластина очень низкая. Однако для усиления двигательной функции кишечника в рацион иногда целесообразно включать продукты, богатые соединительной тканью. В диетах щадящего режима применяют желатин — продукт неполного гидролиза коллагена. По аминокислотному составу желатин неполноценен, но продукты, приготовленные из него, перевариваются без напряжения секреции пищеварительных органов.
Молоко — это гетерогенная система, в которой в качестве дисперсной фазы выступают эмульгированные жировые глобулы и коллоидные мицеллы казеина, а дисперсионной средой служит раствор белков, лактозы, солей и витаминов. Общее содержание белков в молоке колеблется от 2,9 до 3,5 %. Среди них выделяются две основные группы: казеины и сывороточные белки (табл. 12). В молоке содержится более 20 ферментов (ксантиноксидаза, пероксидаза, каталаза, липаза, холинэстераза, α-амилаза, лизоцим, протеаза и др.), а также гормоны (пролактин, окситоцин, кортикостероиды, тироксин, трийодтиронин и др.) и белки в составе оболочек жировых шариков.
Таблица 12. Состав и молекулярные характеристики белковых компонентов молока
| Kомпоненты | Содержание | Молекулярная масса, кД | ИЭТ
(изоэлектрическая точка) |
|
| В % от общих белков | в г/л | |||
| Kазеин:
αS1 -казеин αS2 -казеин -казеин -казеин Белки сыворотки: α-лактоглобулин β-лактальбумин иммуноглобулины альбумин сыворотки крови |
78–85 | … | — | — |
| } 43–54 | 12–15
3–4 |
23,0
25,0 |
4,4–4,8
— |
|
| 25–35 | 9–11 | 24,0 | 4,8–5,1 | |
| 8–15 | 2–4 | 19,0 | 5,4–5,8 | |
| 15–25 | 6–8 | — | — | |
| 7–12 | 3,6 | 18,3 | 5,1 | |
| 2–5 | 1,7 | 14,2 | 4,2–4,5 | |
| 1,5–2,5 | 0,6 | 150–1000 | 5,5–8,3 | |
| 0,7–1,3 | 0,4 | 69,0 | 4,7–4,9 | |
Основными белками молока являются казеины, которые легко перевариваются и являются источниками незаменимых аминокислот, кальция, фосфора и ряда физиологически активных пептидов.
Так, в желудке при действии фермента химозина на -казеин высвобождаются глико- и фосфопептиды, которые регулируют секрецию желудочного сока, моделируют физико-химические свойства белков (растворимость, вязкость, заряд, денатурацию), защищают от протеолиза и влияют на проницаемость мембран клеток.
Важнейшими физиологическими функциями обладают и сывороточные белки. Иммуноглобулины выполняют защитную функцию, лактоферрин и лизоцим (фермент) являются носителями антибактериальных свойств, а лактоферрин и β-лактоглобулин выполняют транспортную роль, перенося в кишечник микро- и макроэлементы, витамины, липиды. α-Лактальбумин необходим для синтеза в молоке лактозы из УДФ-галактозы и глюкозы. Для большинства компонентов казеина, α-лактальбумина, β-лактоглобулина и компонентов протеозо-пептонной фракции расшифрованы первичная структура и некоторые фрагменты вторичной, третичной и четвертичной структур. Молекулы казеина имеют небольшое количество (1–6 %) α-спиралей, тогда как, например, α-лактальбумин состоит из 26 % α-спирали, β-конформации, остальное же количество белка представляет собой неупорядоченную структурную организацию.
При образовании четвертичной структуры казеина бо´льшая роль отводится гидрофобным взаимодействиям и фосфаткальциевым мостикам, меньшая — электростатическим и водородным связям. Фосфаткальциевые мостики являются основой казеинаткальцийфосфатного комплекса, в виде которого казеин присутствует в молоке:
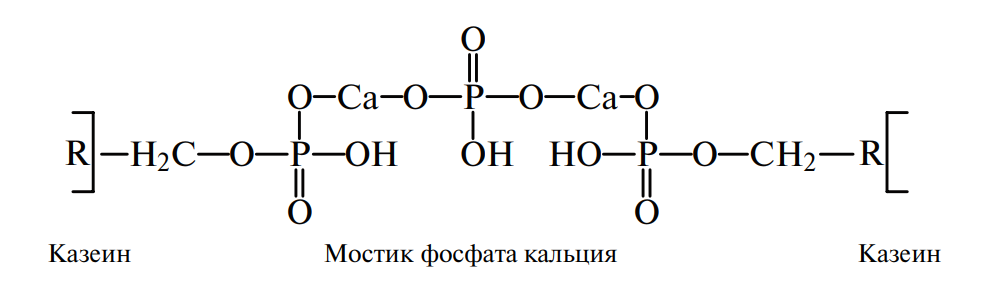
Кальций в составе комплекса выполняет роль структурообразователя, образуя мостик между серинили треонинфосфатными группами двух молекул казеина, а остатки фосфорной кислоты усиливают кислые свойства белка, обусловленные присутствием β- и γ-карбоксильных групп аспарагиновой и глутаминовой кислот.
Казеин из молока осаждается при рН 4,6–4,7, так как на его молекулах при такой реакции среды устанавливается равенство положительных и отрицательных зарядов. Осажденный казеин практически не растворяется в воде, растворяясь в слабощелочной среде солей щелочных металлов и минеральных кислот.
Нерастворимый казеин обладает способностью связывать воду в достаточно больших количествах (более 2 г на 1 г белка), что очень важно для устойчивости частиц белка в сыром, пастеризованном или стерилизованном молоке. Гидрофильные свойства казеина усиливаются под действием β-лактоглобулина в процессе тепловой обработки молока, и от них зависят структурно-механические свойства сгустков, образующихся при кислотном сбраживании и получении сырной массы при созревании сыров.
В промышленности казеины получают из обезжиренного молока действием кислот, сыворотки, введением солей кальция, натриевых, калиевых щелочей, химозина и других ферментов. В зависимости от способа получения различают казеинат натрия, казеинат кальция, кислотный, сычужный казеин и копреципитаты. Для регулирования функциональных свойств белковых продуктов используют неполный ферментативный гидролиз, смешение с растительными белками и их совместную сушку.
При производстве новых форм белковой пищи на основе белков молока (аналоги мясных, рыбных продуктов) большое значение имеет гелеобразование, взаимодействие казеина с веществами небелковой природы, образование стойких эмульсий и явление синерезиса.
Белки молока характеризуются высокой биологической ценностью, они содержат в избыточных количествах лизин и триптофан с одновременным незначительным недостатком серосодержащих аминокислот (см. п. 4). Биологическая ценность белков сыворотки выше, чем казеина, так как они содержат в больших количествах такие незаменимые аминокислоты, как лизин, треонин, триптофан, метионин, цистеин.
На долю сывороточных белков в составе молока приходится 0,5–0,8 % от общего их количества. β-Лактоглобулин устойчив в кислой среде желудка к действию пепсина, поэтому расщепляется только в кишечнике трипсином и химотрипсином. В процессе пастеризации молока белок денатурируется, образуются комплексы с -казеином, которые осаждаются вместе с ним при кислотной и сычужной коагуляции. Податливость комплексов действию сычужного фермента понижается. α-Лактальбумин не осаждается в изоэлектрической точке (рН 4,6), не свертывается под действием сычужного фермента; он термостабилен в силу большого количества дисульфидных связей.
Иммуноглобулины по химической природе являются гликопротеидами; они вызывают агглютинацию микроорганизмов и других чужеродных клеток. Выделены три основные группы иммуноглобулинов: G, A и М; среди них имеются мономеры и полимеры, состоящие из тяжелых и легких полипептидных цепей с молекулярной массой 50 и 25 кД соответственно.
Различают два основных типа молочной сыворотки: сладкую и кислую. Сладкая сыворотка образуется при производстве сыров, кислая — при осаждении творога и казеинов. Молочную сыворотку для применения в хлебопекарной, кондитерской промышленности, производства смесей для детского питания концентрируют сушкой, ультрафильтрацией, электродиализом и осаждением белка в виде комплексов с полиэлектролитами.
Для получения изолятов, концентратов и копреципитатов применяют тепловую денатурацию с последующим осаждением белка в ИЭТ (рН 4,5–4,6) и комплексообразование с анионными полисахаридами (полифосфаты, карбоксиметилцеллюлоза — КМЦ, альгинаты, пектины). Эти способы позволяют выделять до 70–90 % полноценного белка молочной сыворотки и варьировать его функциональные свойства.
7. Новые формы белковой пищи. Проблема обогащения белков лимитирующими аминокислотами
Основным направлением научно-технического прогресса в области производства продовольствия является интенсификация процессов приготовления пищи с приданием ей комплекса свойств, отражающих требования науки о здоровом питании. Новые пищевые производства в качестве приоритетных направлений включают технологии производства белковых продуктов, основывающиеся на фундаментальных и прикладных знаниях в области пищевой, физической, биологической, биоорганической химии, генетики, молекулярной биологии, биофизики и специальных дисциплин. Объективными причинами создания принципиально новых технологий получения белковых компонентов пищи являются: рост численности населения; осознание людьми того, что ресурсы планеты не безграничны; необходимость выпуска пищевых продуктов с составом, соответствующим современному образу жизни; возможность использования накопленных человеком теоретических знаний в прикладных целях.
Отличительной особенностью технологий производства белковых продуктов является комплексная переработка сырья с одновременным получением вторичных ингредиентов (крахмал, масло, пектин, фосфатиды и т. д.), целенаправленным выделением и использованием отдельных фракций белков.
Новые формы белковой пищи — это продукты питания, получаемые на основе белковых фракций с применением научно обоснованных способов переработки сырья. Белковая пища имеет определенный химический состав, структуру, свойства и биологическую ценность.
Объективной оценкой создания и развития отрасли производства растительных белковых продуктов (фракций) является наличие сельскохозяйственного сырья, оборудования (экстракторы, сепараторы, центрифуги, сушилки и т. д.) и конкурентоспособных технологий. К потенциальным источникам сырья относятся:
- зернобобовые (соя, горох, чечевица, люпин, фасоль, нут);
- хлебные, крупяные культуры (пшеница, тритикале, рожь, овес, ячмень, кукуруза), побочные продукты их переработки (отруби, сечка, мучка, зародыш);
- масличные (подсолнечник, лен, рапс, кунжут);
- псевдозлаковые (амарант);
- овощи, бахчевые (картофель, тыква);
- вегетативная масса растений (люцерна, клевер, люпин, сахарная свекла, зеленый табак);
- продукты переработки фруктов, ягод (косточки абрикоса, сливы, вишни, кизила, винограда и т. д.);
- кедровые и другие виды орехов.
К важнейшим факторам выбора сырья относятся: количество, состав и биологическая ценность белка; возможность удаления антипитательных веществ и получения побочных продуктов (жир, крахмал, пектин, сорбит, ксилит, лецитин, антоцианы, витамины, глюкозно-фруктозные сиропы и т. д.); высокие функциональные свойства и способность к хранению.
Традиционными источниками для производства белковых продуктов являются соя и пшеница, все остальные виды сырья относят к нетрадиционным.
Продукты из соевых белков подразделяются на три группы, отличающиеся по содержанию белка: мука-крупа, концентраты, изоляты. На базе указанных видов белковых продуктов организуется производство текстурированной муки, концентратов и изолятов, выпускаются модифицированные и специальные белковые продукты.
Соевая мука и крупа производятся на мельничном оборудовании путем измельчения до определенного размера частиц обезжиренных или необезжиренных семян с последующим их просеиванием. В муке и крупе содержится 40–54 % (N 6,25, см. с. 125) белка от общей массы продукта. Разные виды муки (крупы) отличаются по содержанию жира, размеру частиц и степени тепловой обработки. От интенсивности теплового воздействия зависят КРА (коэффициент растворимости азота), КДБ (коэффициент диспергируемости белка), активность ферментов липоксигеназы, уреазы и ингибиторов протеаз.
Соевые белковые концентраты изготавливаются из очищенных и обезжиренных соевых бобов (белый лепесток) путем удаления растворимых в воде небелковых компонентов (олигосахариды, ферменты, минеральные вещества). Концентраты содержат 65–70 % белка на сухое вещество (N 6,25). Соевые белковые изоляты являются наиболее очищенной формой белковых продуктов, так как содержат не менее 90 % белка на сухое вещество. Белок экстрагируется из измельченного белого лепестка слабощелочным раствором (рН 8–11) с последующим осаждением в изоэлектрической точке (4,2–4,5) и отделением в виде творожистой массы от олигосахаридов. Белковая масса промывается, нейтрализуется до рН 6,8 и сушится.
Назначение текстурированных белковых продуктов заключается в придании пищевым изделиям волокнистой или многослойной (кускообразной) структуры. После гидратации такие белковые продукты по внешнему виду и структуре напоминают мясо, птицу или морские продукты, выступая при этом в роли аналогов традиционных пищевых продуктов. Многослойная мясоподобная структура соевых белковых продуктов может формироваться с помощью термопластической экструзии.
Основные стадии процесса включают: дозирование сырья → кондиционирование (увлажнение, нагревание) → варочный процесс → ламинарное течение (ориентация молекул белков) → формирование волокон → разрезание продукта на куски → сушка.
В основе экструзии лежит процесс реструктуризации белка, заключающийся в том, что под влиянием температуры, увлажнения и механического воздействия макромолекулы его формируют вязкопластичную массу, выстраивающуюся в направлении сдвига, с образованием новых поперечных связей. В результате образуется многослойная объемная жевательная структура, пригодная для использования в качестве наполнителей или аналогов.
Особые соевые продукты представлены соевым соусом, тофу (соевый творог), соевым молоком, мисо (соевая паста) и другими видами. Модифицированные белки (частично или полностью гидролизованные) получают из белковых продуктов с применением протеолитических ферментных препаратов (пепсин, папаин, бромелаин) или кислотного гидролиза. Такие белки используются как функциональные и вкусовые добавки к пище.
Из пшеницы или пшеничной муки методом водной экстракции небелковых и растворимых белковых компонентов получают сухую пшеничную клейковину. Так как клейковина является скоропортящимся продуктом, то важное место в технологическом процессе производства клейковины занимает сушка. Во-первых, влажность готового продукта не может превышать 10 %, а во-вторых, клейковина должна быть нативной, или «витальной». Первое условие необходимо в целях успешного хранения, второе — для обеспечения использования клейковины в качестве функционального ингредиента. В клейковине содержится белка не менее 75–80 % (N 5,7), жира — 0,5–1,5 %, клетчатки — 1,5 %, зольность — 0,8–1,2 %.
В последние годы внимание многих специалистов обращено к белкам из нетрадиционного сырь я: амаранта, льна, рапса.
Амарант (лат. amara´nthus) — однолетнее растение с мелкими цветками, собранными в густые колосовидно-метельчатые соцветия. Оно превосходит традиционные культуры по урожайности, содержанию белка (табл. 13), незаменимых аминокислот, липидов, витаминов, макро-, микроэлементов.
Таблица 13. Химический состав различных культур (в %)
| Культура | Вода | Белок | Жиры | Углеводы | Клетчатка | Зола |
| Амарант | 12,0 | 17,6 | 7,4 | 54,2 | 6,2 | 2,6 |
| Пшеница | 14,0 | 12,3 | 1,7 | 68,4 | 2,0 | 1,6 |
| Рапс (яровой) | 8,4 | 31,2 | 35,5 | 14,5 | 5,8 | 4,6 |
| Рожь | 14,0 | 11,0 | 1,7 | 69,9 | 1,9 | 1,8 |
| Ячмень | 14,0 | 10,5 | 2,1 | 66,4 | 4,5 | 2,5 |
| Овес | 12,0 | 10,3 | 5,3 | 59,4 | 10,0 | 3,0 |
| Рис | 12,0 | 6,7 | 1,9 | 63,8 | 10,4 | 3,0 |
| Соя | 14,0 | 34,0 | 18,4 | 24,6 | 4,5 | 4,5 |
| Фасоль | 14,0 | 23,2 | 2,1 | 53,8 | 3,6 | 3,3 |
Известно около 900 видов амаранта, большинство из них сорные растения; 12 видов окультурены и используются как овощные, зерновые, кормовые культуры, из них около 10 сортов пригодны для производства пищевых продуктов.
Преимуществом семян амаранта является высокое содержание легкоусвояемого белка (13–20 %) и улучшенный аминокислотный состав (табл. 14). Если оценить идеальный белок в 100 баллов, то казеин имеет 72 балла, соевый белок — 68, белок пшеницы — 58, амаранта — 75 баллов.
Фракционный состав белков амаранта колеблется в зависимости от сорта. Альбумины составляют от 20,7 до 65 %, глобулины — 17–19,2 %, проламины — 2,2–11 %, глютелины — 7–44,4 %. По нашим данным (В. В. Колпакова, И. А. Абрамов, 2011) на долю альбуминов приходится 17,4 %, глобулинов — 25,5 %, проламинов — 2 %, щелочерастворимых белков — 55,1 %. Фракция альбуминов обогащена триптофаном, треонином, лизином; глобулинов — серосодержащими аминокислотами, лизином; проламины, глютелины — треонином, лейцином, триптофаном. Из-за значительного содержания лизина (в 2–3 раза больше, чем у пшеницы, кукурузы) ценность белка данной культуры очень высокая.
Таблица 14. Аминокислотный состав амаранта и полученного из него белкового препарата
| Аминокислота | Семена, мг/100 г | Белковый препарат | ||
| мг/г препарата | мг/г белка | Скор,% | ||
| Валин | 766 | 37,1 | 51,7 | 148 |
| Изолейцин | 696 | 33,2 | 46,3 | 165 |
| Лейцин | 1027 | 54,3 | 75,7 | 115 |
| Лизин | 1340 | 38,5 | 54,3 | 94 |
| Метионин | 626 | 13,5 | 51,7 | — |
| Треонин | 644 | 27,6 | 38,5 | 113 |
| Триптофан | 434 | — | — | — |
| Фенилаланин | 731 | 42,8 | 105,7 | — |
| Тирозин | 626 | 33,0 | 45,8 | — |
| Фенилаланин + тирозин | — | — | — | 240 |
| Аланин | 748 | 31,3 | 43,6 | — |
| Аргинин | 1409 | 75,8 | 105,3 | — |
| Аспаргиновая кислота | 1844 | 68,2 | 94,8 | — |
| Гистидин | 539 | 22,3 | 30,9 | — |
| Глицин | 1305 | 39,9 | 55,4 | — |
| Глутаминовая кислота | 2645 | 128,2 | 178,2 | — |
| Пролин | 853 | 33,3 | 46,3 | — |
| Серин | 1131 | 38,7 | 53,8 | — |
| Цистеин | 35 | 0,09 | 0,12 | — |
| Метионин + цистеин | — | — | — | 207 |
| Белок (N 5,7),% | 17,8 | 71,7 | — | — |
Примечание. Коэффициент пересчета 5,7.
Из амаранта получают цельносмолотую муку с содержанием белка 17–40 %, концентраты, изоляты. Концентраты, изоляты получают из муки с последующим экстрагированием белка раствором щелочи или кислоты, и осаждением его в изоэлектрической точке (рН 4,26). Для повышения выхода белков используют α-амилазу и глюкоамилазу.
Химический состав, например, концентрата (в % на с. в.) следующий: белок — 71,6, липиды — 0,3, крахмал — 25,7, зола — 2,4; минеральные вещества (в мг/100 г): кальций — 4,34; железо — 17,9; калий — 202,6. Продукт имеет хорошую растворимость, пенообразующую, жироэмульгирующую способности.
Перспективными направлениями использования продуктов из амаранта являются хлебобулочные, кондитерские изделия (бисквиты, кексы), макаронные, комбинированные молочные продукты и напитки.
Бо´льшую часть азотсодержащих соединений семян льна составляют белки, на долю которых, в зависимости от сорта, приходится от 81 до 92 %. Небелковые экстрактивные вещества составляют около 8–15 %. Содержание белка в семенах льна в среднем 20–27 %, в льняных жмыхах — от 30 до 37 %.
Последовательной экстракцией соле- и щелочерастворимых белков из жмыха и промывкой их водой получают льняной белковый концентрат или изолят с содержанием белка около 70 и 90 % соответственно (А. Григорьева, 2007). Выход солерастворимой фракции составляет 44,95 %, щелочерастворимой — 22,11 % от общего содержания в сырье.
Методом ИК-спектроскопии установлено, что большинство белков жмыха льна имеют α-свернутую форму, а часть их находится в неупорядоченной конформации. Солевая и щелочная экстракции денатурируют белки, так как разрушаются их третичная и вторичная структуры. Процесс осаждения белков в изоэлектрической точке вызывает образование более жестких, термодинамически менее выгодных β-структур и формирование статистического клубка.
Щелочной белковый концентрат превосходит солевой концентрат по содержанию большинства незаменимых аминокислот (лизин, треонин, валин, метионин, лейцин, изолейцин). Сумма незаменимых аминокислот в первом концентрате составляет 34,5, во втором — 23,6 % от общего содержания в белке.
Первой лимитирующей аминокислотой щелочного белкового концентрата является лизин, второй — треонин. Содержание лизина покрывает 55 % потребности взрослого человека в нем, а треонина — 82 %. Скор валина и изолейцина равен 100 %, а суммы метионина и цистеина — 84 %. Если учесть, что скор лимитирующих аминокислот серосодержащих аминокислот соевой белковой муки равен 66 %, то следует считать, что биологическая ценность льняного белкового концентрата мало уступает биологической ценности соевой белковой муки.
Таким образом, льняные белковые продукты могут найти применение в пищевой промышленности в качестве белкового обогатителя при производстве аналогов мясных продуктов, хлебобулочных, макаронных и других изделий.
Рапс — растение семейства крестноцветных. Он содержит 40–44 % масла, 18–22 % белка, 6–7 % клетчатки. Его семена характеризуются наличием белков с полноценным аминокислотным составом, полиненасыщенных жирных кислот, с преобладанием содержания линолевой (ω-3) и линоленовой кислот, и пищевых волокон. Семена рапса используются в качестве сырья для выработки рапсового масла, остающийся жмых служит источником белковых препаратов для повышения биологической ценности различных пищевых изделий.
Химический состав рапсового жмыха (в %): влага — 26,5–27,5, белок — 37,0–40,0, жир — 7,5–10,0, зола — 0,45–0,7, клетчатка — 10,0– 15,0; витамины (в мг/кг): В1 — 2,34, В2 — 0,84, Е — 32,5; минеральные вещества (в мг/кг): железо — 108,6, магний — 350,2, кальций — 436,7, фосфор — 598,6.
Аминокислотный состав белков жмыха рапса представлен всеми незаменимыми аминокислотами, он хорошо сбалансирован и превосходит подсолнечник по лизину на 30 % и по цистеину в 2,1 раза. Доступность аминокислот для животных составляет 80–100 %.
Доля водо- и солерастворимой фракций составляет 72–79 %, коэффициент переваримости — 71–75 %. Доступность (в %): кальция — 68, фосфора — 75, магния — 62, марганца — 54, меди — 74, цинка — 44.
Жмых содержит также холин, ниацин, фолиевую кислоту, фенольные соединения, таннины и вещества, снижающие его питательную ценность: глюкозинолаты (0,8 %), эруковую и фитиновую кислоты. Глюкозинолаты представлены синигрином, глюконастурином и 5-винил-2-тиооксизолидоном. В современных сортах эруковая кислота замещается на олеиновую и линоленовую кислоты, а глюкозинолаты удаляются специальными технологическими приемами при выделении из них белковых препаратов.
В целом же растительный белок по содержанию незаменимых аминокислот — лизина, треонина и триптофана — уступает животному белку. Поэтому внедряются специальные программы питания, предусматривающие применение растительных белков и лимитирующих аминокислот для взрослого населения, школьников и детей. Оптимальный баланс незаменимых факторов питания при этом обеспечивается путем правильного подбора различных видов белков (эффект взаимного обогащения). Дополнение в пищу, например, сои является прекрасным методом восполнения недостатка лизина в пшенице, кукурузе и рисе. За счет правильного подбора компонентов в смесях из хлебных, бобовых и масличных культур можно значительно повысить КЭБ (коэффициент эффективности белка), за эталон которого принимают показатель для казеина (2,5). Смеси из хлебных культур с соевыми продуктами комплементарны по аминокислотному составу при соотношении 50 : 50, однако идеальным считают соотношение 30 : 70.
В зависимости от соотношения белковых составляющих различают эффект истинного и простого обогащения. Эффект истинного обогащения наблюдается в том случае, если скор для каждой незаменимой аминокислоты в белке создаваемого продукта не менее 1,0, простого — если значения аминокислотного скора композиции хотя и меньше 1,0, но выше, чем показатель для белков каждого продукта в отдельности.
Сбалансированность аминокислотного состава в белковых продуктах положительно отражается на их усвояемости. Усвояемость белков растений по сравнению, например, с казеином составляет 60–80 %, усвояемость концентрированных белковых продуктов, которые содержат больше незаменимых аминокислот, — 80–100 %. Для соевых концентратов, изолятов, молочных белков показатель равен 91–96 %, для белков сухой пшеничной клейковины — 91 %, муки из пшеничных отрубей — 94 %. Усвояемость белков может быть повышена до 97–99 % добавлением лимитирующих аминокислот. Например, добавление 0,5–1,5 % метионина к белковым продуктам из сои приближает их по питательной ценности к идеальному белку, а добавление триптофана вызывает образование в организме человека дополнительных антител и повышает иммунитет. В табл. 15 показано влияние добавок аминокислот на качество зернового корма, оцениваемое по КЭБ.
Таблица 15. Влияние добавок аминокислот на КЭБ зерновых культур
| Зерновая культура | Аминокислота | КЭБ | |
| без добавки | с добавкой | ||
| Пшеница
Рис Кукуруза |
L-лизин (0,2 %)
L-лизин (0,4 %) + DL-треонин (0,3 %) L-лизин (0,02 %) + DL-треонин (0,2 %) DL-лизин (0,4 %) + L-триптофан (0,07 %) |
0,7
0,7 1,5 0,9 |
1,6
2,7 2,6 2,6 |
В производстве продуктов и кормов уже давно применяют добавки лимитирующих аминокислот, производство которых в некоторых странах представляет собой специализированную отрасль. По данным ФАО, более 98 % производства приходится на метионин, лизин, триптофан. Основными методами получения аминокислот являются методы микробиологического (лизин, треонин, валин) и химического (метионин, триптофан, фенилаланин) синтеза, часть дефицитных аминокислот можно получать с применением ферментативных методов (метионин), экстракции (цистеин, тирозин) и генной инженерии (лизин, треонин).
Употребление аминокислот в пищу требует тщательного контроля со стороны медиков и специалистов питания, так как целесообразны специальные приемы их употребления и ввода. Лимитирующие аминокислоты, находясь в составе пищи и не участвуя в полостном пищеварении, либо быстро поступят в кровеносную систему, либо останутся в кишечнике, где под влиянием микрофлоры станут объектом образования токсичных продуктов. Разница во времени поступления в кровь свободных аминокислот и аминокислот, образовавшихся при переваривании белков пищи, будет способствовать протеканию негативных ферментативных превращений — дезаминирования, декарбоксилирования и т. д. Свободные аминокислоты, не принимая участия в синтезе белков организма, могут стать источником токсичных биогенных аминов и аммонийных солей. Наиболее высокой токсичностью обладают продукты дезаминирования триптофана, тирозина, гистидина. Так, гистамин и серотонин, образующиеся при декарбоксилировании соответственно гистидина и триптофана, вызывают аллергию.
Важнейшим приемом повышения пищевой ценности самих белковых препаратов, а через них и продуктов питания, является разработка их новых форм, называемых белковыми композитами и модулями (см. п. 10).
Включение в пищевой рацион растительных белков положительно отражается на здоровье людей. Поставляя организму незаменимые аминокислоты, они являются источником и пищевой клетчатки, способной образовывать комплексы с лечебно-физиологическими функциями воздействия на моторику кишечника и регуляцию уровня холестерина в крови. Растительные белки снижают уровень сывороточных липидов в случае гиперлипидемических состояний (атеросклероз, гипертония, сахарный диабет, желчекаменная болезнь, эндокринные расстройства и др.), в связи с чем интерес к замене животных белков на растительные в последние годы особенно возрастает. Так, доказано, что замена мясных и молочных продуктов в рационе питания больных людей на белковые изоляты из сои понижает уровень общего холестерина в крови и холестерина с липопротеидами низкой плотности (ЛНП).
Таким образом, несмотря на большое количество разработанных технологий белковых препаратов, перспективными направлениями остаются переработка нетрадиционного сырья, фракционирование белков на компоненты с различными молекулярными массами (7S и 11S для белков сои, глиадин, глютенин пшеницы и т. д.), функциональными и фармакологическими свойствами и разработка на белковой основе композитов и модулей различного назначения (см. п. 10).
8. Функциональные свойства белков
Растительные белки находят применение в производстве пищевых продуктов в качестве ингредиентов питательной, технологической и лечебно-профилактической значимости благодаря присущим им уникальным функциональным свойствам. Понятие «функциональные свойства белков» впервые ввели Серкл и Джонсон в 1962 г. Под функциональными свойствами понимают физико-химические характеристики белков, определяющие их поведение при переработке в пищевые продукты и обеспечивающие определенную структуру, технологические и потребительские свойства (В. Толстогузов, 1987).
К наиболее важным функциональным свойствам белков относятся растворимость, водосвязывающая, жиросвязывающая способности, способность стабилизировать дисперсные системы (эмульсии, пены, суспензии) и образовывать гели, пленкообразующая способность, адгезионные, реологические свойства (вязкость, эластичность), способность к прядению и текстурированию.
Белки с высокими функциональными свойствами хорошо растворяются в воде, образуют прочные гели, стабильные эмульсии и пены; белки с низкими функциональными свойствами не набухают в воде, не способны образовывать вязкие, эластичные массы, гели, не стабилизируют пены и эмульсии. Некоторые известные белки не попадают под указанные выше закономерности. Так, белки пшеничной клейковины, несмотря на низкую растворимость в воде (1–2 %), образуют структурные коллоидные системы — гели, которые выдерживают нагревание, замораживание и сушку, а белки из отрубей и тритикале с растворимостью 10–20 % обладают высокими жироэмульгирующими и пенообразующими свойствами.
Отклонения от указанных выше закономерностей можно объяснить трудностью создания стандартных условий при оценке функциональных свойств, так как у белков оптимальные значения их разные, модельные системы не учитывают многофункциональности и взаимодействия белков с другими компонентами пищи (липиды, углеводы и т. д.). Поэтому считается, что функциональные свойства белков должны выражаться не только в численных значениях, но и в профилях зависимостей от технологических факторов. Такой подход в оценке функциональных свойств нашел отражение в применении нового термина — «технофункциональные», включающего особенности технологических процессов при производстве, хранении и потреблении пищевых продуктов. При этом функциональные свойства белков оцениваются путем сравнения их значений со свойствами традиционных или других известных белков.
Растворимост ь, являясь первичным показателем оценки функциональных свойств белков, характеризуется коэффициентами КРА и КДБ. В первом случае определяют количество азота, во втором — количество белка, перешедшего в раствор (в процентах от общего содержания его в продукте). Специфическая последовательность аминокислотных остатков в полипептидных цепях, неравномерное расположение гидрофобных и гидрофильных групп на поверхности белков, наличие или отсутствие спирализованных участков обусловливают особенности
функциональных свойств. Растворимость в наибольшей степени зависит от присутствия нековалентных взаимодействий: гидрофобных, электростатических и водородных связей.
При рассмотрении гидрофобных взаимодействий белков различают среднюю и относительную (поверхностную) гидрофобность. Под средней гидрофобностью понимают энергию стабилизации, приходящуюся на одну неполярную боковую группу при связывании ее внутри глобулы белковой молекулы, под относительной — степень гидрофобного взаимодействия неполярных остатков аминокислот, расположенных на поверхности глобул. Последний вид гидрофобности оценивается по связыванию с липидами и углеводами, распределению белков в двухфазных водных системах, содержащих полимеры с разной гидрофобностью, и т. д. За счет относительной гидрофобности осуществляется взаимодействие с липидами и формируется четвертичная структура белков. Чем ниже относительная гидрофобность белков (то есть ниже взаимодействие между глобулами и выше сила отталкивания), тем выше взаимодействие их с молекулами растворителя, следовательно выше растворимость.
Вклад электростатических сил в растворимость белков зависит от рН среды и присутствия солей. При рН, соответствующем ИЭТ, белки имеют наименьшую растворимость, так как суммарный заряд на их молекулах равен нулю и частицы лишены способности отталкиваться за счет электростатических взаимодействий с молекулами растворителя. В кислой или щелочной среде, наоборот, обеспечивается взаимодействие противоположно заряженных ионов растворителя (Н+ или ОН— соответственно) с поверхностями белковых частиц, заряженных положительно в кислой среде и отрицательно в щелочной, а значит, и переход белков в раствор. В кислой среде белок имеет положительный заряд на аминогруппах вследствие подавления диссоциации карбоксильных (–СООН) групп, в щелочной — отрицательный заряд у карбоксильных групп за счет подавления диссоциации –NН2-групп.
Зависимость растворимости белков от концентрации солей носит нелинейный характер. При добавлении небольших количеств солей растворимость увеличивается, так как ионы препятствуют электростатическому взаимодействию боковых групп белка между собой. Высокие концентрации солей снижают гидратацию полипептидных цепей и, наоборот, усиливают гидрофобные белок-белковые взаимодействия и вызывают выпадение белка в осадок (высаливание).
Использование в качестве растворителей воды, растворов солей, щелочей и спиртов обеспечивает перевод гетерогенных смесей альбуминов, глобулинов, глютелинов, проламинов соответственно в раствор и получение белковых фракций, различающихся по аминокислотному составу, молекулярным массам и функциональным свойствам.
Различия в растворимости белков пищевого сырья лежат в основе технологических процессов получения изолятов, концентратов и влияют на качество пищевых продуктов. Важную роль растворимость белков играет в качестве тех пищевых продуктов, в производстве которых предусмотрены гидролиз (автолиз) и денатурация (начальные стадии, сушка, хранение). Потеря растворимости сопровождается изменением других функциональных свойств, что в значительной мере отражается на потребительских свойствах продуктов и степени перевариваемости белка в желудочно-кишечном тракте.
Особые требования к растворимости белков предъявляются при использовании их в производстве напитков, хлебных, мучных кондитерских и макаронных изделий. В напитках применяются белки с высокой растворимостью, в изделиях из муки — с низкой. Применение белков с чрезмерно высокой растворимостью в составе хлебопекарных улучшителей отрицательно отражается на эластично-вязкоупругих свойствах теста. Незначительное количество растворимого белка должно содержаться в текстурированных формах белка, зерновых продуктах, приготовленных высокотемпературной экструзией, и макаронных изделиях.
При использовании белков в качестве обогатителей, наполнителей (разбавители), функциональных ингредиентов и аналогов мясных и рыбных изделий большое значение имеют свойства белковых суспензий (ограниченная степень набухания, размер частиц, водо-, жиросвязывающая способности, адгезионные свойства, значение рН, буферная емкость, образование вязкоупругоэластичных масс и гелей).
Водосвязывающая способность характеризуется адсорбцией воды при участии гидрофильных остатков аминокислот, жиросвязывающая — адсорбцией жира за счет гидрофобных остатков. При невысокой влажности гидрофильные группы, взаимодействуя с молекулами воды, образуют мономолекулярный слой, при высокой — вокруг глобул белка формируется многослойная структура с одновременным проникновением воды во впадины и выступы. Общее количество воды и жира на поверхности достигает 0,2–0,4 г на 1 г белков.
Способность белков удерживать жир и воду зависит не только от особенностей аминокислотного состава и структуры, но и от фракционного состава, способа обработки, рН среды, температуры, присутствия углеводов, липидов и других белков. В пшеничном тесте при добавлении соевого белка или пшеничной клейковины водопоглотительная способность положительно коррелирует с количеством нерастворимой фракции белков и отрицательно — с содержанием растворимой. Высокая способность белков удерживать воду в пищевых продуктах (мясные, хлебобулочные и т. д.) повышает выход, удлиняет сроки хранения и улучшает текстуру изделий. Денатурированные белки имеют пониженную водосвязывающую способность, они отрицательно влияют на качество хлеба.
Жироэмульгирующая и пенообразующая способность белков широко используются в практике получения жировых эмульсий и пен. Присутствие в одной белковой цепи гидрофобных и гидрофильных группировок обеспечивает распределение молекул определенным образом на границе раздела фаз вода–масло и вода–газ. Ориентация гидрофильных групп белка к воде, а гидрофобных — к маслу на границе раздела фаз в виде прочного адсорбционного слоя снижает поверхностное натяжение в дисперсных системах и делает их агрегативно устойчивыми и одновременно вязкими. Наиболее широко распространены пищевые эмульсии «масло в воде» (м/в) и «вода в масле» (в/м), называемые соответственно прямыми и обратными. В производстве новых форм белковой пищи большое значение приобрели и эмульсии «вода в воде» (в/в). Все виды эмульсий с белком получают механическим диспергированием одной жидкости в другой при помощи мешалок, гомогенизаторов, обеспечивающих в поле сил сдвига деформацию дисперсионной среды с образованием мелких частиц. Эмульгирующие свойства белков оценивают по эмульгирующей способности, эмульгирующей емкости, стабильности эмульсий и т. д., описание которых можно найти в специальной литературе.
Пены (дисперсные системы с газообразной фазой и жидкой или твердой средой) получают механическим распределением воздуха в белоксодержащих пищевых системах путем сбивания или за счет вскипания воды, понижения давления, химических и микробиологических процессов. Так, белки клейковины образуют пену в хлебном тесте под действием диоксида углерода при брожении, а в кондитерском — за счет химических разрыхлителей при выделении аммиака и диоксида углерода.
Пенообразующие свойства белков характеризуются пенообразующей способностью и стабильностью пены. Первый показатель измеряется объемом пены, отнесенным к массе белка, второй — периодом ее полураспада, то есть временем, необходимым для разрушения половины объема пены. Оба показателя зависят от рН среды, концентрации белка, солей, температуры, присутствия липидов, сахарозы, пищевых волокон, фракционного состава и строения белков. Для качества некоторых пищевых продуктов большое значение имеет размер пузырьков пен, который также зависит от технологических и других факторов. Глютенин пшеницы, например, образует пузырьки пены с большим размером, чем глиадин. После расщепления дисульфидных связей в глиадине и целой клейковине размер пузырьков не изменяется, в то время как у глютенина он уменьшается.
На основе жироэмульгирующих свойств растительные и животные белки применяются в производстве хлебобулочных, мучных кондитерских изделий, низкокалорийных маргаринов, майонезов, паст, мясных продуктов, а пенообразующие свойства являются основой производства сбивных кондитерских изделий (бисквиты, десерты, кремы и т. д.). Способность белковых суспензий к сцеплению с поверхностями металла, пластмасс, картона, бумаги (адгезия) важна в процессах транспортировки, обработки, формования и упаковки тестовых, творожных, сырных, конфетных масс, мясных, рыбных фаршей, текстуратов белка и новых форм белковой пищи (аналоги).
Гелеобразующие свойства белков характеризуются способностью их коллоидного раствора из свободнодиспергированного состояния переходить в связнодисперсное с образованием систем, обладающих свойствами твердых тел. Упругие свойства геля обусловлены образованием пространственной сетки взаимодействующих молекул белка и зависят от минимальной его концентрации, рН, присутствия других белков, солей, полисахаридов. Концентрация белков, при которой наступает гелеобразование, называется «гель-точкой».
Белок должен образовывать гели в широком диапазоне рН, ионной силы при минимальной его концентрации («гель-точке») и с необходимыми физико-химическими свойствами, такими как прочность, твердость, эластичность, температура размягчения, плавления, степень набухания, сорбция красителей, ароматических веществ, тиксотропия, синерезис и т. д. (тиксотропия — это способность геля обратимо переходить в текучее состояние при механической обработке и вновь образовывать нетекучий гель после ее снятия; синерезисом называется отделение дисперсионной среды с сокращением объема геля). Подобного рода «универсальным» гелеобразователем является желатин, который обеспечивает регулирование физико-химических свойств пищевых продуктов и их химический состав. Различают наполненные, смешанные, комплексные, анизотропные гели и ксерогели. Наполненные гели содержат другие белки в суспензированном или растворенном виде, смешанные состоят из пространственных сеток с разными видами белков, у комплексных гелей роль гелеобразователя выполняют комплексы белков с другими соединениями. Отличительной особенностью анизотропных гелей является наличие в их составе ориентированных молекул белка, а ксерогелей (сухие гели) — возможность хранения их в течение длительного времени.
Отличительным свойством некоторых пищевых белков является низкий уровень полярности функциональных групп. Молекулы воды, окружая частицы белков, отталкиваются, а молекулы белков, наоборот, агрегируются с образованием комплексов с присущими им реологическими свойствами (вязкость, эластичность, упругость). Наиболее выраженным комплексом таких свойств обладают белки пшеничной клейковины, обусловливающие текстуру хлеба и создающие непрерывную фазу в изделиях с наполнителями (зерно, отруби, изюм). За свойство упругости и эластичности белков ответственность несет глютениновая фракция белков клейковины.
Функциональные свойства белков определяются особенностями их структуры, биохимическими и физико-химическими свойствами. Например, вязкость и гелеобразующие свойства соотносятся с размером и формой молекул, а водосвязывающая, пенообразующая и жироэмульгирующая способность — с соотношением полярных и неполярных (гидрофобных) групп. Факторы, которые изменяют структуру, аминокислотный, фракционный состав белков, вызывают денатурацию, агрегацию и взаимодействие с другими компонентами (липиды, углеводы и т. д.); они являются факторами, регулирующими функциональные свойства.
Регулирование функциональных свойств белков осуществляют для обеспечения стабильности технологического процесса производства пищевых изделий, улучшения их качества и расширения ассортимента. Методы регулирования функциональных свойств белков подразделяются на физико-химические, биохимические и химические.
К физико-химическим методам относятся растворение белков перед сушкой (в растворе кислот, щелочей, оснований — с целью изменения их заряда, ионного состава), тепловая денатурация и т. д. При этом у белков изменяются функциональные свойства: повышается растворимость, гелеобразующая, жироэмульгирующая способность, способность к текстурированию и прядению.
Функциональные свойства белков могут улучшаться за счет обработки их веществами липидной (лецитин, стеароиллактилат натрия или кальция, моно-, диацилглицерины), углеводной (пектины, альгинаты, каррагинаны, камеди) или иной природы (поливалентные металлы). При этом реакционные группы белков взаимодействуют с небелковыми соединениями и образуют так называемые композитные формулы и модули. Композиты усиливают водопоглощение, эмульгирование, связывание жира, гелеобразование и улучшают тем самым качество готовых изделий.
Эффективно взаимодействие белков с отрицательно заряженными полисахаридами (пектины, альгинаты, карбоксиметилцеллюлоза). За счет сорбции отрицательных групп полисахаридов на одноименно и разноименно заряженных белковых молекулах, а также при участии гидрофобных и водородных связей образуются нерастворимые комплексы, сопровождающиеся фазовым расслоением систем. При этом может изменяться и вторичная структура белка.
Комплексообразование применяется для фракционирования белков, избирательного осаждения их из растворов, а также стабилизации качества пищевых систем (мясные фарши, кондитерские пены, бисквиты, кексы и т. д.). Комплексы белок–анионный полисахарид хорошо набухают, имеют высокие водоудерживающую способность и поверхностноактивные свойства.
В присутствии, например, пектина и каррагинана повышается эмульсионная емкость, стабильность жировой эмульсии с казеинатом натрия (Э. Токаев, И. А. Рогов и др.,1982), под действием гуммиарабика и КМЦ казеин и глобулины сои образуют стабильные пены (В. Б. Толстогузов, Е. Е. Браудо и др., 1985), а жироэмульгирующие и пенообразующие свойства белков сухой пшеничной клейковины и альбумина улучшаются под влиянием гуаровой, ксантановой камедей, альгината натрия и -каррагинана (С. В. Ванин, В. В. Колпакова, 2008).
Биохимическая модификация функциональных свойств белков осуществляется с использованием различных ферментов (табл. 16) растительного, микробного или животного происхождения. Преимущества таких методов — мягкие режимы выделения белков, сохранение биологической ценности и возможность регулирования глубины той или иной реакции. К недостаткам методов относится ограничение процессов модификации из-за высокой степени специфичности ферментов.
Из ферментативных методов модификации наибольшее распространение получил метод ограниченного ферментативного протеолиза. С его использованием для замены яичного альбумина выпускают пенообразующие модифицированные соевые белки: гидролизаты изолята и гидролизаты муки.
При ограниченном протеолизе изменяется структура и молекулярные массы белков. Например, у легумина кормовых белков под влиянием трипсина расщепляются пептидные связи только α-цепей, тогда как
Таблица 16. Методы ферментативной модификации белков (К. Швенке, 2000)
| Реакция | Фермент | Реагирующие функциональные группы | Структурные эффекты |
| Протеолиз | Протеиназы | Специфическое расщепление пептидных связей | Уменьшение молекулярной массы, гидрофилизация |
| Пластеиновая | Протеиназы | Пептидные связи,
–NН2 и –СООН |
Транспептидация после ферментативного расщепления |
| Гликозилирование | Трансглутаминазы | –Glu–CО–NН2
–ОН –Glu–СО–NН2
–Glu–СО–NН2 Tyr Tyr |
Гидрофилизация |
| Фосфорилироваие | Протеинкиназы | То же | |
| Дезамидирование | Пептидоглутаминазы, трансглутаминазы | « « | |
| Сшивание | Трансглутаминазы,
пероксидаза, полифенолоксидаза |
Стабилизация структуры |
β-цепи остаются незатронутыми. И только в ходе дальнейшего глубокого протеолиза β-цепи 11S белка расщепляются на пептиды.
Гидролитический распад гидрофильных α-цепей приводит к понижению молекулярной массы с 340 до 240 кДа и возрастанию степени гидрофобности «обрубка» — легумина Т. Молекулы белка становятся более компактными, сферическими и с высокой термодинамической стабильностью (Е. Е. Браудо, 1997). При этом улучшаются эмульгирующие и пенообразующие свойства белков.
Аналогичная взаимосвязь между особенностями структуры 11S глобулинов, подвергнувшихся ограниченному протеолизу, и функциональными свойствами существует и у гороха, и у сои. Разница заключается в молекулярных массах легумина Т — 230–260 кДа.
Определенный интерес представляют реакции ферментативного синтеза белков из пептидов (пластеиновый синтез), которые целесообразно применять для введения в состав белков незаменимых аминокислот или их производных (эфиры) с целью улучшения растворимости, поверхностно-активных свойств и биологической ценности:
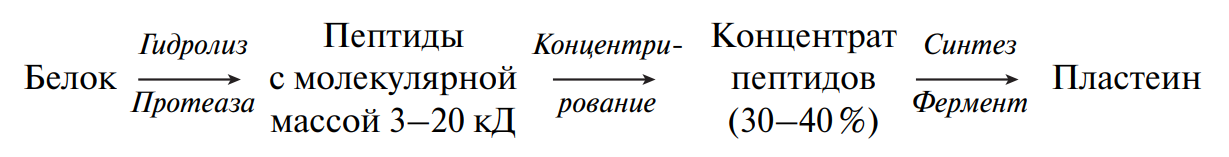
Важнейшие химические методы модификации функциональных свойств приведены в табл. 17. Из этих методов широко известны приемы дезамидирования (удаление амидных групп глутамина и аспарагина), ацилирования аминогрупп янтарным (сукцинилирование) или уксусным (ацетилирование) ангидридами и фосфорилирования.
Таблица 17. Методы химической модификации белков (К. Д. Швенке, 2000)
| Реакция | Реагирующие функциональные группы | Структурные эффекты |
| Ацетилирование | –NН2, –ОН, Tyr–ОН, –SН | Гидрофобизация, изменение конформации при высоких степенях модификации |
| Сукцинилирование | –NН2, –ОН, (Tyr–ОН, –SН)* | То же |
| Гликозилирование | –NН2 | Гидрофилизация |
| Фосфорилирование | –ОН, –NН2, Tyr–ОН, (–СООН)* | Гидрофилизация, сшивание, гидрофобизация как результат изменения конформации |
| Дезамидирование | –СОNН2 | Гидрофилизация, гидрофобизация как результат изменения конформации |
| Этерификация | –СООН | Гидрофобизация |
* Продукты реакции нестабильны.
Сукцинилирование и ацетилирование протекают по следующим схемам:
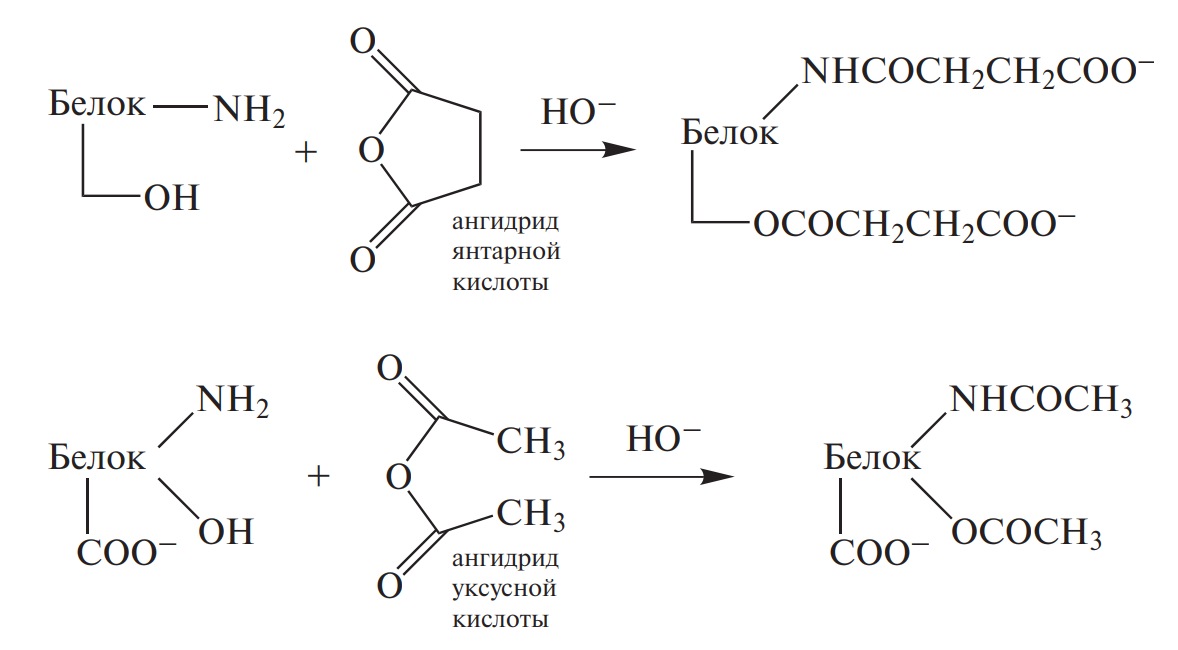
Данный вид химической модификации приводит к повышению суммарного отрицательного заряда молекулы из-за ковалентного присоединения остатков янтарной и уксусной кислот к -группам остатков лизина. Степень ацилирования возрастает за счет гидроксильных групп серина, треонина и тирозина.
Электростатическое отталкивание одноименно заряженных групп приводит к структурным изменениям в белках и даже распаду 11S белков на субъединицы и развертыванию их глобулярной структуры. Подобные структурные изменения характерны для 11S глобулинов семян арахиса, рапса, подсолнечника, гороха и кормовых бобов.
Благодаря изменению пространственной структуры и заряда молекул белков усиливаются гидрофобные свойства, следовательно, улучшаются эмульгирующие и пенообразующие свойства, изменяются растворимость и гелеобразующие свойства. Полипептидные цепи формируют гели при меньших значениях концентрации, рН и температуры, чем нативные белковые глобулы. С возрастанием степени модификации прочность гелей уменьшается, поэтому для ацетилированных белков целесообразна средняя степень модификации.
Сукцинилированные или ацетилированные легумины при определенной степени модификации образуют эмульсии «масло в воде» высокой степени устойчивости.
Фосфорилирование растительных белков с применением хлорокиси фосфора приводит к улучшению растворимости, эмульгирующих и пенообразующих свойств и способности к гелеобразованию. Стабилизации структуры геля способствуют ковалентные сшивки модифицированных белков:
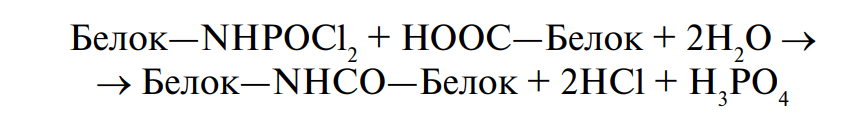
9. Превращения белков в технологическом потоке
Нативная трехмерная структура белков поддерживается разнообразием внутри- и межмолекулярных сил и поперечных связей. Любое изменение условий среды в технологических потоках производства пищевых продуктов оказывает влияние на нековалентные связи молекулярной структуры и приводит к разрушению четвертичной, вторичной и третичной структур. Разрушение нативной структуры, сопровождающееся потерей биологической активности (ферментативная, гормональная), называют денатурацией. С физической точки зрения денатурацию рассматривают как разупорядочение конформации полипептидной цепи без изменения первичной структуры. Процесс денатурации протомера схематически представлен на рис. 17. Денатурация олигомерного белка заключается в диссоциации на протомеры, сопровождающейся или не сопровождающейся изменением их конформации.
Рис. 17. Схема денатурации протомера
Большинство белков денатурируются в присутствии сильных минеральных кислот или оснований, при нагревании, охлаждении, обработке поверхностно-активными веществами (додецилсульфат), мочевиной, гуанидином, тяжелыми металлами (Ag, Pb, Hg) или органическими растворителями (этанол, метанол, ацетон). Широкое применение кислот, оснований, солей, органических растворителей предусматривается в практике выделения белков из пищевого сырья и готовых продуктов при изучении их свойств и структурных особенностей, а также при экстракции и очистке в технологии выделения концентратов и изолятов. Денатурированные белки обычно менее растворимы в воде, так как их полипептидные цепи настолько сильно переплетены между собой, что затрудняется доступ молекул растворителя к радикалам остатков аминокислот.
Белки денатурируются при 60–80 °С, однако встречаются белки и термостабильные, например α-лактальбумин молока и α-амилаза некоторых бактерий. Повышенная устойчивость белков к нагреванию часто обусловливается наличием в их составе большого количества дисульфидных связей. Однако степень денатурирующего воздействия температуры на белки зависит и от их влажности, реакции, солевого состава среды и присутствия небелковых соединений. Например, температура денатурации белков сои и подсолнечника существенно понижается в присутствии кислот жирного ряда, кислой и влажной среде, но повышается в присутствии сахарозы, крахмала.
Факторы, вызывающие денатурацию белков, имеют особо важное значение для регулирования активности ферментов. Любые воздействия, направленные на стабилизацию вторичной и третичной структуры, приводят к повышению активности ферментов, а те, которые разрушают нативную структуру, — к их инактивации.
При температуре от 40–60 до 100 °С наблюдается взаимодействие белков с восстанавливающими сахарами, сопровождающееся образованием карбонильных соединений и темноокрашенных продуктов — меланоидинов (реакция Майяра). Сущность реакций меланоидинообразования заключается во взаимодействии группы –NH2 аминокислот с гликозидными гидроксилами сахаров (см. гл. 3). Сахароаминные реакции являются причиной не только потемнения пищевых продуктов, но и уменьшения сухого вещества и потерь незаменимых аминокислот (лизин, треонин).
Меланоидины понижают биологическую ценность изделий, так как снижается усвояемость аминокислот из-за того, что сахароаминные комплексы не подвергаются гидролизу ферментами пищеварительного тракта. К тому же количество незаменимых аминокислот уменьшается. Это уменьшение происходит не только за счет взаимодействия их с восстанавливающими сахарами, но и за счет взаимодействия между собой функциональных групп –NН2 и –СООН самого белка. Реакции протекают с образованием внутренних ангидридов, циклических амидов и ω– изопептидных связей. Механизм образования связей с участием глутаминовой кислоты и ее амида представлен на рис. 18. Изопептиды обнаружены в кератине, молочных белках и белках мяса.
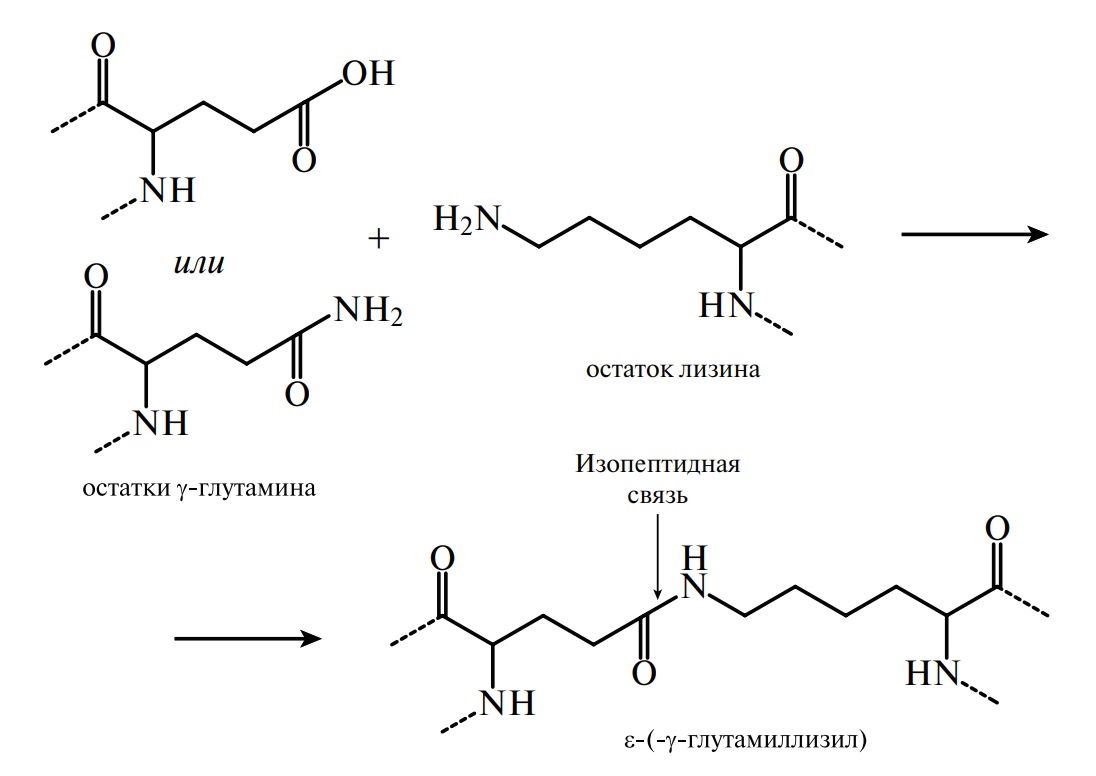
Рис. 18. Механизм образования изопептидных связей
Тепловая денатурация белков является одним из основных физико-химических процессов, лежащих в основе выпечки хлеба, печенья, бисквитов, пирожных, сухарей, сушки макаронных изделий, получения экструдатов, сухих завтраков, варки, жарения овощей, рыбы, мяса, консервирования, пастеризации и стерилизации молока. Данный вид превращений относится к полезным, так как он ускоряет переваривание белков в желудочно-кишечном тракте человека (облегчая доступ к ним протеолитических ферментов) и обусловливает потребительские свойства пищевых продуктов (текстура, внешний вид, органолептические свойства).
В связи с тем, что степень денатурации белков может быть различной (от незначительной до полного изменения расположения пептидных цепей с образованием новых ковалентных –S–S-связей), то и усвояемость полимеров может не только улучшаться, но и ухудшаться. Параллельно могут изменяться физико-химические свойства белков. Для хлопковых семян, подвергнутых влаготепловой обработке, зафиксирован, например, переход растворимого азота из одной формы в другую:
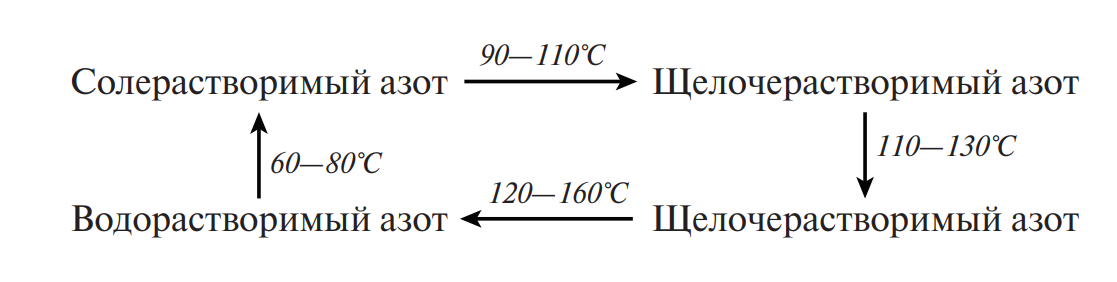
Термическая обработка белоксодержащей пищи при 100–120 °С приводит не к денатурации, а к разрушению (деструкция) макромолекул белка с отщеплением функциональных групп, расщеплением пептидных связей и образованием сероводорода, аммиака, углекислого газа и ряда более сложных соединений небелковой природы. Так, стерилизация молочных, мясных и рыбных продуктов при температуре выше 115 °С вызывает разрушение цистеиновых остатков с отщеплением сероводорода, диметилсульфида и цистеиновой кислоты: Н2S; СН3—S—CH3; HOOC—CH(NH2)CH2SO3H.
Реакции дезамидирования аспарагиновой и глутаминовой аминокислот и дегидратации глицина могут быть причиной образования новых ковалентных связей в белках, так как образуется пирролидонкарбоновая кислота и 2,5-дикетопиперазин, которого много встречается в обжаренных бобах какао.
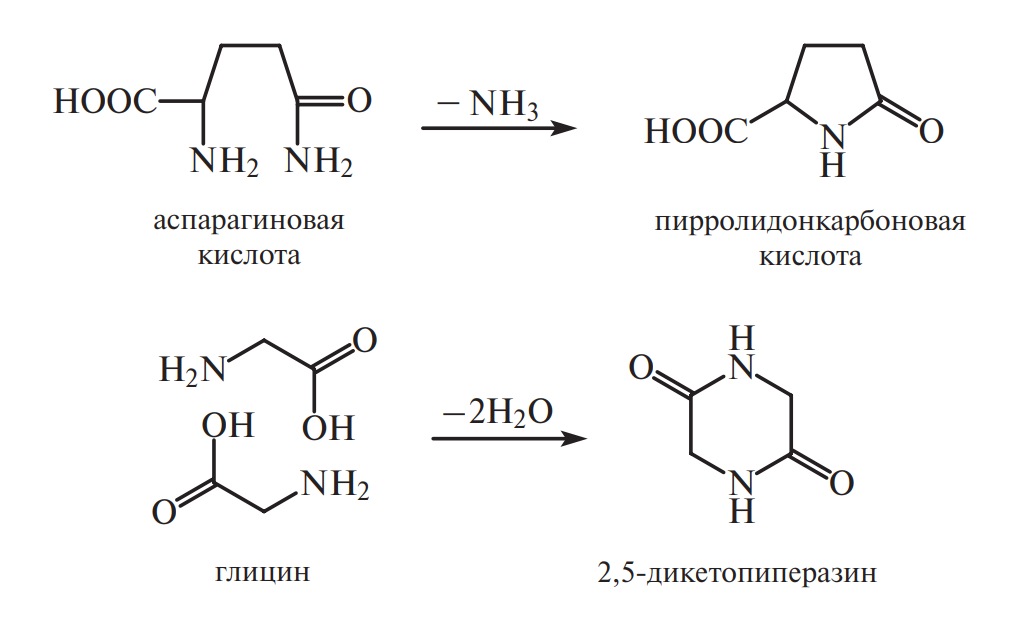
Среди продуктов термического распада белков встречаются соединения, придающие им мутагенные свойства. Термически индуцированные мутагены образуются в белоксодержащей пище в процессе ее обжаривания в масле, выпечки, копчения в дыму и сушки. Мутагены содержатся в бульонах, жареной говядине, свинине, домашней птице, жареных яйцах, копченой и вяленой рыбе. Некоторые из них вызывают наследственные изменения в ДНК, и их воздействие на здоровье человека может быть от незначительного до летального.
В экстрактах, выделенных из жареной рыбы и мяса, еще в 1970-х гг. найдены продукты пирролиза аминокислот, образующиеся обычно при 500–600 °С. Продукты идентифицированы как Трп—П—1 и Трп—П—2 из триптофана, Фен—П—1 из фенилаланина, Глу—П—1 и Глу—П—2 из глутаминовой кислоты, Лиз—П—1 из лизина, Орн—П—1 из орнитина:
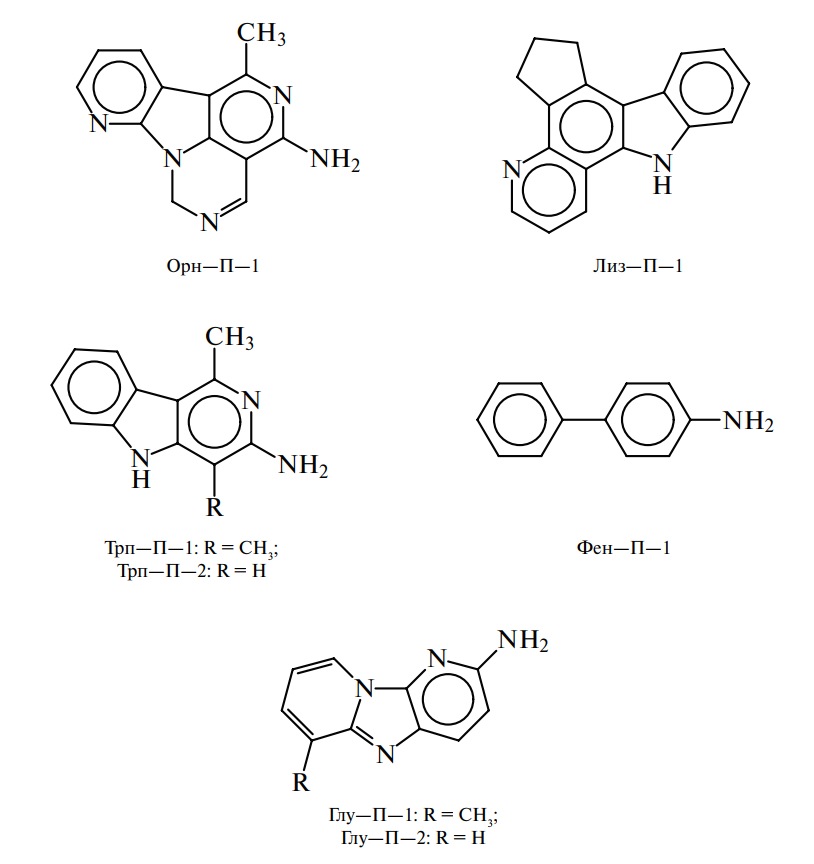
Другая группа мутагенных соединений в белковой пище обнаружена в 1980-х гг. в умеренно нагретом мясе (ниже 200 °С) и пищевых бульонах:
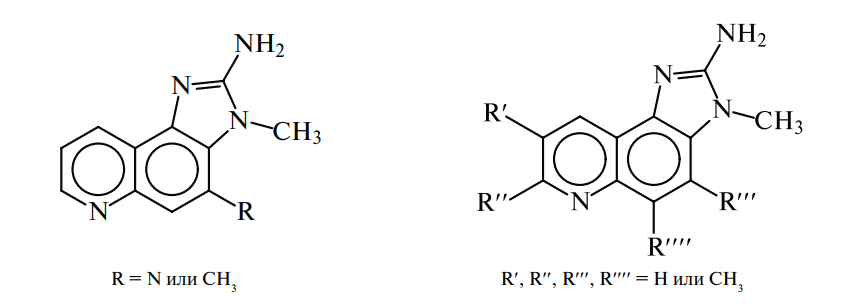
Токсические свойства белков при термической обработке выше 200 °С или при более низких температурах, но в щелочной среде, могут обусловливаться не только процессами деструкции, но и реакциями изомеризации остатков аминокислот из L- в D-форму. Присутствие D-изомеров понижает усвояемость белков. Например, термообработка казеина молока при температуре около 200 °С снижает биологическую ценность продукта на 50 %.
В сильнощелочных средах, особенно при высоких температурах, остатки аминокислот претерпевают ряд специфических превращений (Э. Г. Розанцев, 1997). Так, аргинин превращается в орнитин, цитруллин — в мочевину и аммиак, а цистеин — в дегидроаланин с выделением сероводорода.
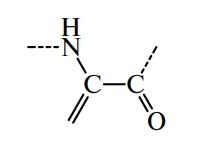
Реакционноспособный дегидроаланин конденсируется с остатками лизина, орнитина и цистеина боковых цепей и образует межмолекулярные поперечные связи в белках.
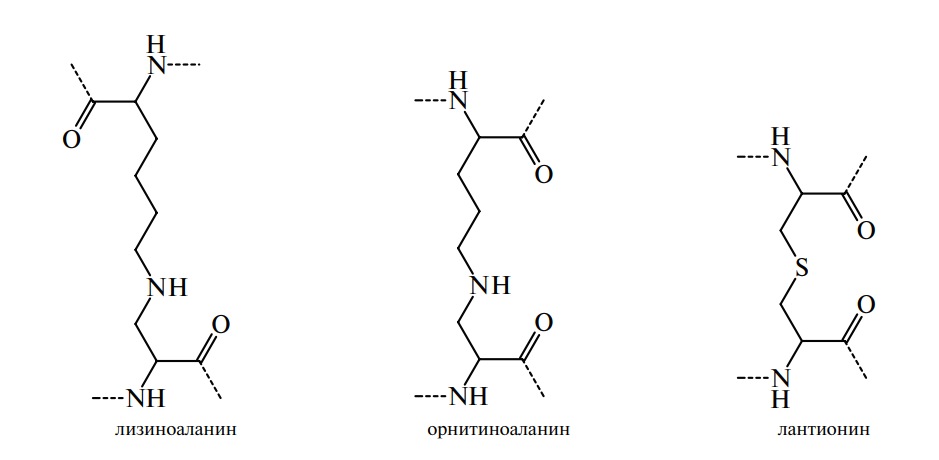
В реакцию конденсации могут вступать остатки аргинина, гистидина, треонина, серина, тирозина, триптофана. Питательная ценность белков с новыми поперечными связями ниже, чем у белков с нативной структурой, поэтому образование их в технологических процессах производства пищевых продуктов нежелательно. К тому же, в опытах на крысах показано, что образование, например, лизиноаланина стимулирует нефрокальциноз, диарею и облысение.
Обработка сырья растворами щелочей широко используется при получении изолятов и концентратов белков. Чем ниже значение рН, температура и время обработки, тем выше содержание незаменимых аминокислот в белке. Например, при повышении рН раствора с 8,5 до 12,5 при экстракции белка из пшеничных отрубей количество лизина в нем уменьшается на 40 %, треонина — на 26 %, а валина — на 24 %. Мягкие температурные режимы предохраняют от образования в больших количествах нежелательных аминокислотных фрагментов. В то же время среди специалистов обсуждается вопрос о введении предельно допустимых концентраций лизиноаланина (например, 300 мг на 1 кг) в целях обеспечения безопасности белоксодержащей пищи.
Неблагоприятные погодные условия при созревании зерна, поражение его вредителями и микрофлорой, пониженная или повышенная температура при хранении и переработке сырья, полуфабрикатов, механические, физические, химические факторы (перемешивание, гомогенизация, замес, инфракрасное облучение, ультразвук, действие солей, диоксида углерода, газообразных азота, этилена и т. д.) усиливают структурные перестройки белков, которые могут разрушать природные белково-липидные взаимодействия. Высвобождающиеся липиды, подвергаясь окислительной порче, способны инициировать образование ковалентных меж- и внутримолекулярных связей в белках и новых полимерах:
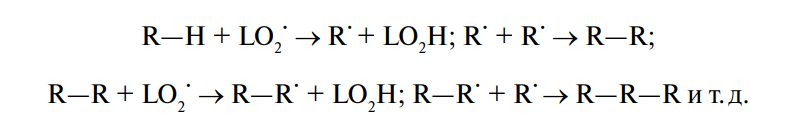
Остатки тирозина в присутствии гидропероксидов (LO2H) могут превращаться в сульфоксиды и сульфоны, остатки цистеина — в сульфиновые, сульфоновые кислоты, а остатки триптофана — в гидрокси-β-индолилаланин и N-формилкинуренин. Все реакции окисления связаны с потерей незаменимых аминокислот. Окислительная порча белков особенно опасна при переработке масличного и жирового сырья. Торможения реакций можно достигать добавлением антиоксидантов, ферментных препаратов или повышением активности собственных ферментов сырья в целях вывода липидов из взаимодействия с белками.
Традиционные и новые технологические процессы, без глубокого изучения влияния их на молекулярные основы структуры белков, не только опасны для здоровья людей, но и неэффективны с точки зрения обеспечения качества пищевых продуктов. Примером может служить современное научное обоснование применения аскорбиновой кислоты для улучшения качества хлеба.
В свете последних данных, аскорбиновая кислота оказывает положительное воздействие не напрямую на белки клейковины, а через трипептид глютатион. Кислота окисляет восстановленную форму глютатиона (Г-SH) и превращает его в окисленную форму (Г-S-S-Г), что предохраняет глютатион от участия его в сульфгидрильно-дисульфидном обмене с белками клейковины во время образования теста. Дисульфидносвязанные цепи белка не вступают во взаимодействие с восстановленной формой глютатиона (Г-SH), тесто не расплывается и качество хлеба улучшается. Наряду с окислением в технологических процессах, предусматривающих механические, физические воздействия на белковые вещества сырья (замес, гомогенизация, ультразвук и т. д.), протекают и другие превращения, характер которых зависит от природы, степени и способа этих воздействий. При обработке, например, молока ультразвуком протекают различные химические превращения, так как скорость выброса струи жидкости 400 км/ч, а температура вблизи пузырьков схлопывания достигает 2100 °С. При усиленной механической обработке хлебного теста возможна деструкция белков с разрывом как дисульфидных, так и пептидных связей, а при его замесе, измельчении семян, зерна наблюдается тепловая агрегация белков.
Агрегирующая способность белков пшеницы является одним из важнейших процессов при формировании клейковины при ее отмывании и тестоведении. Параметры агрегации определяют по методу японских исследователей (Т. Arakawa, D. Yonezawa, 1975). Для этого смешивают растворы клейковинных белков в 0,01 н. уксусной кислоте и 0,2 М натрий-фосфатного буферного раствора (рН 5,6), содержащего 2 М NаСl. Измеряют оптическую плотность раствора (при λ = 350 нм) во времени агрегации процесса и рассчитывают коэффициент начального этапа агрегации (К ) и показатель агрегации (t10 /с), характеризующий степень помутнения раствора в течение 10 мин.
Константу начальной скорости агрегации рассчитывают по уравнениям:
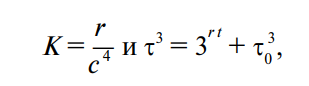
где τ — оптическая плотность раствора при λ = 350 нм; r — постоянная, отражающая изменение τ3 в первые 1–1,5 мин агрегации; τ — время агрегации; τ0 — оптическая плотность при τ = 0; с — концентрация белка,%.
Параметры агрегации белков сильных пшениц, характеризующиеся более «плотной» пространственной упаковкой структуры, выше по сравнению со слабыми, имеющими более «рыхлую» организацию молекул (рис. 19). Процесс образования белковых агрегатов по ходу технологического процесса приготовления изделий из муки интенсивнее у крепкой клейковины, чем у слабой.
Рис. 19. Кривая помутнения раствора с клейковиной из муки разного качества (Т. Arakawa, D. Yonezawa, 1975): S — сильная мука; М1 и М2 — средняя; W — слабая
Константы агрегации уксуснорастворимых белков, экстрагированных из предварительно отмытой клейковины и теста, выше, чем белков, выделенных из муки (В. Колпакова, Е. Молчанова, 1991). Следовательно, при гидратации белков в ходе технологического процесса и, в частности, при замесе теста или отмывании клейковины водой происходят внутри- и (или) межмолекулярные превращения, связанные с изменением структуры молекул, приводящим к снижению агрегирующих свойств.
Наиболее высокие показатели агрегации наблюдаются у α- и γ-компонентов глиадина, наименее — у ω-компонентов. Способность к агрегации возрастает по мере увеличения подвижности полипептидов и уменьшения их молекулярной массы. Очень высокой способностью образовывать надмолекулярные ассоциаты обладают быстроподвижные α-глиадины с молекулярной массой 31 000.
Агрегирующая способность белков взаимосвязана с особенностями аминокислотного состава. Так, суммарный глиадин с повышенной агрегирующей способностью содержит меньше заряженных групп, а ω-глиадины, обладающие низкой степенью агрегации, богаты пролином, фенилаланином, амидогруппами и полярными аминокислотными остатками. Это определяет высокую способность их к взаимодействию с другими компонентами муки и прежде всего с липидами и липидоподобными соединениями (дигалактозилдиглицерид). Комплексообразование последнего с ω-глиадинами за счет водородных связей обусловливает газоудерживающую способность теста и объем хлеба. Имеются данные, что структура комплексов белки–липиды имеет сходство со структурой белок-липидных мембран.
В агрегации и взаимодействии молекул клейковинных частиц с другими компонентами муки в технологических процессах производства хлеба, макаронных изделий, печенья и т. д. наряду с водородными связями принимают участие гидрофобные, ионно-электростатические и дисульфидные связи.
Способность к формированию агрегированных структур зависит от рН, ионной силы, присутствия денатурирующих, восстанавливающих и других видов веществ.
С повышением рН от 4,0 до 9,1 агрегация белков злаковых культур (пшеница, рожь, ячмень) повышается. Чем больше концентрация нейтральных солей, тем выше агрегирующая способность белков. Отсюда — определенные дозировки поваренной соли способны регулировать образование или разрушение макромолекул клейковинного белка пшеничного теста при производстве хлеба.
Определенное влияние на агрегативное состояние запасных белков оказывают детергенты (ПАВ) различной природы: анионные, катионные, нейтральные. В присутствии анионного детергента в кислой среде, когда молекулы имеют положительный заряд, агрегация белка максимальна. Действие же катионных и нейтральных детергентов в направлении усиления или ослабления агрегации неоднозначно и зависит от рН среды и их концентрации.
В целом агрегирующая способность запасных белков различных зерновых культур в ходе технологического процесса может быть представлена в виде интегральной суммы множества взаимодействий, способствующих или препятствующих образованию надмолекулярных структур:
где ΔАи — агрегация белка за счет ионно-электростатических сил; ΔАг — гидрофобных взаимодействий; ΔАв — водородных связей; ΔАн — набухания (гидратации); ΔАα — изменения регулярных структур; ΔАд — содержания дисульфидных связей.
Степень участия того или иного фактора в изменении агрегативного состояния белков, а с ним и реологических свойств теста и качества хлеба зависит от исходных физико-химических свойств и структурных особенностей белков муки, технологических факторов (температура, степень механического воздействия, рН среды и т. д.), химической природы, количества дополнительного сырья, улучшителей, пищевых добавок.
Огромное значение для изменения свойств и агрегативного состояния белков в ходе технологического процесса приготовления теста имеет дисульфидно-сульфгидрильный обмен:
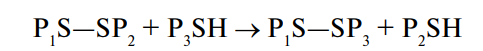
Считают, что лабильность дисульфидных связей обеспечивает образование новых прочных межмолекулярных связей и релаксацию (ослабление) напряжения структур клейковины при замесе теста.
Сильная мука, содержащая крепкую клейковину, требует больше времени замеса, так как она содержит больше дисульфидных связей и меньше SН-групп, чем слабая.
В процессе созревания муки при ее отлежке, а также под влиянием окислителей типа броматов улучшение реологических свойств клейковины объясняется увеличением содержания S–S-связей и уменьшением соответственно SН-групп. В присутствии восстанавливающих агентов (сульфит натрия) реологические свойства клейковины ухудшаются, как это имеет место в прорастающем зерне или в процессе приготовления теста из зерна, пораженного клопом-черепашкой. Во всех случаях показатели качества и реологические характеристики теста связаны с изменением соотношения S–S-связей и SН-групп в белках.
Процессы образования или распада S–S-связей в созревающем и прорастающем зерне пшеницы протекают при участии специфических ферментов тиол-дисульфидного обмена: тиол-кислородоксидоредуктазы (КФ 8.3.2) и тиол-протеиндисульфидредуктазы (КФ 8.4.2). Регулирование активности данных ферментов в процессе приготовления теста может улучшить технологические свойства муки и качество хлеба.
В результате действия протеолитических ферментов в технологическом потоке производства пищевых продуктов белковые вещества также претерпевают ряд существенных изменений. Так, на стадии солодоращения при производстве пива в эндосперме ячменя наблюдается гидролиз глобулина (эдестин), альбумина (лейкозин), проламина (гордеин) и глютелина с накоплением азотистых соединений с более низкой молекулярной массой (пептиды, аминокислоты). В результате в зерне накапливается растворимая, коагулируемая и аминная формы азота, тогда как в зародышевом листке и ростках зерна, наоборот, увеличивается количество белкового азота за счет процессов синтеза.
Высокомолекулярные фракции белков при прорастании зерна расщепляются под действием ферментов эндопептидаз (по схеме:
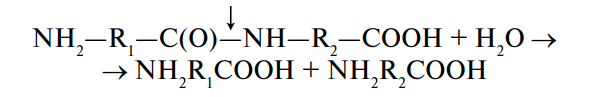
и экзопептидаз (дипептидаз и полипептидаз). Полипептидазы включают аминопептидазы (α-аминоацилпептидгидролазы, 4.1), для действия которых необходимы свободные аминогруппы (–NН2), и карбоксипептидазы (пептидиламинокислотные гидролазы, 4.2), требующие для гидролиза свободные карбоксильные группы (–СООН).
Технологические режимы проращивания зерна предусматривают оптимальные условия (рН, температура) действия гидролитических ферментов для обеспечения накопления низкомолекулярных азотистых соединений для питания дрожжей сусла.
В традиционной технологии производства хлеба и мучных кондитерских изделий из муки нормального качества при тестоведении не протекают глубокие реакции гидролиза белков, свидетельствующие об изменении их первичной структуры, тогда как слабые процессы пептизации низкомолекулярных азотистых соединений, являющихся продуктами незавершенного синтеза в зерне, могут иметь место. Изменения белков при тестоведении ограничиваются, как правило, агрегацией, дезагрегацией и нарушением вторичной, третичной и четвертичной структур.
10. Состав и техно-функциональные свойства белковых композитов
В основе создания белковых композитов лежит способность белков к взаимодействию с биологически активными соединениями. Композиты предназначаются для профилактики и лечения сердечно-сосудистых заболеваний, диабета, аллергии, атеросклероза, для специальных модулей длительного хранения, для питания детей (раннего возраста и школьников), престарелых людей, военнослужащих и спортсменов. Медико-биологические требования к композитам заключаются в исключении из их состава меланоидинов, продуктов взаимодействия окисленных липидов с белками и, наоборот, во введении безаллергенных полипептидов, фосфатидов, пектина, клетчатки, витаминов, минеральных веществ и других соединений.
Белковые продукты с включенными в их состав различными ингредиентами называются композитами (модули). Способность композитов иметь регулируемые химический состав и функциональные свойства определяет возможность использования их в качестве сырья при производстве пищевых или кормовых продуктов. Композиты подразделяют на следующие:
- продукты с комплементарным аминокислотным составом (предназначены для повышения пищевой и биологической ценности изделий);
- продукты как технологические ингредиенты для улучшения показателей качества готовых изделий и стабилизации их при хранении;
- специальные продукты и модули лечебно-профилактической направленности.
В качестве белковой основы используют как традиционные белки (соевые, пшеничные), так и белки из нетрадиционного сырья. Обязательные условия — отсутствие антипитательных веществ, способность к длительному хранению и хорошие функциональные свойства.
Полимерные цепи белка, имея в своем составе химические группировки (–СООН, –NН2, –SH, –ОН и др.), взаимодействуют с различными группами фосфатидов, остатками жирных кислот, ацилглицеринами, минеральными веществами, пектином и т. д.; в результате возможна модификация химического состава и функциональных свойств препаратов (водо-, жиросвязывающая способность, растворимость, жироэмульгирующие свойства, гелеобразование, текстурирование и т. д.). Разработка композитов сопровождается изменениями в первоначальной структуре и физико-химических свойствах белковых препаратов под влиянием вводимых ингредиентов, поэтому и формируются новые функциональные свойства.
За рубежом организовано производство белковых композитов на основе пшеничной клейковины, соевых белков с лецитином, гидроколлоидами (стабилизаторы, загустители, гелеобразователи) и витаминами. Их используют в хлебопекарной, кондитерской и мясоперерабатывающей промышленности.
На базе научных работ ученых нашей страны (В. Л. Кретович, А. Б. Вакар, А. П. Нечаев, В. Б. Толстогузов, Е. Е. Браудо, И. А. Рогов, Е. И. Титов и др.) в области изучения структуры, свойств и питательной ценности белков разработаны технологии белковых композитов состава белок-белок, белок-жир, белок-жир-лецитин с комплементарным амино- и жирно-кислотным составами (И. В. Мартынова, А. А. Невский, В. В. Колпакова, 2000–2007). Основой композитов служат белки из периферических частей зерен пшеницы, ржи, ячменя (крупка, отруби, зародыш, шелуха), соевой муки и концентратов.
По химическому составу двух- и трехкомпонентные композиты на основе зерновых продуктов относятся к группе «Мука белковая» (табл. 18); аминокислотный состав их более сбалансирован, чем у исходных белков (табл. 19).
Таблица 18. Химический состав белковых композитов из фракций зерна (в масс. долях, % на с. в.)
| Фракции зерна | Белок | Углеводы | Клетчатка | Зола | |
| Крахмал | Сахара | ||||
| Крупка
Шелуха |
40–50
40–45 |
30–43
35–40 |
2–3
4–5 |
2–3
3–4 |
2–4
3–5 |
Таблица 19. Аминокислотный скор белковых препаратов и композитов (в %)
| Аминокислоты | Периферические части зерна (шелуха) | |||||
| Препараты | Композиты | |||||
| Пшеница | Рожь | Ячмень | Пшеницарожь | Пшеницаячмень | Пшеницарожьячмень | |
| Лизин | 52 | 63 | 64 | 58 | 58 | 60 |
| Треонин | 76 | 100 | 99 | 86 | 88 | 90 |
| Валин | 95 | 100 | 100 | 100 | 100 | 100 |
| Лейцин | 95 | 100 | 100 | 100 | 100 | 100 |
| Изолейцин | 88 | 90 | 100 | 97 | 100 | 100 |
| Метионин + цистеин | 91 | 100 | 100 | 100 | 100 | 100 |
| Фенилаланин + тирозин | 100 | 100 | 100 | 100 | 100 | 100 |
Двух- и трехкомпонентные белково-липидные композиты включают белковые продукты из сои, чечевицы, нута, клейковину пшеницы, концентрат из пшеничных отрубей, соевое, подсолнечное, пальмовое масло, лецитин.
Композиты содержат (в %): 22,0–57,7 белка; 22–30 жира; 1,8–4,6 клетчатки; 27,9–42,9 углеводов; 3–5 зольных элементов; 4–10 лецитина. Скор лизина составляет 50–100 %, треонина — 80–100 %, валина и серосодержащих аминокислот — от 90 до 100 %. Соотношение насыщенных, моно- и полиненасыщенных жирных кислот (от 1 : 1,1 : 1,8 до 1 : 1,3 : 2,2) приближается к соотношению, рекомендуемому для здорового питания; количество трансизомеров жирных кислот не превышает 1,8 %. Жировые композиции композитов понижают уровень холестерина в крови животных.
Функциональные свойства белковых композитов зависят от природы белка, химического состава, технологических режимов и способов приготовления. Так, у композита с соевой мукой по сравнению с композитом, содержащим белковую муку из пшеничных отрубей, на 16–20 % выше растворимость, на 32–60 % больше жиросвязывающая способность и, наоборот, водосвязывающая способность на 40 % ниже.
Из технологических приемов большое влияние на функциональные свойства оказывает способ сушки и температурные режимы. Если сушка белок-липидных композитов проводится в виброкипящем слое инертного материала, то они имеют высокие жиросвязывающие свойства и не обладают жироэмульгирующими свойствами, а если продукты высушивают распылительным способом, то у них, наоборот, самые высокие жироэмульгирующие характеристики.
Чем выше были дозировки лецитина в составе композитов, тем лучше функциональные свойства. С повышением массовой доли лецитина повышаются водосвязывающая, жиросвязывающая способности — на 63–149 и 10–42 % соответственно, почти в 2 раза растворимость и на 8–38 % способность эмульгировать жир.
Функциональные свойства композитов, как и белковых препаратов, в значительной степени определяются особенностями физико-химических свойств белков. Чем больше в них содержится водо- и солерастворимых фракций, тем выше растворимость (r = 0,83); большему количеству дисульфидных связей (S—S) в них соответствует более высокая жиросвязывающая способность (r = 1,0).
В ходе изготовления белково-липидных композитов в процессе сушки при участии различных видов связей структура белков изменяется. Так, например, в композите, полученном из соевой муки, количество сульфгидрильных групп (–SH) меньше, чем в исходной муке, а в композите с белковой мукой из пшеничных отрубей, наоборот, — больше, следовательно, при изготовлении первого продукта образуются новые S–Sсвязи (табл. 20), а второго, наоборот, они разрываются. В композите, полученном на основе концентрата из пшеничных отрубей, ковалентные дисульфидные связи полностью отсутствуют.
Таблица 20. Содержание сульфгидрильных групп и дисульфидных связей в белковых продуктах (в мк-экв/г белка)
| Показатели | Соя | Пшеничные отруби | ||||
| Мука | Композит | Мука | Композит | Концентрат | Композит | |
| SН-группы
S—S-связи |
72,9
3,85 |
51,4
37,3 |
59,9
35,8 |
87,0
15,4 |
32,4
29,3 |
79,0
— |
Следовательно, эти результаты, а также данные определения агрегирующей способности белков позволяют заключить, что структура белков соевой муки в технологии изготовления композитов превращается в более «компактную» по сравнению с исходными белками, а белков муки и концентрата, полученных из пшеничных отрубей, наоборот, в более «рыхлую» с полным или частичным разрывом дисульфидных связей.
Наряду с ковалентными дисульфидными связями в структурной организации композитов принимают участие и нековалентные водородные, ионные, гидрофобные взаимодействия, количество которых зависит и от природы белка. Так, композиты из соевой муки содержат в 1,5–1,9 раза больше белков, соединенных водородными связями, в 3–4 раза больше белков с гидрофобными взаимодействиями и в 4,0–4,7 раза меньше белков с ионными связями.
Белковые композиты различного химического состава и разной структурной организации обладают полным набором функциональных свойств. Жироэмульгирующие свойства и водосвязывающая способность делают целесообразным применение их в изделиях эмульсионного и других типов (колбасные, кондитерские, хлебобулочные изделия, майонезы, пасты и т. д.), а хорошая пенообразующая способность благоприятна для приготовления сбивных, пенных изделий (десерты, бисквиты, муссы и т. д.).
Наряду с обогащением изделий качественным белком, биологически эффективным жиром, лецитином, витаминами и другими функциональными компонентами решаются проблемы улучшения технологических показателей качества изделий (пластичность, структурообразование, вязкоупругоэластичные свойства масс: тесто, молочные, мясные полуфабрикаты), замены дефицитного или дорогостоящего сырья и расширения ассортимента продукции с повышением пищевой и биологической ценности.
Присутствие белков в пищевых объектах устанавливается с помощью качественных реакций, которые условно разделяют на две группы: а) цветные реакции; б) реакции осаждения.
Среди первой группы различают универсальные реакции (биуретовая на пептидные связи, нингидриновая на α-аминокислоты) и специфические, обусловленные присутствием в белках остатков определенных аминокислот. Так, ксантопротеиновая реакция свидетельствует о наличии в белках остатков ароматических аминокислот, реакция Паули — гистидина и тирозина, Адамкевича и Вуазене — триптофана, нитропруссидная — цистеина, а реакция Сакагучи — аргинина. По результатам специфических реакций ориентировочно можно судить о пищевой ценности белков.
Во второй группе реакций белки осаждают действием солей, органических растворителей, концентрированных кислот, щелочей, ионов тяжелых металлов, температуры и в изоэлектрической точке. Белки в растворенном состоянии крайне неустойчивы, поэтому при добавлении органических растворителей (спирт, ацетон), концентрированных растворов нейтральных солей щелочных металлов и воздействии физических факторов (нагревание, облучение, ультразвук) гидратная оболочка разрушается и они выпадают в осадок.
Так как белковые вещества сырья (мука, крупа, молоко, мясо), включая ферменты, часто являются определяющими в обеспечении качества пищевых изделий, то для изучения физико-химических, биохимических и физиологических свойств этих соединений обязательным условием является получение белков в индивидуальном и по возможности неденатурированном состоянии. Белки обычно теряют природные (нативные) свойства (растворимость, гидратация, ферментативная активность и т. д.), подвергаясь денатурации под влиянием различных факторов. Типичным примером необратимой денатурации белков является выпадение их в осадок под действием трихлоруксусной кислоты (ТХУ). Длительный контакт со спиртом также приводит к необратимой денатурации белка. Денатурирующее действие различных факторов на белки можно смягчить, если проводить операции выделения при температуре не выше +4 °С.
Общая схема операций по выделению белков сводится к измельчению биологического материала (гомогенизации), экстрагированию и собственно выделению, то есть очистке и получению белка в индивидуальном состоянии. При изучении метаболических процессов в живых организмах, таких как созревающие плоды, зерно, овощи и т. д., морфологическую и биохимическую целостность клеток и тканей сохраняют в максимальной степени, а при исследовании сырья и пищевых продуктов потерю целостности структуры считают менее существенной. Гомогенизацию объектов рассматривают как начальную стадию выделения белков, но способ ее определяется постановкой задачи. Например, анализ ферментов из растительных материалов часто затруднен тем, что при гомогенизации экстрагируется большое количество фенолов, которые взаимодействуют с карбонильными группами пептидных групп при помощи водородных связей и вызывают денатурацию белка и потерю ферментами своей активности. Добавление в экстракт поливинилпирролидона, образующего с фенолами нерастворимые комплексы, предотвращает инактивацию ферментов.
Разрушение клеточной структуры осуществляется тщательным измельчением материала в гомогенизаторах, мельницах, попеременным замораживанием и оттаиванием, применением ультразвуковых высокочастотных колебаний, пресс-методов с использованием высоких давлений и метода «азотной бомбы». В последнем случае клетки насыщаются азотом под давлением, которое затем сбрасывается и клетки разрушаются. Эффективность гомогенизации зависит не только от способа разрушения клеточных структур, но и от вида анализируемого материала. Животные клетки разрушаются относительно легко, особенно в отсутствии сосудистой и соединительной ткани, тогда как растительные и микробные — из-за присутствия клеточных стенок — трудно. В таком случае применяют методы растирания материала с твердыми веществами (песок, абразивный порошок) или обработку клеточных стенок лизоцимом или ферментными препаратами, содержащими целлюлазу, хитиназу и липазу. Гомогенизацию рекомендуется проводить в холодных комнатах или с использованием льда.
Экстракция белков может быть совмещена с гомогенизацией клеток и тканей либо проведена отдельно, если продукт заранее измельчен. Для определения ферментативной активности белка достаточно одноразовой экстракции, тогда как для количественного определения белковых фракций зерна — трехили пятикратной. Условия экстрагирования белков (время, гидромодуль, температура и т. д.) подбираются эмпирически, основываясь на методиках ведущих научных школ.
Большинство белков животных тканей хорошо растворимы в 5– 10 %-ных растворах солей, тогда как для перевода в раствор белков зерновых культур применяют более широкий набор растворителей. Для этого используются буферные системы со значениями рН от кислых до слабощелочных (фосфатные, боратные, цитратные, трис-HCl), органические растворители и неионные детергенты, разрывающие белок-липидные или белок-белковые связи:
Растворители подбираются с учетом разрыва в белках определенных типов связей. Так, уксусная кислота ослабляет ионные связи, сообщая молекулам одноименные положительные заряды, мочевина — водородные и гидрофобные, салицилат натрия и ДДС-Na — гидрофобные, ионные, а водные растворы спиртов — водородные, гидрофобные взаимодействия. Органические растворители разрывают белок-липидные связи.
При изучении физико-химических свойств белков и их превращений в пищевых системах широко используют методы фракционирования и очистки от небелковых соединений. Они основаны на различиях таких свойств белков, как размер молекул, растворимость, заряд и сродство к специфическим химическим группам.
Осаждение белков из раствора под действием солей щелочных и щелочноземельных металлов называют высаливание м. Для высаливания чаще применяется сульфат аммония, под влиянием которого белки, как правило, сохраняют растворимость и ферментативную активность. Главную роль при высаливании играет не природа солей, а валентность ионов, действие которых оценивается по ионной силе ():
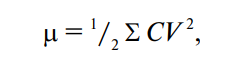
где С — концентрация каждого вида иона; V — валентность ионов.
Глобулины выпадают в осадок при 50 %-ном насыщении, альбумины — при 100 %-ном насыщении растворов солей, а при ступенчатом фракционировании (20–100 % насыщения) выпадают белки и других классов (проламины, глютелины).
В практике выделения и очистки белков используются различные типы хроматографии: адсорбционная, распределительная, ионообменная и хроматография по сродству. А дсорбционная хроматография основана на различиях в полярности белков. В колонке вместе с буферным раствором упаковывают адсорбент, на который в небольшом объеме растворителя наносят исследуемый образец. Компоненты разделяемой смеси адсорбируются, затем элюируются с помощью буферного раствора с увеличивающейся концентрацией или полярностью. Фракции белка собирают с помощью автоматического коллектора фракций.
В распределительной хроматографии, в отличие от адсорбционной, в качестве неподвижной фазы выступает водный слой, удерживаемый твердой фазой (силикагель, бумага). Разделяемые вещества многократно распределяются между водным слоем и движущейся фазой растворителя и с разной скоростью перемещаются по длине колонки или по бумаге. Распределительную хроматографию на бумаге часто используют для анализа пептидов и аминокислот. Адсорбентом служат нити целлюлозы, а растворителем — смесь органических растворителей, например: бутиловый спирт — уксусная кислота — вода. Хроматограмму проявляют, высушивают и анализируют местонахождение разделяемых компонентов тем или иным способом.
Методом и онообменной хроматографии белки или аминокислоты разделяют на основе различий в общем заряде молекул. Если белок в нейтральной среде (рН 7) имеет положительный заряд, то он связывается на колонке с ионообменником, содержащим фенольные, сульфо- и карбоксильные группы (катионообменник), а если отрицательный, — на колонке с ионообменником, представленным аминами или органическими основаниями (анионообменник). Чаще всего для фракционирования белков используют производные полистирола и целлюлозы:
Положительно заряженный белок снимается с колонки с помощью раствора хлорида натрия или изменением рН элюирующего буфера. При этом ионы натрия конкурируют с положительно заряженными группами белков. Белки с меньшим положительным зарядом вымываются с колонки первыми, с бо´льшим зарядом — последними.
Хроматография по сродству (афинная хроматография) основана на принципе избирательного связывания белков со специфическими веществами (лиганды), прикрепленными к носителю. Лиганд (глюкоза) ковалентно присоединяют к носителю (проводят иммобилизацию) и наносят на колонку исследуемую белковую смесь. Специфические белки связываются с лигандом, а несвязавшиеся удаляют соответствующим буфером. С лиганда белок элюируют раствором, содержащим глюкозу в очень высокой концентрации. При этом в молекуле белка остатки глюкозы, присоединенные к колонке, замещаются на глюкозу, находящуюся в растворе (рис. 20).
Гель-филь трация, или метод молекулярных си т, заключается в пропускании белков через колонку с гелем сефадекса или других типов (агарозные, полистирольные). Применяются также пористые стеклянные шарики и пористый кварц (порасил). Наибольшее распространение получили декстрановые гели (сефадекс), являющиеся продуктом поперечного сшивания полисахаридных цепочек декстрана. Зерна сефадексов разных номеров содержат поры разных размеров, в которые могут
\ 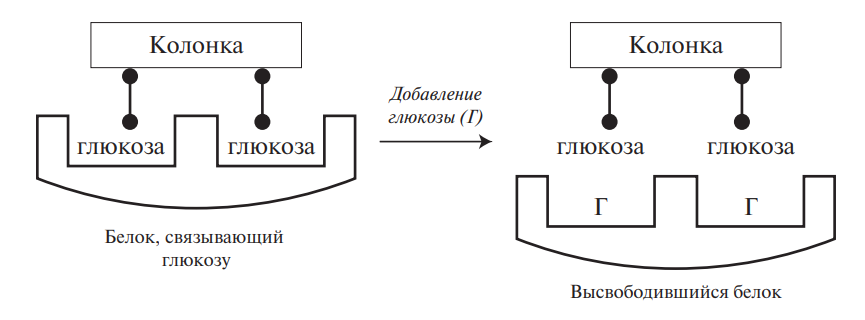
Рис. 20. Хроматография по сродству (афинная хроматография)
проникать белки с определенной молекулярной массой. Низкомолекулярные белки распределяются в растворенном виде как внутри частиц полимера, так и между ними, а высокомолекулярные — только между частицами, поэтому вторые быстрее проходят через колонку и первыми вытекают из нее (рис. 21). В итоге белки распределяются по молекулярной массе и могут быть собраны в виде отдельных хроматографических фракций (рис. 22).
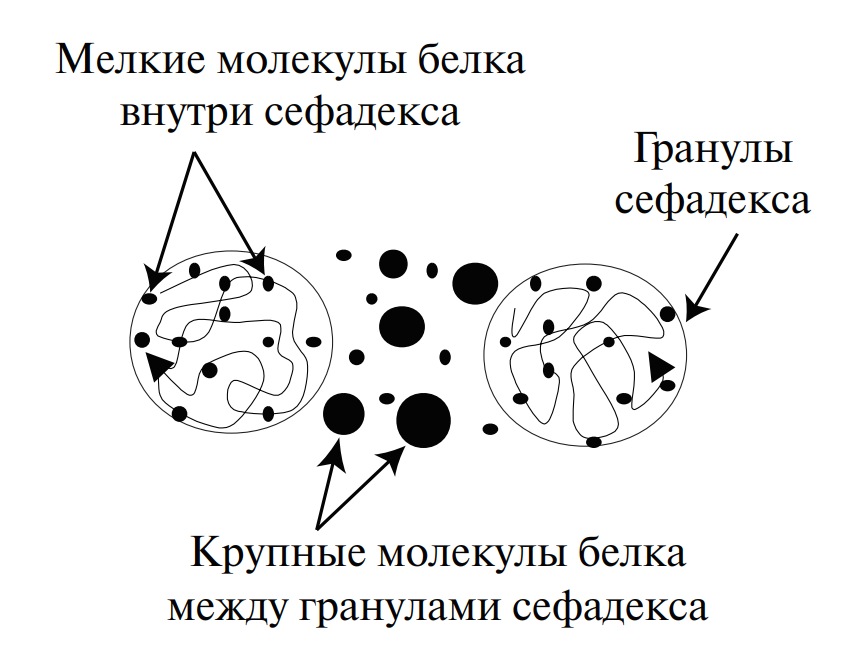
Рис. 21. Распределение молекул белка среди гранул сефадекса
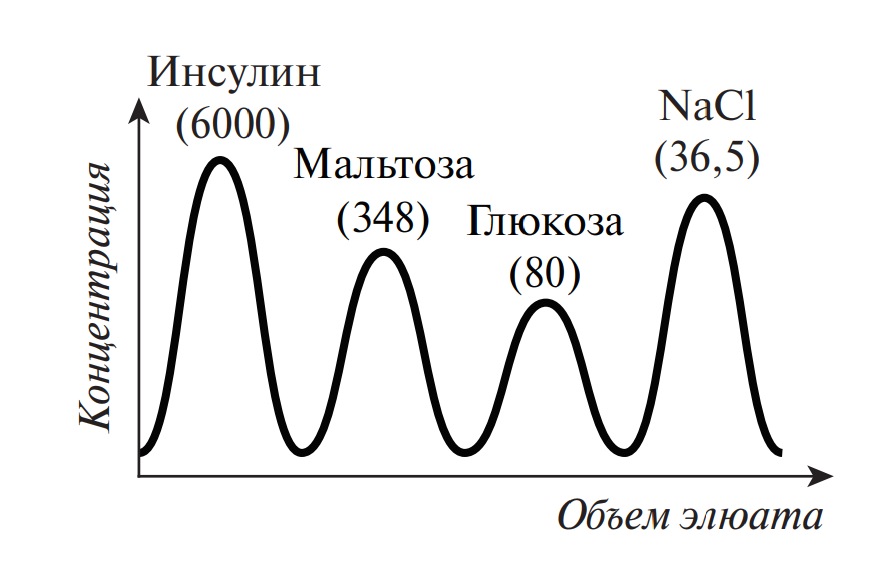
Рис. 22. Картина распределения смеси веществ, различающихся по молекулярным массам, при методе гель-фильтрации
Принцип методов электрофоретического разделения заключается в способности молекул пептидов и аминокислот, находящихся в заряженной форме в виде катионов (+) или анионов (–), передвигаться в электрическом поле с определенной скоростью. Кроме того, молекулы с близкими зарядами, но разными размерами, отличаются отношением заряда к массе. Все эти различия и обусловливают высокую разрешающую способность электрофоретических методов. Скорость миграции белков в электрическом поле (v ) зависит от напряжения электрического поля (), заряда белков (z) и сопротивления трения ( f ). Сопротивление трения определяется размерами, формой белка, значениями рН и концентрацией буфера. Указанные величины связаны между собой соотношением
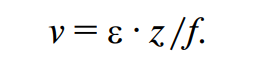
Впервые метод электрофореза был разработан Тизелиусом с применением бумаги в качестве носителя и специальных оптических устройств, регистрирующих передвижение границы раздела раствора белка и растворителя по показателям преломления (фронтальный электрофорез). В настоящее время распространены методы зонального электрофореза, предусматривающие использование крахмальных и полиакриламидных гелей (ПААГ). Наиболее распространенным методом фракционирования белков является диск-электрофорез (от англ. discontinuous прерывистый) в ПААГ, при котором используется пара буферных растворов с различными значениями рН в присутствии ДДС-Na и гели различной пористости (концентрирующие и разделяющие) (Laemmli, 1970). Для обнаружения белков гели обрабатывают красителями: амидовым черным 10В, кумасси синим R-250. Интенсивность окраски, а по ней и количественное содержание белковых фракций определяют сканированием на денситометре. Для электрофоретического разделения белков и пептидов успешно применяется двумерный электрофорез в ПААГ. В соответствии с этим методом смесь компонентов разделяют сначала в столбиках геля электрофорезом в горизонтальном направлении, затем в гелевых пластинах — в вертикальном (рис. 23). При разделении белков, например гороха, этим методом удалось получить более 150 различных компонентов.
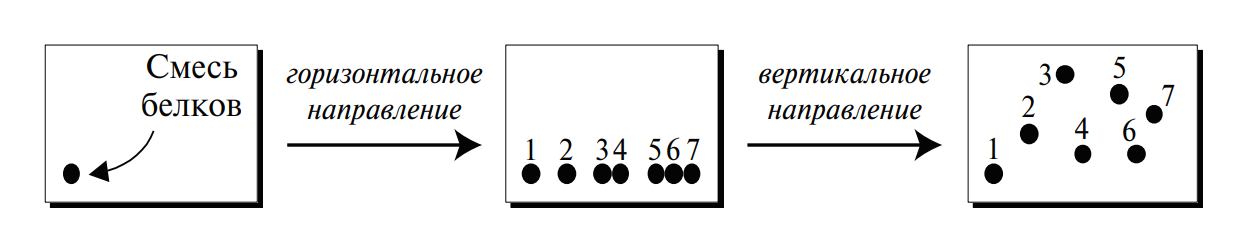
Рис. 23. Двумерный электрофорез
Очень высокую разрешающую способность имеет метод изоэлектрического фоку сирования белков, в основе которого лежит фронтальный электрофорез, проводимый на колонке одновременно в градиенте рН и напряжения. Колонку предварительно заполняют носителями с синтетическими смесями полиаминополикарбоновых кислот (амфолиты), затем сверху в нее подают раствор сильной кислоты, снизу — сильнощелочной раствор для того, чтобы установить градиент рН с крайними значениями, соответствующими рН кислого и щелочного растворов. Амфолиты прекращают движение по колонке, когда их суммарный заряд становится равным нулю, и тем самым стабилизируют исходный градиент рН. В подготовленную колонку вносят образец исследуемой смеси, компоненты которой распределяются по зонам со значениями рН, характерными их изоэлектрическим точкам.
В химии пищевого белка применяют и другие разновидности электрофоретического разделения (и ммуноэлектрофорез, изотахофорез ), а также метод пептидных карт и уль трацентрифугировани е. Метод пептидных карт (отпечатков пальцев) относится к методам двумерного разделения и наиболее часто используется для анализа пептидов. Пептиды получают избирательным гидролизом белков, затем на бумаге их разделяют в горизонтальном направлении электрофорезом, в вертикальном — распределительной хроматографией. Пептиды окрашивают нингидрином, элюируют и определяют аминокислотный состав.
В методе ультрацентрифугирования белки в градиенте плотности распределяются на разных уровнях центрифужной пробирки в процессе седиментации (осаждение) в виде отдельных зон. Для создания градиента используют соли тяжелых металлов и растворы сахарозы. Метод широко применяется для определения молекулярных масс белков по константе седиментации (S), которая зависит от массы и формы белковых частиц:
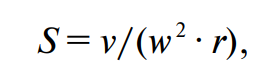
где v — скорость перемещения границы растворитель–белок, см/с; w — угловая скорость ротора, рад/с; r — расстояние от центра ротора до середины ячейки с раствором белка.
Величина S, равная 1 · 10–13 c, принята за единицу и названа сведбергом — в честь Т. Сведберга, впервые сконструировавшего ультрацентрифугу. Очистка белков от низкомолекулярных соединений (соли, сахара, аминокислоты) осуществляется методами диализа, гель-фильтрации на сефадексе G-25, кристаллизации, ультрафильтрации и с помощью полых волокон. При диализе используют полупроницаемые мембраны (целлофан, коллодийная пленка), через которые белки не диффундируют и остаются внутри диализного мешочка. Более мелкие молекулы проходят через поры диализной мембраны и выходят в диализат. В методе ультрафильтрации, который применяется, например, в производстве сывороточных белков молока, соевых белковых изолятов, по обе стороны мембраны создается разность давлений за счет продавливания фильтруемого белкового раствора. В качестве мембран используются целлюлозные пленки и нецеллюлозные полиэлектролитные комплексы. Аналогично мембранам по принципу молекулярного сита действуют и полые волокна. Белковый раствор помещается с внешней стороны волокон, и создается разность давления за счет повышения его в растворе или понижения внутри их.
Гомогенность белка определяется на последнем этапе выделения и очистки с применением по меньшей мере двух методов. Наиболее достоверными являются ультрацентрифугирование в градиенте плотности, диск-электрофорез в ПААГ, иммунохимические методы, растворимость. Если белок при электрофорезе представлен только одной полосой и обладает при этом максимальной биологической активностью, то он считается гомогенным. Для гомогенного белка на кривой растворимости (зависимость растворенного белка от общего его количества в постоянном объеме растворителя) имеется только один перегиб, тогда как для гетерогенного — столько, сколько в нем индивидуальных компонентов. Содержание белка в пищевых объектах обычно определяют по количеству азота с использованием метода, предложенного Кьельдалем еще в 1883 г. С целью упрощения и сокращения длительности анализа этот метод неоднократно модифицировался с применением различных катализаторов и условий минерализации. На основе модифицированных методов созданы высокопроизводительные автоматические анализаторы типа «Кьельфос», «Кьельтек», стоимость определения содержания белка на которых сегодня остается высокой. Существует и некоторая условность при расчете количества белка, заключающаяся в использовании переводного коэффициента. Однако, несмотря на недостатки, метод Кьельдаля является унифицированным, он включен в ГОСТы на многие пищевые продукты.
Для перевода количества азота в содержание белка используют коэффициент 6,25. Принят он потому, что большинство белков содержит 16 % азота (100/6,25 = 16). Однако более правильным является использование коэффициентов, соответствующих фактическому содержанию сырого белка в каждом его виде. Так, для пшеницы получен коэффициент 5,7, так как ее белки содержат 17,5 % азота. Для других белковых ресурсов коэффициенты перевода приняты следующими: 5,7 — рожь, ячмень, овес, семена подсолнечника; 5,8 — соя; 6,25 — кукуруза, мясо; 6,38 — молоко.
Имеются и другие методы определения азота, такие как метод Дюма, нейтронно-активационный и с фенолятгипохлоритом на приборе «Техникон». Принцип метода Дюма заключается в разложении органического соединения в атмосфере оксида углерода до газообразного состояния с последующим измерением объема азота (N2). В нейтронно-активационном методе атомы азота образца бомбардируются нейтронами в ядерном реакторе с получением изотопа 13N. Содержание белка рассчитывают по количеству гамма-лучей. Определение азота на приборе « Техникон» осуществляется колориметрическим способом, в котором измеряется интенсивность сине-голубой окраски, образующейся по реакции взаимодействия сульфата аммония, выделяющегося в процессе минерализации образца, с щелочным раствором фенола и гипохлорита. Все описанные здесь методы по точности анализа не уступают методу Кьельдаля, однако они дорогостоящие.
Широкое распространение получил метод инфракрасной спектроскопи и, в основе которого лежит поглощение белками света с определенной длиной волны и измерение интенсивности его отражения в приборах-анализаторах. Приборы калибруют по образцам зерна (эталоны) с известным содержанием белка, который определяют по методу Кьельдаля.
Известны методы количественного определения белка, основанные на помутнении (нефелометрический метод), способности белков адсорбировать красители (кумасси синий R-250, амидовый черный и др.), преломлять лучи света (по показателю преломления) и вступать в реакции с образованием окрашенных растворов. Они характеризуются высокой точностью, простотой определения, хотя имеют ряд ограничений. Наиболее удобными являются методы с кумасси синим, биуретовый и Лоури. В основе биуретового метода лежит биуретовая реакция, в основе метода Лоури — восстановление фосфомолибденовой кислоты остатками тирозина и триптофана с одновременным протеканием биуретовой реакции. По оптической плотности, с использованием калибровочных графиков, находят концентрацию белка в растворах.